二酰甘油酰基转移酶(DGAT)是三酰甘油(TAG)合成途径的限速酶, 对脂肪酸合成的调节具有关键作用。为了研究 AhDGAT2a的表达调控, 利用GenomeWalking方法从鲁花14基因组中克隆了 AhDGAT2a上游5°侧翼调控区1200 bp序列, 即 AhDGAT2a启动子(pAhDGAT2a)序列, 并利用生物信息学软件分析其包含的调控元件, 发现其含有多个TATA-box和CAAT-box、光调控元件、胁迫防御相关元件和激素响应元件。用pAhDGAT2a构建pAhDGAT2a:GUS植物表达载体并转化烟草品种SR1。利用组织染色法鉴定转基因烟草的GUS表达模式, 发现在转基因烟草的各个器官均有GUS酶活, 在柱头、花药和幼嫩种子中表达量较高, 说明pAhDGAT2a具有一定的组成型启动子活性。
Diacylglycerol acyltransferase (DGAT) is a rate-limiting enzyme in triacylglycerol (TAG) biosynthesis pathway. In this study, GenomeWalking method was used for cloning the promoter sequence of AhDGAT2a gene from Luhua 14, and finally a 1200 bp fragment flanking 5′-upstream of AhDGAT2a was obtained and named as pAhDGAT2a. The crucial regulatory elements in pAhDGAT2a were further analyzed with software PlantCARE. There were many TATA-box, CAAT-box, light regulation, stress and defense response and hormone response elements. To assess the activity of pAhDGAT2a, we constructed pAhDGAT2a:GUS cassettes and introduced it into the tobacco SR1 genome by Agrobacterium-mediated transformation. Expression pattern was monitored by histochemical staining. Results showed that GUS activity driven by the pAhDGAT2a was detected in almost all vegetative and reproductive tissues, with a higher expression level in stigma, anther and young seeds than in the other organs, indicating that pAhDGAT2a has a constitutive promoter activity.
植物油是食用油的主要来源, 约占全世界脂类消耗的75%[1]。植物油是由脂肪酸和甘油化合而成的天然化合物。脂肪酸, 是指一端含有一个羧基的长的脂肪族碳氢链, 是机体主要能量来源之一。植物油的不饱和脂肪酸含量比较高, 作为食用油, 可以降低人体血液中胆固醇的含量, 降低动脉硬化发生的几率[2]。三酰甘油(triacylgycerol, TAG)是大多数植物和动物体内最重要的油脂贮藏形式, 具有重要的社会经济价值。酰基辅酶A:二酰甘油酰基转移酶(acyl-CoA diacylgycerol acyltransferase, DGAT)是一种内质网细胞微粒体酶, 其主要作用是催化二酰甘油(diacylglycerol, DAG)加上酰基脂肪酸形成TAG[3]。该基因不仅与脂肪酸合成相关, 在种子萌发和叶片衰老等过程中也有一定的作用[4, 5, 6, 7]。
1956年DGAT基因首次被发现[8], 并很快引起研究人员的广泛关注。根据结构和细胞定位的差异, DGAT被分为DGAT1、DGAT2、WS/DGAT和胞质DGAT四种类型[9, 10]。DGAT1属于包括酰基辅酶A胆固醇酰基转移酶ACAT1和ACAT2在内的膜结合酰基转移酶(membrane-bound O-acyltransferases, NBOAT)家族的一部分[11]。DGAT2是一个蛋白超级家族, 在动物[12]、植物[13]和酵母[14]中都存在, 但是与DGAT1蛋白家族没有明显的相关性。WS/DGAT和胞质DGAT是近几年发现的DGAT基因家族的新成员, 目前相关研究较少。胞质DGAT (Cyto DGAT)是从花生未成熟种子中获得的一类新型二酰甘油酰基转移酶基因[9], 该基因没有跨膜结构, 与WS/DGAT具有13%的一致性, 与DGAT1和DGAT2家族具有不到10%的相似性。DGAT1和DGAT2大多被定位于内质网[15, 16], 而胞质DGAT是一种定位于细胞质中的可溶性蛋白[9]。
DGAT1和DGAT2对于种子油脂合成非常重要[17, 18], 是Kennedy途径中唯一的限速酶。在拟南芥中过量表达DGAT1基因可使种子含油量显著提高, 而且可使转基因拟南芥种子内的DGAT活性比野生型提高10%~70% [19]。在玉米中过量表达DGAT1不仅可使转基因玉米种子含油量提高, 而且改变了油脂组成[20]。DGAT2在大豆等转基因油料作物中过量表达均能提高种子的含油量[21, 22]。
DGAT基因一直是油料作物的研究热点。花生在我国的种植面积已超过460万公顷, 总产量居世界首位[23]。花生籽仁粗脂肪含量50%左右, 仅次于芝麻[24]。由于DGAT在植物种子发育过程中影响种子油分含量、脂肪酸组成等, 对于油料作物花生DGAT的研究具有重要经济意义。目前花生的DGAT基因也有一些研究成果[9, 25, 26, 27], 但是对DGAT基因启动子的研究却很少。
我们前期从花生中克隆得到了AhDGAT2a基因(GenBank登录号为JF897614), 该基因编码区为1005 bp, 将该基因在烟草中过表达, 发现其能改变转基因烟草叶片的总脂肪酸含量和组成[25]。将AhDGAT2a基因在大肠杆菌Rosetta (DE3)表达, 能使大肠杆菌的体积增大2.4~2.5倍, 同时提高大肠杆菌的总脂肪酸含量[26]。为进一步研究AhDGAT2a基因的表达模式和基因组信息, 我们通过GenomeWalking方法从花生中克隆了AhDGAT2a基因的启动子序列(pAhDGAT2a), 并通过农杆菌介导的遗传转化法转化烟草进行功能验证。这为我们研究植物DGAT2的功能和油料作物TAG的合成及调控提供了依据, 为我们培育油料作物新品种奠定了基础。
花生品种鲁花14由实验室保存, 室内培育后取幼叶, 液氮速冻保存在-80℃。烟草品种SR1由实验室保存。大肠杆菌(Escherichia coil) DH5α , 根癌农杆菌(Agrobacterium tumefaciens)菌株LBA4404, 表达载体pCAMBIA2301均由本实验室保存。
材料基因组DNA提取试剂盒、凝胶回收试剂盒和质粒DNA提取试剂盒为TIANGEN公司产品。Genome Walking试剂盒购自TaKaRa。T4 DNA连接酶及限制性内切酶购自Fermentas。其他化学试剂为国药产品。引物合成和测序由生工生物工程(上海)股份有限公司完成。
pAhDGAT2a的克隆按照GenomeWalking试剂盒进行3轮扩增。用到的引物SP1: 5° -GGAGAGAGGTAGAA AGAGAAG-3° , SP2: 5° -CGCAAGCGCCAGCGTCGTTTT GAAGC-3° , SP3: 5° -CCGCCGGCGGCGCCACCGTGACG TT-3° 从上海生工合成。反应体系含基因组DNA 1 µ g、2.5 mmol L-1 dNTPs混合物8 µ L、10× LA PCR buffer II 5 µ L、5 U TaKaRa LA Taq 0.5 µ L、100 µ mol L-1 AP1 Primer 1 µ L、10 µ mol L-1 SP1 Primer 1 µ L, ddH2O加到总体积50 µ L。反应条件为94℃ 1 min, 98℃ 1 min, 5个循环的94℃ 30 s, 65℃ 1 min, 72℃ 2 min, 然后94℃ 30 s; 25℃ 3 min; 72℃ 2 min, 15个循环的94℃ 30 s; 65℃ 1 min; 72℃ 2 min; 94℃ 30 s; 65℃ 1 min; 72℃ 2 min; 94℃ 30 s; 44℃ 1 min; 72℃ 2 min, 最后72℃延伸10 min。第1轮产物稀释100倍后取1 µ L作为第2轮模板, 以AP1 Primer为上游引物, SP2为下游引物, 其余同第1轮扩增体系。反应条件为15个循环的94℃ 30 s; 65℃ 1 min; 72℃ 2 min; 94℃ 30 s; 65℃ 1 min; 72℃ 2 min; 94℃ 30 s; 44℃ 1 min; 72℃ 2 min, 最后72℃延伸10 min。第2轮产物稀释100倍后取1 µ L作为第3轮模板, 以AP1 Primer为上游引物, SP3为下游引物其余同第1轮扩增体系, 反应条件同第2轮。第2轮和第3轮PCR产物经琼脂糖凝胶电泳检测, 回收纯化目的条带, 连接到pMD18-T载体测序。测序完成后用PlantCARE软件分析其调控元件。
将得到的pAhDGAT2a序列用引物PD2F/PD2R扩增, 引物序列为PD2F: 5° -TCTAGAACGACTGCCACATTATA CATTCTAGC-3° , PD2R: 5° -CCATGGTTTGGATTCGGTGG CTGTTG-3° , 引物两侧分别添加Xba I和Nco I酶切位点。提取花生幼叶的基因组DNA, 用基因组DNA为模板进行PCR扩增, 得到的序列进行双酶切, 利用T4连接酶连接到pCAMBIA2301载体, 替换pCAMBIA2301载体上的CaMV35S启动子。连接体系为PCR片段6 µ L, 载体DNA 2 µ L, 10× T4连接酶1 µ L, T4 DNA连接酶1 µ L。上述体系于16℃过夜连接, 连接体系转化大肠杆菌DH5α 感受态, 测序确定pAhDGAT2a:GUS表达载体构建成功。将构建好的pAhDGAT2a:GUS表达载体转化农杆菌LBA4404感受态细胞, 挑取单菌落进行PCR验证, 阳性克隆保存菌液待用。
烟草种子经75%乙醇和次氯酸钠消毒, 无菌水洗净后播于1/2 MS0基本培养基上生长4~5周, 利用叶盘法转化烟草。将携带pAhDGAT2a:GUS表达载体的农杆菌于28℃, 200转 min-1振荡培养至对数生长期。取烟草叶片, 剪成小块(0.5 cm × 0.5 cm)置MS0重悬的菌液中15 min, 取出后用无菌滤纸吸干水分。在MS分化培养基上暗培养2 d后取出, 于MS选择培养基(含100 mg L-1 kanamycin)上诱导长出丛生芽, 将丛生芽切下放入伸长培养基长至3~5 cm时, 转移到生根培养基使其生根。将生根后的幼苗移入盛有无菌土的花盆, 温室常规管理。
利用CTAB法提取转基因烟草叶片的DNA, 利用引物PD2F/PD2R进行PCR检测。将阳性烟草的幼苗和其他组织器官加入GUS染液, 37℃保温16 h。用70%乙醇冲洗浸泡, 在体视解剖镜下观察染色情况并照相。
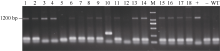
利用GenomeWalking试剂盒, 经过3轮扩增得到pAhDGAT2a的核苷酸片段(图1), 长度1200 bp左右。将该序列连接到pMD18-T载体上测序表明, 该序列为AhDGAT2a基因的启动子序列。
PlantCARE分析显示该序列含有126个TATA-box和22个CAAT-box元件, 符合启动子的一般特点。该启动子序列含有多个与胁迫和防御相关的顺式作用元件, 主要包括一个参与干旱应答反应的MBS元件, 3个参与高温应答反应的HSE元件, 2个参与胁迫和防御应答反应的TC-rich repeats。另外还含有3种激素应答元件, 包括2个激素应答元件TGA-元件, 2个茉莉酸应答元件CGTCA- motif和TGACG-motif, 一个赤霉素应答元件GARE- motif。该启动子还含有真菌激活子应答元件W1-box及一些光应答元件(Sp1、I-box、GT1-motif、ACE和MNF1)。这表明AhDGAT2a的表达调控可能受多种因素的影响。
先利用卡那霉素初步筛选, 再利用PCR方法检测转基因烟草株系(图2)。结果表明, 有14个株系在1200 bp左右出现条带, 该片段与目的条带大小一致, 表明我们得到了阳性转基因烟草株系。
TAG是大多数植物和动物体内最重要的油脂贮藏形式, DGAT是TAG合成反应的限速酶, 对于种子油脂合成非常重要[17, 18]。在拟南芥等多种植物中过量表达DGAT基因均能显著提高种子的含油量[17, 19, 28, 29, 30]。我们实验室前期从花生中克隆得到了DGAT2基因, 将其与CaMV35S启动子相连接, 构建植物表达载体转化烟草并对其进行了功能验证, 发现其能提高转基因烟草的总脂肪酸含量[25]。
启动子是一段位于结构基因5° 端上游区的DNA序列, 能够使RNA聚合酶与之结合并起始目标基因转录, 是转录水平上基因表达调控的关键部位。启动子上的顺式作用元件通常含有TATA-box、CAAT-box和GC-box元件, 其中TATA-box是启动子上最具特征的序列。本研究的pAhDGAT2a中含有126个TATA-box和22个CAAT-box元件, 表明其具有典型启动子的特征。
不同的启动子都具有自己特异的调节序列, 如USE、MSP等。大多数绿色植物都包含若干个光应答元件(light response element), 如G-box[31, 32]、I-box[31]、GT1元件(或GATA元件)[33]、AT富含元件[34, 35]、Z-box[36]等, 这些作用元件对光调控的转录激活是必需的[37]。在pAhDGAT2a中也含有一些光应答元件, 而前期研究表明AhDGAT2基因在花生叶片中具有一定的表达量[25], 这些结果表明AhDGAT2的表达调控可能会受到光信号的影响。pAhDGAT2a还包含激素响应元件和胁迫诱导元件, 预示AhDGAT2a的表达受激素诱导, 并且在胁迫响应中起一定的作用。我们前期分析了AhDGAT2基因在不同胁迫(冷、干旱、盐、紫外照射、ABA、机械损伤和病害)下的表达模式, 结果表明AhDGAT2基因在受到机械损伤时表达下调最明显, 在冷、干旱、盐和紫外照射胁迫下表达量略有下降, 而在ABA处理和病害胁迫下表达显著上调[25]。这恰好与pAhDGAT2a含有多种胁迫相关元件相吻合。在他人研究中也有类似报道, 如麻风树的种子特异性启动子JcMFT1受脱落酸诱导, 是由于其含有ABA应答元件、G-box、RY repeat等元件[38]; Xu等[39]在中国华东野生葡萄中克隆了一个受白粉病和赤星病诱导表达的VpSTS诱导型启动子, 通过序列分析发现该启动子含有Box-W1、TC-rich element、ABRE、MBS、LTR等特殊元件。
目前关于植物DGAT1基因组织特异性表达的研究有较多报道, 而关于植物DGAT2基因的组织器官特异性表达的研究较少。普遍认为大多数高等植物的DGAT1基因在各组织器官中均表达, 而DGAT2则与植物种子中特殊脂肪酸的积累有关。拟南芥DGAT1在发育中的种子、花瓣、花芽中表达量高, 而在叶和茎中表达量低[19], 大多数双子叶植物例如大豆、斑鸠菊、油菜的表达模式与拟南芥相似[14, 17, 40], 而旱金莲DGAT1只在发育的种子中表达[41]。桐树DGAT2基因在种子发育中期被较强诱导表达, 而在其他器官中表达量很低, 表明桐树DGAT2与种子中脂肪酸积累直接相关[28]。斑鸠菊、大戟、琉璃苣和蓖麻的DGAT2基因在种子发育早期高表达, 而大豆DGAT2基因在种子中的表达量很低。相反, 大豆DGAT1基因在种子中表达量较高[42]。我们前期关于AhDGAT2基因组织器官特异性表达模式研究表明, 该基因在花生的各个器官都表达, 但是在叶、花以及种子发育前期表达量较高[25]。本研究中将pAhDGAT2a构建GUS植物表达载体并转化烟草, 结果发现该序列不仅能正确启动GUS基因表达, 而且在转基因烟草的各个器官中都表达, 与我们前期研究结果一致, 但是与桐树DGAT2和大豆DGAT2的表达特点显著不同。本研究中GUS活性在转基因烟草柱头和花药中较强表达, 显示出AhDGAT2a基因在花生授粉中的重要性, 这一点在其他文献中未见报道。这些研究均表明, DGAT1与DGAT2基因的组织器官特异性表达模式因物种而异。二者不仅在植物种子脂肪酸合成中具有重要作用, 同时对于其他组织器官内的脂肪酸合成(比如维持细胞膜脂类的动态平衡), 甚至对于植物个体的整个发育过程都具有十分重要的作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|