*通讯作者(Corresponding author): 董志强, E-mail: dongzhiqiang@caas.cn, Tel: 010-82106043
第一作者联系方式: E-mail: liguangyan5112@126.com
以中单909和吉单35为材料, 设置乙矮合剂和聚糠萘合剂双重化控处理, 研究玉米穗位叶和籽粒中蔗糖代谢相关酶活性的动态变化, 探讨双重化控调控玉米碳代谢的生理机制, 为建立玉米高产稳产的化学调控技术提供理论基础。结果表明, 双重化控提高了灌浆期穗位叶蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)的活性, 尤其显著提高灌浆后期(花后50 d)蔗糖合成能力, 提高灌浆前期(花后10~20 d)穗位叶蔗糖含量, 降低后期(花后30~50 d)蔗糖含量。双重化控处理对玉米籽粒蔗糖合成酶(合成方向)和蔗糖磷酸合成酶活性的影响较小, 蔗糖合成酶分解方向活性呈升高趋势; 中单909籽粒蔗糖含量灌浆前期(花后10 d)升高, 灌浆后期(花后50 d)降低, 花后20~40 d影响不显著, 吉单35籽粒蔗糖含量花后10~20 d降低, 30~40 d升高, 50 d没有显著差异。双重化控处理提高了中单909和吉单35灌浆中期和灌浆中后期灌浆速率, 使两品种粒重和产量均显著提高, 分别比对照增产4.61%和7.78%。本研究说明, 乙矮合剂和聚糠萘合剂双重化控处理可通过调控源库蔗糖代谢关键酶的活性, 促进蔗糖在源端的合成和在库端的降解, 从而促进碳同化物向籽粒的转运, 达到高产。
In order to explore the new cultivation techniques, chemical control was established in this study. We conducted a field experiment using two varieties of Zhongdan 909 and Jidan 35 with treatments of leaf-spraying ethylene-chlormequat-potassium (ECK) in V6 and PASP-KT-NAA (PKN) in V9. The results showed that ECK & PKN increased the activities of sucrose synthetase (SS) and sucrose phosphate synthetase (SPS) and sucrose content during early grain filling stage (10-20 d after anthesis) in ear leaf, and decreased sucrose content in ear leaf during late grain filling stages (30-50 d after anthesis), especially it improved the ability of sucrose synthesis at the late filling stage (50 d after anthesis). ECK & PKN also decreased SS (synthesis) activity in grain during middle and late grain filling stages and increased SS (resolving) activity, promoting sucrose decomposition ability, with less effect on SS (synthesis) and SPS activities in grain. The yields of Zhongdan 909 and Jidan 35 compared with their own control were respectively increased by 4.61% and 7.78%. The study indicated that ECK & PKN enhance sucrose synthesis in leaf and decomposition ability in grain, and promote the translocation of carbon assimilation to grain, resulting in high grain-filling rate, high grain weight, and high yield.
作物高产不仅需要功能叶片强大的光合生产能力, 而且需要光合产物合理的运输分配[1]。蔗糖是重要的光合产物, 为植物体内运输的主要物质, 又是碳水化合物积累和贮藏的主要形式, 此外, 它还是细胞代谢的调节因子, 可能通过影响基因表达发挥作用[2, 3]。蔗糖的代谢是一个复杂的过程, 受多种因素的影响。与蔗糖代谢和积累密切相关的酶主要有转化酶(Inv)、蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS), 温度、密度、激素等因素主要通过影响蔗糖代谢相关酶活性间接影响蔗糖代谢与积累。赵福成等[4]研究发现高温降低甜玉米SPS和SS合成活性, 提高SS分解活性, 导致糖分含量降低品质变劣; 覃鸿妮等[5]和赵宏伟等[6]认为高密度不利于玉米功能叶中蔗糖合成; 王俊忠等[7]和曹玉军等[8]研究发现施氮量和施钾量影响功能叶片和籽粒中蔗糖代谢关键酶活性; 王庆燕等[9]对春玉米苞叶和穗位叶喷施油菜素内酯显著提高玉米光合能力, 促进穗位叶蔗糖合成, 增加籽粒中蔗糖积累, 提高籽粒干物重; 刘鹏等[10]对甜质型和普通型玉米籽粒发育过程中蔗糖代谢和淀粉合成相关酶活性动态比较研究发现, 甜质型玉米蔗糖积累较多的原因主要是蔗糖合成能力增加而非降解量减少。
前人在营养运筹、种植方式、化控调节等方面采取措施[5, 6, 7, 8, 9], 从促进玉米功能叶片中光合能力和蔗糖合成能力、促进蔗糖的转运和积累角度出发, 探讨玉米高产的途径。植物生长调节剂在促进玉米根系生长、调控株型结构、提高抗逆能力和增加产量等方面的作用已得到普遍重视[11]。ECK主要成分为乙烯利和矮壮素, 在玉米六展叶拔节后喷施, 可有效矮化株高、降低群体倒伏, 并且在防止群体早衰方面效果显著[12]; PKN主要成分为生长素和细胞分裂素, 是一种在东北地区广泛应用的抗冷调节剂, 具有促进碳氮代谢、提高籽粒灌浆速率和后期脱水速率的效果[13, 14, 15]。本研究采用乙矮合剂与聚糠萘合剂双重化控方法, 从调节源库代谢的角度, 研究双重化控对功能叶和籽粒中蔗糖代谢关键酶活性的影响, 探讨东北春玉米高产的化控技术途径。
吉林省公主岭市中国农业科学院作物科学研究所试验站(43° 29′ 55″ N, 124° 48′ 43″ E)耕层土壤(0~20 cm) pH 6.0, 含有机质2.62%、全氮0.13%、速效氮125.8 mg kg-1、速效磷24.46 mg kg-1、速效钾187.74 mg kg-1。
选用耐密型玉米品种中单909 (以下简称ZD)和稀植大穗型玉米吉单35 (以下简称JD)。种植密度为7.5万株 hm-2, 60 cm等行距。全生育期施肥量N∶ P2O5∶ K2O = 247.5∶ 97.5∶ 120.0 (kg hm-2), 基施尿素330 kg hm-2、磷酸二铵165 kg hm-2、氯化钾127.5 kg hm-2。拔节期每公顷追施尿素177 kg、磷酸二铵55.5 kg、氯化钾79.5 kg, 其他管理同当地大田生产。双重化控处理(TR), 于六展叶期叶面喷施乙矮合剂0.45 L hm-2, 九展叶叶面喷施聚糠萘合剂0.45 L hm-2, 每公顷兑水225 L, 对照(CK)喷施等量清水。采用随机区组设计, 3次重复。试验小区面积10.0 m × 4.8 m。2013年5月9日播种, 9月25日收获。2015年5月1日播种, 10月3日收获。
乙矮合剂(ethylene-chlormequat-potassium, 简称ECK)、聚糠萘合剂(PASP-KT-NAA, 简称PKN)由中国农业科学院作物科学研究所栽培生理系研制, 黑龙江禾田丰泽兴农科技开发有限公司生产提供。
开花期选取同天开花且长势长相基本相同的单株挂牌标记, 从开花之日起, 每10 d取样1次(去除叶脉穗位叶中部及穗中部籽粒), 液氮速冻后放入-80℃冰柜储存待测生理指标。
1.3.1 蔗糖与蔗糖代谢关键酶活性 参照刘鹏等[10]的方法测定蔗糖含量、蔗糖磷酸合成酶活性(SPS), 并分别测定蔗糖合成酶(SS)合成方向和分解方向酶活性。参照赵智中等[16]的方法并稍加改进测定酸性转化酶(AI)和中性转化酶(NI)活性。加入pH 4.7 (AI) / pH 7.0 (NI) 0.08 mol L-1的乙酸-K3PO4缓冲液(内含0.05 mol L-1的蔗糖)和酶提取液。将上述反应液在37℃下保温10 min, 经沸水浴5 min终止反应。用煮沸失活的酶液作对照。冷却后加1 mL 3, 5-二硝基水杨酸试剂, 沸水浴5 min, 冷却至室温在540 nm波长下比色。
以每克植物鲜样在1 h内反应生成的蔗糖含量(mg)表示蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)活性, 以每克鲜样在1 h内反应生成的果糖含量(mg)表示酸性转化酶(AI)、中性转化酶(NI)和蔗糖合成酶(分解方向SS)活性。
1.3.2 粒重与籽粒灌浆速率 在玉米吐丝期, 选取长势、穗型基本一致的植株挂牌标记。自吐丝后5 d起, 每隔5 d (灌浆30 d后每隔10 d)在每小区标记的植株上取3个果穗, 每穗取中部籽粒100粒, 于105℃烘箱中杀青30 min, 80℃烘至恒重后称重。参照陈传永等[17]方法进行Logistic模拟测定灌浆速率。
1.3.3 测产 在每处理小区中选取10 m2称重计产, 并选取20个平均穗调查穗部性状, 测定出籽率和含水率, 计算产量(按14%含水量计)。
采用Microsoft Excel 2007整理数据和作图, SPSS 19.0统计分析, 以LSD检验平均数间差异显著性(P< 0.05* ; P< 0.01* * )。两年的试验结果趋势基本一致, 本文采用2015年的数据。
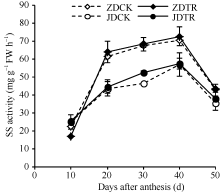
2.1.1 穗位叶蔗糖含量 蔗糖是功能叶片中最主要的光合产物, 也是物质转运的主要形式。如图1所示, 在花后10~50 d内, 穗位叶蔗糖含量呈先增加后降低再增加的变化规律, 而化控处理ZDTR在花后50 d降低, 品种间表现为ZD高于JD。化控处理, ZD和JD穗位叶蔗糖含量在花后10~20 d显著高于对照, 分别提高1.95%~6.09%和4.56%~23.35%; 在花后30~50 d低于对照, 分别降低1.46%~42.52%和13.19%~44.64%。
2.1.2 穗位叶蔗糖合成酶与蔗糖磷酸合成酶活性
蔗糖合成酶和蔗糖磷酸合成酶是叶片中蔗糖合成的关键酶, 分别催化果糖与UDPG和6-磷酸果糖与UDPG生成蔗糖, 其中蔗糖合成酶催化蔗糖合成的可逆反应。在花后10~50 d内, ZD穗位叶SS活性(图2-A)呈双峰曲线, 峰值分别出现在花后20 d和40 d, JD穗位叶SS活性呈单峰曲线, 在花后30 d或40 d达到最大值, 品种间表现为ZD高于JD。化控处理后, ZD和JD穗位叶SS活性高于CK。花后20~50 d内, ZDTR穗位叶SPS活性比CK高10.54%~48.74%, 而在花后10 d活性降低; JDTR穗位叶SS活性在花后10~50 d内比CK高22.89%~ 76.86%, 其中在花后40 d降低, 差异不显著。
如图2-B所示, 在花后10~50 d内, SPS活性随灌浆进程基本呈单峰曲线, ZDCK、ZDTR和ZDCK SPS活性均在花后30 d达到最大值, JDTR在花后20 d达最大值。化控处理后, ZD和JD穗位叶SPS活性整体高于CK, 且ZD高于JD。在花后20~50 d内, ZDTR和JDTR分别比CK活性高6.04%~93.75%和2.04%~238.88%, 而在花后10 d分别降低37.34%和25.48%。
2.2.1 籽粒蔗糖含量 籽粒中的蔗糖积累是个复杂的过程, 包括源端转运、自身分解与合成。由图3可见, 花后10~50 d内, ZD籽粒蔗糖含量呈降低的趋势, JD籽粒蔗糖含量呈先增加后降低的变化趋势, JDCK和JDTR分别在20 d和30 d达到最大值。化控处理后, ZDTR在花后10~20 d内蔗糖含量显著高于ZDCK, 比ZDCK提高5.95%~10.97%, 花后30~50 d内ZDTR蔗糖含量降低3.51%~11.95%; JDTR在花后30~40 d蔗糖含量比JDCK增加11.77%~19.02%, 其他时期比JDCK降低3.91%~20.35%。
2.2.2 籽粒蔗糖合成酶与蔗糖磷酸合成酶活性
如图4-A所示, 花后10~50 d内, 两品种玉米籽粒中SS活性呈单峰曲线变化, 均在花后20 d达到峰值。化控处理对两品种SS活性的影响不一致, ZDTR在花后30 d和50 d SS (合成方向)活性显著高于ZDCK, 分别提高16.77%和6.89%, 而在花后10~20 d和40 d低于ZDCK, 降低5.61%~11.33%, 花后10 d和40 d降低显著; JDTR在花后20 d和50 d SS (合成方向)活性显著高于JDCK, 分别提高32.97%和38.45%, 在花后10 d和30~40 d降低0.65%~30.00%, 仅在花后40 d降低显著。
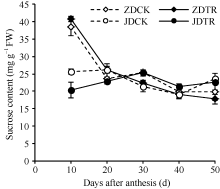 | 图3 双重化控对籽粒蔗糖含量的影响 ZD: 中单909; JD: 吉单35; CK: 对照; TR: 化控处理。Fig. 3 Effect of PGR (plant growth regulators) on sucrose content in grain ZD: Zhongdan 909; JD: Jidan 35; CK: control; TR: ECK & PKN treatment. |
由图4-B可知, ZDCK籽粒SPS活性在花后10~20 d降低幅度较大, 随后活性变化平稳, ZDTR在生育期内SPS活性变化平稳, 在花后20~50 d与ZDCK差异不显著; JDTR和JDCK SPS活性基本呈先增加后降低的变化趋势, 在花后40 d达到最高, JDTR在花后10~20 d较JDCK活性提高10.09%~ 23.97%, 花后30~50 d降低5.15%~35.63%。
2.2.3 籽粒蔗糖转化酶活性 蔗糖转化酶催化蔗糖不可逆地分解为果糖和葡萄糖, 根据其最适pH又可分为酸性转化酶(AI)和中性转化酶(NI)。如图5-A所示, 在花后10~50 d内, 两品种玉米籽粒AI活性呈降低的趋势, 在花后10 d活性最高。化控处理后, ZDTR籽粒AI活性在花后20~30 d比ZDCK降低9.85%~49.50%, 差异显著, 而在其他时期活性提高0.49%~33.44%; JDTR籽粒AI活性在花后20 d比JDCK降低19.26%, 差异显著, 而在其他时期提高6.71%~13.77%。
与AI活性相比, NI活性较低。在花后10~50 d内, ZD籽粒NI活性呈双峰曲线变化, 分别在花后20 d和40 d达到峰值; JD整体呈先下降再升高的趋势, 在花后30 d活性最低。化控处理后, ZDTR籽粒NI活性在花后20 d显著降低, 降低37.83%, 在其他时期NI活性均有不同程度的提高, 但仅在花后50 d与CK差异显著; JDTR在花后20~30 d籽粒NI活性比JDCK降低7.94%~35.12%, 在其他时期提高20.03%~ 92.13%。
2.2.4 籽粒蔗糖合成酶(分解方向)活性 蔗糖合成酶催化蔗糖合成与分解的可逆反应, 分解方向的SS催化蔗糖分解成UDPG和果糖。如图6所示, 在花后10~50 d, 两品种玉米籽粒SS活性呈单峰曲线变化, 在花后40 d活性最高。品种间ZD比JD活性高。化控处理后, ZDTR和JDTR籽粒SS活性不同程度提高, 但与CK差异不显著。
相关分析表明(表1), 穗位叶蔗糖含量(X1)、蔗糖合成酶(降解方向)(X4)与籽粒蔗糖含量呈显著或极显著正相关, 酸性转化酶(X2)、蔗糖合成酶(X5)、蔗糖磷酸合成酶(X6)与籽粒蔗糖含量呈极显著负相关。通径分析表明, 穗位叶蔗糖含量(X1)、酸性转化酶(X2)、蔗糖合成酶(X5)通径系数对籽粒蔗糖含量为正效应, 籽粒中性转化酶(X3)、蔗糖合成酶(降解方向)(X4)、蔗糖磷酸合成酶(X6)通径系数对籽粒蔗糖含量为负效应。对籽粒蔗糖含量的直接作用表现为酸性转化酶(X2)> 蔗糖合成酶(X5)> 中性转化酶(X3)> 蔗糖磷酸合成酶(X6)> 蔗糖合成酶(降解方向)(X4)> 穗位叶蔗糖含量(X1); 间接作用表现为蔗糖磷酸合成酶(X6)> 蔗糖合成酶(降解方向)(X4)> 穗位叶蔗糖含量(X1)> 中性转化酶(X3)> 酸性转化酶(X2)> 蔗糖合成酶(X5), 其中穗位叶蔗糖含量(X1)、蔗糖合成酶(降解方向)(X4)对籽粒蔗糖含量的间接作用为负效应, 其他参数为正效应; 穗位叶蔗糖含量(X1)通过酸性转化酶(X2)、蔗糖合成酶(降解方向)(X4)对籽粒蔗糖含量的间接作用负相关程度较高, 酸性转化酶(X2)通过蔗糖合成酶(降解方向)(X4)、蔗糖合成酶(X5)对籽粒蔗糖含量的间接作用正相关程度较高。分析结果表明, 酸性转化酶(X2)、中性转化酶(X3)、蔗糖合成酶(X5)对籽粒蔗糖含量的直接贡献较大, 穗位叶蔗糖含量(X1)、蔗糖合成酶(降解方向)(X4)、蔗糖磷酸合成酶(X6)对籽粒蔗糖含量的间接贡献较大, 且通过酸性转化酶(X2)的间接作用较大。
由图7可知, 两品种百粒重均随籽粒的发育呈现“ 慢— 快— 慢” 的S型变化, 籽粒灌浆速率呈单峰曲线的变化, 在花后30 d左右达到最大灌浆速率。双重化控处理后, ZDTR (图7-A)籽粒干物重在25~65 d以后均比ZDCK有所提高, 成熟期百粒重比ZDCK显著提高4.33%, 而籽粒灌浆速率在花后10~40 d ZDTR比ZDCK提高6.30%~17.31%, 在花后40~65 d降低7.65%~44.07%; JDTR (图7-B)籽粒干物重在花后30~65 d以后比CK有所提高, 成熟期百粒重比JDCK显著提高, 提高4.74%, 而籽粒灌浆速率在花后25~65 d JDTR比JDCK提高2.71%~ 14.24%。
| 表1 籽粒蔗糖积累与代谢关键酶活性的通径分析和相关系数 Table 1 Path and regression analysis of sucrose accumulation and key enzymes activity in grain |
由图8可知, 化控处理后两品种春玉米产量均显著高于CK, ZDTR比ZDCK增产628.12 kg hm-2, JDTR比JDCK增产1017.99 kg hm-2, 分别比对照增产4.61%和7.78%。ZD产量高于JD。
叶片是玉米进行光合作用的主要器官, 维持叶片较强的碳代谢是籽粒产量形成的基础。蔗糖是高等植物光合作用的主要产物, 也是植物体内碳同化物运输的主要形式, 在植物的糖代谢中具有重要的作用[18]。但前人研究表明, 叶片中过多的蔗糖积累会影响与光合作用相关的一些基因表达, 不利于光合作用[19]。化学调控是调节植物生长代谢的重要手段, 乙矮合剂和聚糠萘合剂是分别针对玉米茎秆倒伏和低温冷害特点而研制的新型调节剂, 其主要成分分别为乙烯利、矮壮素和生长素、细胞分裂素。卢霖等[12]、徐田军等[13]研究结果表明, 乙矮合剂、聚糠萘合剂具有提高抗氧化酶活性、降低群体花后早衰的作用, 使植株在生育末期仍可以保持较高的物质生产能力, 陈传晓[20]研究发现聚糠萘合剂提高了玉米穗位叶蔗糖代谢关键酶(蔗糖合成酶、蔗糖磷酸合成酶和转化酶)的活性, 增强了叶片光合性能, 增加了蔗糖的积累。与前人单一化控处理结果相似, 本研究结果表明, 乙矮合剂和聚糠萘合剂双重化控促进了穗位叶SS和SPS活性, 提高灌浆前期(花后10~20 d)穗位叶蔗糖含量, 降低后期(花后30~50 d)蔗糖含量, 促进了蔗糖合成与转运。
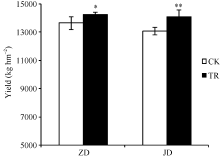 | 图8 双重化控对两品种玉米产量的影响 ZD: 中单909; JD: 吉单35; CK: 对照; TR: 化控处理。Fig. 8 Effect of PGRs (plant growth regulators) on yield ZD: Zhongdan 909; JD: Jidan 35; CK: control; TR: ECK & PKN treatment. |
源端转运至库中的蔗糖, 经AI、NI、SS的分解, 生成单糖类物质供自身能量消耗和淀粉等的合成。籽粒中蔗糖的降解反映了“ 库” 强度的高低[21]。一般认为, 转化酶是蔗糖从韧皮部卸出的主要驱动力, 在蔗糖运输和调节源库关系中起着关键作用[22, 23], 但也有研究认为, 转化酶仅在籽粒发育的早期为胚乳细胞的快速分裂提供碳源, 对物质积累几乎未起作用[24, 25], 这与本研究中转化酶活性仅在灌浆前期维持较高的活性一致。张海艳等[26]研究认为分解方向的蔗糖合成酶是玉米淀粉合成的限速酶, 与淀粉积累速率和籽粒灌浆速率显著相关, 而旺盛的蔗糖降解是籽粒淀粉积累和粒重提高的基础。Hubbard等[27]提出将几种酶活性加减来获得综合效应, 以此得到净活性; 刘鹏等[10]也认为籽粒中蔗糖积累是分解和合成两个方向共同作用的结果。通过Hubbard的净活性方法研究发现, 本试验两品种的籽粒蔗糖分解能力大于合成能力(花后10~40 d), 而双重化控提高蔗糖分解的净活力, 促进了蔗糖分解, 提高中单909灌浆中期和吉单35中后期灌浆速率, 提高了粒重。本研究发现, 玉米籽粒中蔗糖含量与除中性转化酶外的其他因素均达到显著或极显著相关, 但各因素对蔗糖含量的贡献率和作用方式不同。
维持功能叶片中较高的蔗糖合成, 是作物高产的物质基础。前人在探究提高源端蔗糖合成能力方面做了大量研究。一般认为, 种植密度可以显著影响功能叶蔗糖合成能力[5, 6]; 张超男等[28]研究认为, 不同的施肥方式可以影响玉米叶片磷酸蔗糖合成酶活性; 陈洋等[29]研究发现适宜的施氮量可以提高玉米穗位叶蔗糖合成酶与磷酸蔗糖合成酶活性。前人研究认为生长素促进碳同化产物向“ 库” 端和施用外源生长素的部位积累[30]; 细胞分裂素能提高蔗糖转化酶的活性[31]。董学会等[11]研究认为30%己乙水剂可以加快同化物输出, 与本研究结果双重化控极显著地降低灌浆后期功能叶中的蔗糖含量一致。乙矮合剂和聚糠萘合剂是分别针对玉米茎秆倒伏和低温冷害特点而研制的新型调节剂。本研究结果表明, 双重化控提高了穗位叶蔗糖合成相关酶的活性, 尤其显著促进灌浆后期(花后50 d)蔗糖合成能力, 促进了穗位叶蔗糖转运, 提高籽粒中蔗糖分解能力和灌浆中期灌浆速率, 增加粒重和产量。双重化控对保障灌浆后期功能叶正常的物质生产能力和物质转运具有重要作用。
中单909和吉单35灌浆期(10~50 d)穗位叶蔗糖含量呈先增加后降低再增加的变化规律, 双重化控提高穗位叶灌浆期SS和SPS活性, 降低灌浆后期(30~50 d)的穗位叶蔗糖含量, 促进了蔗糖合成与转运; 中单909籽粒蔗糖含量变化呈降低的趋势, 吉单35籽粒蔗糖含量呈先增加后降低的变化趋势, 双重化控降低中后期(30~40 d)籽粒蔗糖合成酶(SS)活性, 提高籽粒蔗糖合成酶(SS)分解方向活性, 促进蔗糖的水解; 通过调控源库蔗糖代谢关键酶的活性, 促进蔗糖向籽粒转运, 分别提高两品种灌浆中期和中后期灌浆速率, 百粒重分别提高4.33%和4.74%。双重化控处理较各自对照分别增产4.61%和7.78%。籽粒蔗糖的代谢是一个复杂的过程, 受多种因素的共同作用, 其代谢机制仍需结合其他因素进一步探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|