第一作者联系方式: E-mail: 1461755144@qq.com
玉米-大豆套作种植模式是国家农业重点推广技术, 研究该模式下大豆茎秆对荫蔽胁迫响应的分子机制将有助于大豆耐荫性的分子遗传改良。利用转录组测序技术分析荫蔽胁迫对南豆12和南032-4大豆茎秆转录基因表达的影响, 结果表明, 荫蔽条件下, 南豆12和南032-4分别有287个和110个差异转录基因, 皆以上调为主。基因功能注释分析显示, 这些基因主要富集于次生细胞壁的生物起源、多糖的合成、钙调素结合和水解酶活性等生物过程中。荫蔽条件下, 南豆12响应木质素、生长素合成的相关基因上调, 南032-4响应茉莉酸、乙烯合成的相关基因上调, 响应赤霉素代谢的相关基因则下调, 但南豆12表现出更多的差异转录基因。大豆茎秆积极响应荫蔽信号, 增加茎秆细胞壁多糖, 加快次生细胞壁的生成, 从而阻碍茎秆横向生长, 使大豆茎秆变细, 同时增加水解酶活性, 加快细胞的松弛, 使大豆茎秆伸长。南豆12和南032-4也通过各自特有的差异转录基因响应荫蔽, 但南豆12通过更多地增加细胞壁多糖、木质素含量以及对生长素的响应等来增加茎秆强度, 保持茎秆一定的形态优势, 最终提高自身抗倒伏能力, 表现出对荫蔽更强的适应性。
Maize-soybean relay-cropping system is a key technology in agriculture, studying the molecular mechanisms for shade stress responses of soybean grown in the intercropping system will be useful for soybean improvement by genetic manipulation. An experiment was conducted using two different shade susceptive soybean ( Glycine max L.) varieties Nandou 12 and Nan 032-4 to investigate the transcriptome changes in response to shade stress by RNA-seq technology. The results indicated that 287 differentially expressed genes in Nandou 12 and 110 genes in Nan 032-4 were significantly affected by shade, and the expression of the genes was mainly up-regulated. Gene ontology analyses showed that differentially expressed genes were enriched in secondary cell wall biogenesis, polysaccharides synthesis, calmodulin binding, hydrolase activity and so on. In the shade treatment, differentially expressed genes responded to lignin and auxin biosynthetic processes were up-regulated in Nandou 12; and genes responded to jasmonic acid and ethylene biosynthetic processes were up-regulated, but genes responded to gibberellin metabolic process were down-regulated in Nan 032-4. However, Nandou 12 had more differentially expressed genes than Nan 032-4. The accumulateion of polysaccharides in cell wall and acceleration of secondary cell wall formation hindered the radial growth of stem making stem thinner, meanwhile the increase of hydrolysis enzyme activity accelerated the relaxation of cells, making stem longer. Nandou12 and Nan032-4 also had their particular genes to response shade, but Nandou 12 had more cell wall polysaccharides, lignin content and auxin content to increase the intensity of stem keeping a certain morphological advantage, resulting in higher lodging resistance under the shade, that is a stronger adaptability to shade.
近年来, 玉米-大豆套作种植模式在我国西南地区大面积推广, 扩大了大豆种植面积, 增加了我国大豆供给, 成为振兴我国大豆产业的新途径[1, 2]。如今, 玉米-大豆带状复合种植技术更是列为国家农业重点推广技术。在玉米-大豆套作种植模式下, 大豆苗期与玉米共生, 大豆冠层的透光率降低[3], 导致大豆出现避荫反应, 植株茎秆变细, 节间过度伸长, 容易出现倒伏, 最终影响大豆生长发育及产量和品质[4, 5, 6, 7]。茎秆性状作为影响大豆倒伏的最主要因素, 其形态生理、生物力学等特征与抗倒性密切相关[8, 9]。细胞壁是植物细胞的重要结构, 不但维持细胞形态, 决定细胞壁强度, 还参与细胞分化、信号转导等生理过程, 其结构、成分和状态与植物细胞的伸长紧密相关, 而植物细胞的伸长又与植物的个体生长有密切的关系[10]。木质素作为细胞壁主要组成成分之一, 对维持茎秆机械强度以及抵御不良环境具有明显的促进作用[11, 12]。邹俊林等[13]研究表明, 套作大豆苗期木质素含量与倒伏率呈显著负相关。细胞壁中的纤维素和半纤维素含量的变化与细胞延伸生长有关, 而果胶组分的变化与细胞壁松弛有关[14], 内切木葡聚糖转糖基酶(XET)则是一种细胞壁松弛酶, 属于木葡聚糖内转糖苷酶/水解酶(XTH)类, 有水解和形成糖苷键的双重功能[15]。同时, 在植株生长发育过程中, 激素亦扮演着重要角色。研究表明赤霉素和生长素促进茎秆细胞伸长[16, 17], 茉莉酸和乙烯均能参与植物的逆境胁迫[18, 19]。
转录组代表细胞或组织内全部的RNA转录本(RNA transcript), 反映不同生命阶段、不同组织类型、不同生理状态以及不同环境条件下表达的基因。近年来, 高通量转录组测序技术的不断发展和完善为开展不同生物功能基因组学研究提供了全新的思路和方法[20]。应用转录组测序筛选出逆境胁迫下差异表达基因, 分析基因的功能, 不仅能使我们更好地理解作物响应及耐受胁迫的分子机制, 也为利用这些基因对作物进行定向遗传改良以提高作物的抗胁迫能力奠定一定的基础[21, 22]。目前, 转录组测序在大豆结瘤发育[23]、种子发育[24]、花发育[25]等方面已有一定研究, 但在荫蔽胁迫下对大豆茎秆进行转录组测序分析还尚未见报道。本研究利用转录组测
序技术分析荫蔽胁迫下大豆茎秆中基因表达的差异, 并对极显著基因作进一步分析, 旨在探讨大豆响应荫蔽胁迫的分子基础, 为利用分子生物学技术和基因工程手段提高大豆耐荫抗倒性奠定基础。
强耐荫性品种南豆12 (西南地区套作大豆主推品种, 四川省南充市农业科学院选育)和弱耐荫性品种南032-4 (四川省南充市农业科学院育种材料)[13, 26], 均由四川农业大学作物栽培学与耕作学大豆课题组提供。沙质土pH 6.55, 含有机质8.96 g kg-1, 全氮1.21 g kg-1, 全磷0.61 g kg-1, 全钾11.44 g kg-1, 碱解氮62.35 mg kg-1, 速效磷25.34 mg kg-1, 速效钾65.70 mg kg-1。
于2014年7月至8月在四川农业大学雅安科研教学园区(29° 59′ N, 103° 00′ E)进行试验。采用两因素随机区组设计, 因素一为光照处理, 即全光照和遮荫65%处理; 因素二为大豆材料, 即南豆12和南032-4, 共4个处理, 3次重复。盆钵直径40 cm, 高35 cm, 每盆装20 kg沙质土, 盆播5穴, 穴留2株。大豆幼苗第一片复叶全展开时使用遮阳网进行遮阴处理, 透光率为35%。出苗30 d后, 于14:30至15:30取样, 截取大豆顶端幼嫩部分茎秆样品, 速冻于液氮中, 带回实验室-80℃冰箱保存。
采用RNAqueous phenol-free total RNA Reagent (Cat#AM1912, Ambion)根据生产厂商提供的标准操作流程抽提样品的总RNA, 经Agilent Bioanalyzer 2100 (Agilent technologies, Santa Clara, CA, US)电泳质检合格后使用RNeasy Micro Kit (Cat#74004, QIAGEN, GmBH, Germany)和RNase-Free DNase Set (Cat#79254, QIAGEN, GmBH, Germany)纯化总RNA。经NanoDrop ND-2000分光光度计及Agilent Bioanalyzer 2100 (Agilent technologies, Santa Clara, CA, US)质检, 合格的RNA可用于后续的测序实验。
在200 μ L PCR管中加入质量合格的样品RNA和Fragmentation buffer (LC-Bio), 94℃反应8 min, 将mRNA随机打断成片段; 用随机引物和逆转录酶将RNA片段反转成cDNA第1链片段, 并合成第2链cDNA; 接着对双链cDNA片段进行末端修复及3′ 末端加‘ A’ 碱基, 并将DNA片段两端连接上特定的测序接头; 最后通过PCR扩增对cDNA富集纯化, 完成测序样本文库构建; 使用Qubit 2.0 Fluorometer检测所建文库浓度, Agilent2100检测文库的大小。按照cBot User Guide所示相应流程, 在Illummina HiSeq 2500测序仪配套的cBot上完成 Cluster生成和第一向测序引物杂交; 按照HiSeq 2500 User Guide准备测序试剂, 将携有cluster的flow cell上机(HiSeq 2500型, Illumina), 选用paired-end程序, 进行2× 100 nt multiplex测序, 测序过程由Illumina提供的data collection software进行控制, 并进行实时数据分析。文库的构建和测序均由上海伯豪生物技术有限公司完成。
利用Illumina 平台将测序所得的图像数据转化为相应的核苷酸序列数据, 通过fastx (version: 0.0.13, http://hannonlab.cshl.edu/fastx_toolkit/index. html)去除测序过程中低质量的序列和不确定的序列(Q < 20)。采用tophat (version: 2.0.9)的splicedmapping算法对预处理后reads进行Genome mapping。通过Genome mapping去除重复序列, 应用cufflinks (version: 2.1.1)对tophat的mapping结果进行基因定量。通过FPKM方法使转录水平规范化。差异表达基因筛选标准为表达倍数Fold change≥ 2或≤ 0.5 (表达上调或下调), FDR (False discover rate) < 0.05。把所挑选的差异表达基因向Gene Ontology数据库的各个条目(term)映射, 并进行Gene Ontology分析, corrected P-value (FDR)≤ 0.05为阈值, 满足此条件的GO term定义为在差异表达基因中显著富集的GO term。
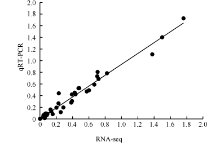
随机挑选10个筛选出来的差异表达基因来验证其在4个处理中的表达, 设计特异引物, 提取同期样品RNA, 逆转录为cDNA, 进行实时荧光定量PCR分析, 选用Actin 11基因为内参(表1)。反应体系含2× SYBR Green PCR buffer 5 μ L、Template 0.5 ng、Primer-F 0.5 μ L、Primer-R 0.5 μ L, 补水至总体积10 μ L。扩增反应程序为50℃孵育2 min, 95℃, 10 min; 40个循环的95 ℃, 15 s; 60℃, 1 min。仪器为ABI 7900 HT Sequence Detection System。
| 表1 实时定量PCR选用基因及其引物 Table 1 Genes and primers for qRT-PCR |
NGS (Next Generation Sequencing, 二代高通量测序)技术应用高通量测序仪lllumina Hiseq 2500对12个样本(荫蔽或全光照条件下的南032-4和南豆
12, 各3个重复)的cDNA测序得到232.2~383.1万条原始序列(表2), 再通过fastx (version 0.0.13)过滤得到216.5~356.7万条有效序列, 占原始序列92.6%~93.3%。通过tophat (version 2.0.9)与大豆参考基因组进行基因比对, 成功比对202.6~334.1万条序列。
| 表2 Illumina测定序列与大豆基因组比对结果统计 Table 2 Statistics of Illumina reads and comparison with soybean genome |
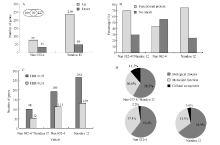
序列整体评估优良, 结果合格可用。通过在遮荫和全光照下3个重复的FPKM值进行样本间差异基因分析, 采用Fold change (表达差异倍数)以及Fisher-test精确检验统计学方法对差异基因差异程度进行筛选, 筛选条件为|log2FC| > 1, 且FDR < 0.05。经筛选, 在荫蔽胁迫下南032-4的差异转录基因数量为110个, 上、下调转录基因数量分别为77个和33个; 南豆12的差异转录基因数量为287个, 上、下调转录基因数量分别为239个和48个; 南032-4和南豆12共有的差异转录基因数目为60个(图1-A)。
通过对差异转录基因筛选, 从Ensemble Plant获得GO IDs, 对南032-4和南豆12的差异转录基因进行功能注释, 南032-4和南豆12共有的60个差异转录基因, 其中获得功能注释的基因数为42个, 未找到匹配信息的基因数为18个, 2种注释情况占比分别为70.0%、30.0%, 此外, 对南032-4和南豆12特有的差异转录基因这2种注释情况占比分别为44.0%、56.0%和75.3%、24.7% (图1-B)。
Gene Ontology可分为生物过程(biological process)、细胞组成(cellular component)和分子功能(molecular function) 3个部分。将得到的数据通过FDR< 0.05为筛选条件筛选出差异转录基因中显著富集的GO条目。经荫蔽处理, 南032-4和南豆12差异转录基因中获得显著性GO富集的条目分别有189个和263个(图1-C), 共有98个显著性GO富集的条目。其中, 南032-4特有的显著性GO富集条目的生物过程、细胞组成和分子功能分别有55、2和34个, 占比为60.4%、2.2%和37.4%; 南豆12特有的显著性GO富集条目的三个过程分别有107、6和52个, 占比为64.9%、3.6%和31.5%。此外, 南032-4和南豆12共有98个显著性GO富集条目, 其生物过程、细胞组成和分子功能分别占比58.2%、11.2%和30.6% (图1-D)。
为了进一步推断大豆茎秆对荫蔽的响应, 通过FDR < 0.01筛选出极显著的GO条目(图1-C), 南032-4和南豆12分别具有111个和129个极显著富集条目, 共有52个极显著的富集条目, 主要涉及次生细胞壁的生物起源(GO: 0009834)、木聚糖的生物合成过程(GO: 0045492)、作用于糖基键的水解酶活性(GO: 0016798)、木质素生物合成过程(GO: 0009809)等(表3)。
| 表3 荫蔽胁迫下南032-4和南豆12共有的极显著GO富集 Table 3 Highly significant GO terms in both Nan 032-4 and Nandou 12 under shade stress |
南032-4特有59个极显著的富集条目(表4), 主要涉及茉莉酸、乙烯、赤霉素等相关代谢。其中, 有8个差异转录基因富集于茉莉酸的生物合成过程(GO: 0009695), 5个差异转录基因富集于乙烯的生物合成过程(GO: 0009693), 2个差异转录基因富集于赤霉素的代谢过程(GO: 0009685)。在这15个差异转录基因中, 主要有6个编码茉莉酮酸酯ZIM结构域蛋白、2个编码赤霉素氧化酶、1个编码乙烯合成前体1-氨基环丙烷-1-羧酸(ACC)、1个编码乙烯形成酶等, 除编码赤霉素相关代谢的基因下调外其他的皆上调(表5)。
| 表4 荫蔽胁迫下南032-4特有的极显著GO富集 Table 4 Highly significant GO terms in Nan 032-4 under shade stress |
| 表5 荫蔽胁迫对南032-4茉莉酸合成、乙烯合成、赤霉素代谢的影响 Table 5 Effect of shade stress on jasmonic acid biosynthetic process, ethylene biosynthetic process, and gibberellin metabolic process in Nan 032-4 |
南豆12特有77个极显著的富集条目(表6), 主要涉及细胞壁相关多糖的合成, 尤其是木质素合成, 比如 3个编码4-香豆酰辅酶A连接酶的差异转录基因富集于4-香豆酰辅酶A连接酶活性(GO: 0016207)、3个编码苯丙氨酸裂解酶的差异转录基因富集于苯丙氨酸解氨酶活性(GO: 0045548)、3个编码甲基转移酶的差异转录基因富集于咖啡酸-O-甲基转移酶活性(GO: 0047763)等, 所有的这些基因皆上调。此外, 在荫蔽条件下南豆12有23个差异转录基因涉及植物激素的响应(GO: 0009733), 其中, 有9个编码SAUR-like生长素响应家族蛋白, 1个编码吲哚乙酸, 10个基因皆上调(表7)。
| 表6 荫蔽胁迫下南豆12特有的极显著GO富集 Table 6 Highly significant GO terms in Nandou 12 under shade stress |
| 表7 荫蔽胁迫对南豆12合成木质素相关酶类及生长素的影响 Table 7 Effect of shade stress on lignin synthesis related enzymes and auxin in Nandou 12 |
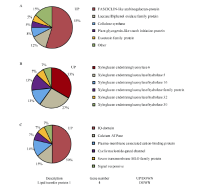
南032-4和南豆12分别有40个和62个差异基因富集在次级细胞壁生物发生(GO: 0009834), 共有40个差异基因(表3), 其中, 22个差异基因编码类成束蛋白阿拉伯半乳聚糖蛋白FLAs, 5个编码漆酶氧化酶, 2个编码植物类糖原淀粉起始蛋白, 3个编码纤维素合酶, 2个编码EXT蛋白, 这些差异基因在荫蔽条件下皆上调(图2-A); 同时多个富集条目涉及细胞壁相关多糖的合成, 比如与纤维素合成紧密相关的纤维素合酶活性(GO: 0016759)等; 与果胶合成相关的鼠李半乳糖醛酸聚糖侧链代谢过程(GO: 0010400)等; 与半纤维素合成紧密相关的木聚糖生物合成的过程(GO: 0045492)、葡糖醛酸木聚糖代谢过程(GO: 0010413)等; 与木质素合成紧密相关的木质素合成过程(GO: 0009809)、苯丙烷代谢过程(GO: 0009698)等; 在荫蔽条件下这些差异表达基因皆上调且南032-4较南豆12上调的基因数相对少些(表3)。
南032-4和南豆12分别有14个和11个差异基因富集在作用于糖基键的水解酶活性(GO: 0016798), 所有差异转录基因皆编码木葡聚糖内转糖苷酶/ 水解酶(XTH), 皆上调(图2-B)。在荫蔽条件下, 南032-4和南豆12分别有7个和14个差异基因富集于钙调素的结合(GO: 0005516), 其主要参与编码IQ-domain、钙-ATP酶、与质膜相关的钙离子结合蛋白等, 除了南豆12有4个编码脂质转运蛋白LTP基因下调外其他的皆上调(图2-C)。
作物的抗逆性是由多基因控制的复杂数量性状, 涉及信号转导、激素代谢、防御和胁迫耐受蛋白、能量代谢和转录翻译等方面[27, 28]。在荫蔽条件下, 作物感受荫蔽信号, 表现出避荫反应, 致使植株高度增加, 茎秆细长纤弱, 由于荫蔽条件的复杂性和作物基因型的多样性可能使作物对荫蔽存在不同程度或方式的适应性[4, 5, 6, 7, 29]。本研究对不同耐荫型大豆品种的茎秆转录组测序显示, 在荫蔽条件下大豆茎秆转录基因出现显著差异, 且皆以上调为主, 这或许与荫蔽胁迫适应调节机制密切相关, 但仍需进一步研究揭示。强耐荫品种南豆12较弱耐荫品种南032-4表现出更多的差异转录基因, 体现了不同基因型对荫蔽适应能力的不同, 强耐荫品种南豆12对荫蔽具有更强的响应能力, 积极调控以增强对荫蔽的适应能力。
植物细胞壁对植物体的支撑、水分和养料的供给、植物形态建成和植物与环境的相互作用起着重要作用, 与植物细胞分化、植物体生长发育也有密切关系, 其中, 次生细胞壁对加强植物向上生长所需要的机械支持能力起重要作用[30]。本研究中, 在荫蔽条件下大多基因主要集中于茎秆次生细胞壁的起源以及细胞壁相关多糖的合成, 且皆上调, 这是作物对荫蔽胁迫的积极响应以加强自身向上生长所需的机械支持力和所需的物质基础, 进而增强对荫蔽胁迫的耐受能力。其中, 又以编码FLAs基因占多数, 其属于阿拉伯半乳聚糖蛋白中的一类, 前人研究表明, 阿拉伯半乳聚糖蛋白能够促进棉花纤维的伸长[31]、参与植物细胞定向生长的控制[32]以及茎的伸长[33]等。亦有研究证明, FLA在细胞伸长及次生细胞壁的成熟中起作用[34, 35]。本研究表明, 在荫蔽条件下编码细胞壁纤维素、半纤维素、木质素等相关多糖的基因上调, 这便促进细胞壁多糖的积累, 为细胞生长提供物质基础, 加之在荫蔽胁迫下编码FLA增多, 促进细胞伸长, 加快次生细胞壁的成熟, 这就使得细胞周边扩散生长减弱致使茎秆变细。其中, 南豆12相关基因上调数目较南032-4多, 表明在荫蔽胁迫下强耐荫品种南豆12茎秆物质积累丰富, 致使茎秆不至过于纤细, 能维持茎秆较强的机械能力, 防止倒伏, 体现了较强的耐荫能力。
细胞壁松弛对植物发育有着深刻的影响, 其中木葡聚糖内转糖苷酶/水解酶XTH能催化木葡聚糖分子水解与再连接, 通过一种“ 分子嫁接” 的机制介导细胞壁的松弛及重构促进细胞伸长[36, 37]。在荫蔽条件下大豆茎秆编码水解酶活性的XTH基因皆上调, 促进了细胞壁的松弛进而促进细胞壁细胞伸长, 致使大豆茎秆伸长生长。这与前人研究的AtXTH9的突变会导致节间变短[38], 水稻OsXTH8基因上调表达参与细胞伸长[39]的研究结果基本一致。其中, 南豆12较南032-4上调的基因少些, 说明在荫蔽条件下南豆12茎秆维持一定长度, 减弱茎秆藤蔓化程度, 降低植株倒伏率, 较032-4更适应荫蔽环境。
在荫蔽条件下, 作物茎秆变得纤细, 归结于作物对荫蔽信号作出的响应, 本研究表明作为第二信使Ca2+结合蛋白的钙调素尤为明显, 其积极的响应促使作物通过信号转导对荫蔽作出响应, 增强对荫蔽的适应能力。其中, 南豆12茎秆中4个编码响应钙调素结合的脂质转运蛋白皆下调, 脂质转运蛋白是一种重要的逆境蛋白[40], 其下调可能介导复杂的信号系统增加南豆12对荫蔽的耐受力, 但其调节机制还需进一步研究。在荫蔽条件下, 南豆12和南032-4也有各自特有的对荫蔽的响应和适应性。本研究表明, 遮荫使南豆12茎秆中编码木质素合成和响应生长素的相关基因显著上调。木质素是次生细胞壁重要组成成分, 编码其合成的基因上调与次生细胞壁合成加快相照应, 前人研究表明木质素对茎秆机械强度的增加具有促进作用, 在荫蔽条件下大豆茎秆变得纤细, 木质素含量降低, 易出现倒伏[11, 13], 南豆12通过促进木质素合成增强其自身茎秆抗折力, 加强了对荫蔽环境的适应性, 体现了其强耐阴性。同时, 其编码响应生长素的相关基因皆上调, 促进了生长素的合成, 由于高浓度的生长素抑制生长, 因此, 抑制了茎秆过度伸长生长, 减弱茎秆藤蔓化程度, 降低植株倒伏率, 体现了对荫蔽较强的适应性。至于南032-4, 在荫蔽条件下, 主要通过相关的激素代谢响应荫蔽。前人研究表明, 赤霉素促进茎秆伸长[16], 茉莉酸参与植物抗逆境胁迫[18], 乙烯提高植物抗逆性[19]。本试验中南032-4编码赤霉素代谢
的基因下调, 而编码茉莉酸和乙烯相关的基因则上调, 皆表现出南032-4对荫蔽环境的适应性。总之, 在套作荫蔽条件下, 大豆幼苗出现避荫反应, 其茎秆变细伸长, 抗折力下降, 易倒伏, 这归结于分子水平上作出积极响应而调控其形态、生理的变化, 再者, 不同基因型品种表现出不同程度的适应性, 强耐荫品种南豆12较弱耐荫品种南032-4表现出更多的差异转录基因, 对荫蔽响应能力和适应能力更强。
套作荫蔽条件下, 南豆12和南032-4分别有287个和110个差异转录基因影响茎秆形态建成, 主要富集于次生细胞壁的生物起源、多糖的合成、钙调素结合和水解酶活性等生物过程。强耐荫品种通过更多地增加细胞壁多糖、木质素含量以及对生长素的响应等来增加茎秆强度, 保持茎秆一定的形态优势, 最终提高自身抗倒伏能力, 表现出对荫蔽更强的适应性。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|