第一作者联系方式: E-mail: yushanzhai@126.com, Tel: 18450077687
捕光叶绿素 a/ b结合蛋白是植物光系统I (photosystem I, PSI)中与色素分子结合的膜蛋白, 由 Lhca基因家族编码, 主要参与光合作用中光能的捕获与传递。本研究对甘蔗叶片cDNA文库测序, 获得甘蔗PSI中 Lhca3基因的cDNA序列, 命名为 ScLhca3(GenBank登录号为KU215669)。生物信息学分析表明, ScLhca3的开放读码框(opening reading frame, ORF)长度为804 bp, 编码267个氨基酸, 分子量为28.91 kD, 等电点为8.96; ScLhca3被定位于叶绿体, 无信号肽, 存在3个明显的跨膜区域, 含有典型的捕光叶绿素 a/ b结合蛋白功能域(chlorophyll a/b binding domain), 为亲水性非分泌蛋白。多序列比对和进化分析表明, ScLhca3在不同物种间具有较强的保守性, 具有种属特性。构建原核表达载体pGEX-6P-1-ScLhca3, 通过IPTG诱导表明, ScLhca3蛋白与预测大小一致。亚细胞定位试验显示, ScLhca3与报告基因 GFP的融合蛋白定位于叶绿体中。实时定量PCR分析表明, ScLhca3在成熟叶片中的相对表达量最高, 根中几乎不表达, 具有明显的组织特异性; 在CdCl2、ABA和H2O2外源胁迫下, ScLhca3均上调表达; 在黑暗、NaCl和PEG胁迫下则下调表达。
The Lhcagene family in green plants encodes several light-harvesting chlorophyll a/b-binding proteins that harvest and transfer light energy to the reaction center of photosystem I (PSI) in photosynthesis. The cDNA sequence of Lhca3gene was firstly obtained from sugarcane leaf full-length cDNA library through sequencing and validated by homology comparison. It was designated ScLhca3 and submitted to the GenBank (accession number: KU215669). ScLhca3contains an 804 bp open reading frame (ORF) and encodes a deduced protein of 267 amino acids, with a molecular weight and pI of 28.91 kD and 8.96, respectively. Bioinformatics analysis showed that ScLhca3 is a hydrophilic non-secretory protein with three transmembrane domains and a chlorophyll a/ b binding domain. Sequence multi-alignment and phylogenetic analysis demonstrated that the ScLhca3 protein sequence shared a high identity with Lhca3 from other plants, with the specificity of species. The protokaryotic expression vector pGEX-6P-1-ScLhca3 was constructed and expressed in E. colicells under the induction of IPTG. The subcellular localization experiment showed that the ScLhca3 fused with GFP, a reporter protein, was located on chloroplast. Real-time quantitative PCR analysis showed the expression of ScLhca3 had a clear tissue specificity, and was upregulated by CdCl2, ABA, and H2O2, but downregulated by darkness, NaCl, and PEG.
捕光叶绿素a/b结合蛋白(light harvesting chlorophyll a/b binding protein, LHC)是光合系统中的重要功能蛋白, 定位于叶绿体类囊体膜上, 与色素结合形成捕光色素蛋白复合体[1]。该复合体能捕获光能, 并迅速把光能传到PSI (photosystem I, PSI)和光系统II (photosystem II, PSII)的反应中心, 引起光化学反应, 将光能转化为化学能。在高等植物和绿藻中, PSI复合物由PSI核心复合物(PSI-CC)和捕光色素蛋白复合体I (LHCI)两部分组成[2]。真核生物的PSI复合物包括了一系列捕光叶绿素a/b结合蛋白即LHCI, 它们结合大约100个叶绿素分子以增大捕光截面, 并且因为含有叶绿素b和类胡萝卜素而可以捕获光谱中不同波长的光[2, 3]。通常LHCI含有Lhca1、Lhca2、Lhca3和Lhca4捕光蛋白, 由核基因编码, 分子量在20~29 kD之间, 在细胞质中合成后在引导肽的作用下被运输进叶绿体并整合到类囊体膜上[2, 4]。根据荧光发射波长的不同, LHCI又分为LHCI-730和LHCI-680两部分, 其中LHCI-730是由Lhca1和Lhca4形成的异源二聚体; LHCI-680由Lhca2和Lhca3形成的同源二聚体[5]。近年来在拟南芥、水稻和杨树中, 又发现了Lhca基因的2个新类型Lhca5和Lhca6, 但因表达量非常低, 导致其在以往的研究中被忽略[6, 7, 8]。
与PSII相比, PSI在植物上的研究较少, 主要是以菠菜、豌豆和大麦等植物为试验材料, 研究其蛋白组成、基因结构和结构生物学[9, 10]。高荣孚等[11]研究油松上的PSI发现存在2种PSI。有报道称, PSI相对于PSII对逆境胁迫抵抗性强, 是某些环境胁迫的最初作用部位[12]。作为PSI中最重要的功能蛋白之一, LHCI蛋白目前的研究主要集中在光能的捕获与传递方面[13], 涉及物种较少, 而且基因结构、编码蛋白的生化特性、进化关系及胁迫应答等方面的研究报道尚少。
甘蔗(Saccharum officinarum L.)是我国和全世界主要的糖料作物和能源作物[14], 同时, 甘蔗的光饱和点高, 属高光效C4作物。高产、高糖和抗逆等农艺性状形成的分子机制一直是甘蔗基础研究中的热点。本研究从甘蔗叶片cDNA文库[15]中获得了甘蔗PSI的Lhca3编码序列, 运用生物信息学方法预测该基因的结构和功能, 明确了该基因编码蛋白的亚细胞定位, 并利用实时荧光定量PCR技术研究了该基因在不同组织中以及不同逆境胁迫下的表达模式, 为进一步研究Lhca家族基因在甘蔗PSI中的功能提供了试验依据。
甘蔗叶片cDNA文库、供试甘蔗品种热带种Badila和健康本氏烟苗株, 均由福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室提供[15]。
使用Badila组培苗研究目的基因受不同外源胁迫后的表达特性。参照侯朝祥等[16]方法, 采用腋芽快繁技术培养Badila组培苗。待苗株高15~25 cm、出现4~5片完全展开叶时, 转移到清水中培养, 28℃下光照16 h/黑暗8 h, 复性培养1周。选取长势一致的幼苗, 进行黑暗(1、3、6和12 d)、重金属镉(50 μ mol L-1 CdCl2, 12、24和48 h)、过氧化氢(10 mmol L-1 H2O2, 3、12和24 h)、ABA (100 μ mol L-1ABA, 3、12和24 h)、高盐(250 mmol L-1 NaCl, 6、12和24 h)和模拟干旱(25% PEG-8000, 6、12和24 h)胁迫处理, 每个处理3个重复, 每个重复3株, 以正常生长条件下的甘蔗幼苗作为对照。另外, 在田间随机选取9株处于分蘖期且长势一致健康的Badila植株, 分成3组, 每组3株。取其白色嫩根、心叶(未展开的叶)、+1叶(甘蔗最高可见肥厚带的第一叶)、侧芽、叶鞘和蔗茎, 用于研究目的基因的空间表达特性。取样后立即将样品用液氮速冻, 置-80℃冰箱保存备用。
采用TRIzol试剂提取样品总RNA, 取1.0 μ L RNA, 以1.0%琼脂糖凝胶电泳检测RNA质量。使用 Nanodrop (Thermo Scientific, USA)测定RNA的浓度, 按照Prime Script RT Reagent Kit使用说明书, 将RNA反转录成cDNA。
对甘蔗叶片cDNA文库进行大规模测序和生物信息学分析[15]。挑取含有目的基因的克隆测序, 获得目的基因的序列。利用NCBI的ORF finder软件, 分析所获cDNA序列的开放阅读框及其推测氨基酸序列, 利用ProtParam (http://expasy.org/tools/protparam.html)预测一级结构, 利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析, 利用TMHMM Server v. 2.0 (http://www.cbs.
dtu.dk/services/TMHMM/)进行跨膜结构域分析, 利用Cell-PLoc (http://www.csbio.sjtu.edu.cn/bioinf/Cell-
PLoc/)进行亚细胞定位分析, 利用Motif Scan (http://prosite.expasy.org/)和Inter Proscan (http://www.
ebi.ac.uk/interpro/scan.html)进行功能结构域分析,
利用DNAMAN进行多序列比对, 利用ClustalX和MEGA5.1构建系统进化树。
根据测序获得ScLhca3的开放读码框(ORF), 设计带有合适酶切位点的特异性引物(表1), 以ScLhca3质粒为模板, 扩增并回收目的基因片段。回收产物经BamH I和EcoR I酶切后, 用T4 DNA连接酶连接到同样双酶切的原核表达载体pGEX-6P-1, 然后转化至大肠杆菌DH5α 感受态细胞, 进行阳性克隆子筛选, 提取阳性克隆质粒用BamH I和EcoR I双酶切鉴定, 将阳性克隆送上海生物工程有限公司测序, 测序结果正确的阳性克隆即为重组质粒, 命名为pGEX-6P-1-ScLhca3。将空质粒pGEX-6P-1和重组质粒pGEX-6P-1-ScLhca3转化入大肠杆菌Rosetta (DE3)中, 挑取单菌落, 接种至含有氨苄青霉素(50 mg L-1 Amp+)的LB液体培养基中, 37℃培养过夜。取1 mL培养物接种至20 mL LB液体培养基(含50 mg L-1 Amp+)中培养至OD600为0.6时, 加入终浓度为1 mmol L-1的IPTG, 37℃诱导12 h, 每2 h取样1 mL。分别取样品300 μ L, 4℃ 8000 × g离心10 min后收集菌体, 加入30 µ L蛋白上样缓冲液, 沸水浴5 min, 常温下12 000 × g离心5 min, 取10 µ L上清液经12% SDS-PAGE电泳检测融合蛋白的表达。
以ScLhca3-GFP-F和ScLhca3-GFP-R为引物(表1), ScLhca3质粒为模板, 扩增ScLhca3完整的ORF。PCR产物经Xba I与BamH I双酶切后, 连入同样双酶切处理的亚细胞定位载体pCAMBIA1302, 转化大肠杆菌DH5α 感受态细胞, 经PCR、双酶切和测序鉴定后, 得到植物表达载体pCAMBIA1302- ScLhca3。按照Green等[17]的方法将植物表达载体转入农杆菌EHA105, 通过菌落 PCR鉴定重组农杆菌。然后取健康的本氏烟叶片, 参照Sparkes等[18]农杆菌侵染方法, 将重组农杆菌注射入健康的本氏烟叶片, 48 h后在激光共聚焦显微镜(Leica TCS SP5 II)下观察本氏烟叶片表皮细胞中ScLhca3蛋白的定位结果。
根据ScLhca3基因的ORF序列, 设计特异性实时荧光定量PCR引物, 以Badila各组织及各胁迫后的叶片cDNA为模板, 以GAPDH基因(表1)为内参基因[19], 按照SYBR Green PCR Master Mix Kit (Roche)说明书配置定量反应体系。实时荧光定量PCR扩增程序为: 50℃ 2 min; 95℃ 10 min; 95℃ 15 s、60℃ 1 min, 循环40次。每个样品设置3次重复, 以无菌水作对照, 采用2-Δ Δ Ct算法进行基因表达水平分析[20]。
| 表1 实验中用到的扩增引物 Table 1 Primers used in this study |
在对甘蔗叶片cDNA文库大规模测序的过程中, 发现了1个与玉米基因(XM_008660371.1)同源性高达96%的基因片段, 序列分析显示, 该基因片段长1009 bp, 包含一个804 bp的ORF, 编码267个氨基酸(图1), 被命名为ScLhca3(GenBank登录号为KU215669)。
 | 图1 获得的ScLhca3基因的cDNA全长序列及其氨基酸序列 * 终止密码子Fig. 1 cDNA sequence and amino acid sequence of ScLhca3gene obtained * stop codon. |
ProtParam分析表明, ScLhca3基因编码的蛋白的分子量为28.91 kD, 等电点为8.96, 不稳定系数为36.56, 脂溶指数为83.75, 总平均疏水性是-0.068, 表明该蛋白可能是一种亲水蛋白。利用SignalP 4.1 Server在线软件对ScLhca3蛋白的信号肽预测表明, 该蛋白不含信号肽, 是非分泌蛋白。根据TMHMM Server v. 2.0在线分析, ScLhca3蛋白具有3个明显的跨膜区域, 分布在第95~121、第137~160、第220~ 249位区域, 膜向性分别为i→ o、o→ i、i→ o。用Cell-PLoc进行亚细胞定位分析表明, ScLhca3蛋白定位于叶绿体。使用 Inter Proscan和Motif Scan在线分析软件对 ScLhca3蛋白进行分析, 显示第55~238位包括一个典型的捕光叶绿素a/b结合蛋白功能域(chlorophyll a/b binding domain); 第8~10、第25~27、第208~210和第263~265位为蛋白激酶C的磷酸化位点(protein kinase C phosphorylation site); 第58~61、第76~79和第208~211位为酪蛋白激酶II磷酸化位点(Casein kinase II phosphorylation site); 第62~67、第104~109和第237~242位为N-肉豆蔻酰位点(N-myristoylation site)。
使用NCBI网站的Blastp搜索ScLhca3的同源序列, 选择玉米(Zea mays, XP_008658593.1)、谷子(Setaria italica, XP_004965906.1)、水稻(Oryza sativa, BAD25284.1)、二穗短柄草(Brachypodium distachyon, XP_010233979.1)、乌拉尔图小麦(Triticum urartu, EMS56059.1)、拟南芥(Arabidopsis thaliana, NP_ 001185280.1)、大豆(Glycine max, NP_001276264.1)、 葡萄(Vitis vinifera, XP_002273201.1)、盐芥(Eutrema halophilum, BAJ33764.1)、豌豆(Pisum sativum, AAA84545.1)的Lhca3蛋白序列进行氨基酸同源性分析。结果如图2所示, 甘蔗ScLhca3蛋白与其他物种Lhca3蛋白在N端保守性较差, C端有较大的保守性, 且与玉米、谷子、水稻、乌拉尔图小麦和二穗短柄草的蛋白相似度分别为98.5%、98.8%、82.1%、81.4%和81.7%, 表明ScLhca3基因编码的氨基酸序列与单子叶植物的同源性较高。
 | 图2 甘蔗ScLhca3蛋白与其他植物种蛋白的氨基酸序列比对Fig. 2 Homology analysis of sequences from sugarcane ScLhca3 and those of other species |
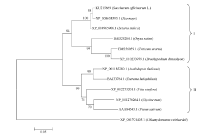
以莱茵衣藻(Chlamydomonas reinhardtii, XP_ 001701405.1)的Lhca3蛋白序列作为外源序列, 使用ClustalX和MEGA5.1软件, 采用NJ法(BootStrap 1000)构建进化树, 分析ScLhca3蛋白与其他物种Lhca3蛋白的进化关系, 结果如图3所示。单子叶植物和双子叶植物的Lhca3蛋白明显属于两大不同的分支, 且在单子叶植物分支中, 甘蔗与同属C4植物的玉米和谷子为同一分支, 而同属C3植物的水稻、小麦和二穗短柄草为另一分支。这表明, 该基因在遗传进化上具有明显的种属差异性, 它们对应的蛋白属于同一个家族。
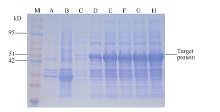
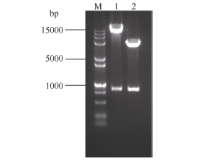
将重组质粒测序, 并用BamH I和EcoR I双酶切电泳检测。从图4泳道2中可以看出, 重组质粒经过双酶切之后电泳结果出现5000 bp左右的载体片段和800 bp左右的目的基因, 结合测序结果证明, ScLhca3和表达载体pGEX-6P-1重组成功。图5中重组质粒SDS-PAGE电泳结果显示, 在分子量54 kD左右处可见一条特异性条带, 且随诱导时间的延长, 蛋白浓度逐渐增加。ScLhca3蛋白约为28.91 kD, 加上pGEX-6P-1载体上26 kD大小的GST标签蛋白, 因此与预测的蛋白大小基本相符, 可以确定该融合蛋白成功表达。
重组荧光定位表达载体pCAMBIA1302-ScLhca3经酶切和测序验证后(图4泳道1), 转化到农杆菌 EHA105中, 通过烟草瞬时表达体系表达了ScLhca3和GFP的融合蛋白, 于激光共聚焦显微镜下观察融合蛋白绿色荧光在细胞中的分布, 结果如图6所示。对照GFP在烟草表皮细胞中大量表达, 绿色荧光信号在细胞质、质膜和细胞核中均有分布; 而ScLhca3-GFP融合蛋白主要定位于叶绿体中, 定位结果与生物信息学分析预测一致。
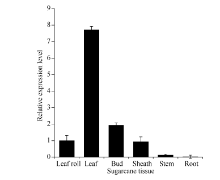
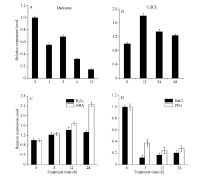
基于实时荧光定量PCR技术, 以心叶的表达量
为参照基准, 采用2-Δ Δ Ct法对甘蔗各组织ScLhca3基因表达量的分析结果如图7所示。ScLhca3基因的表达具有明显的组织特异性, 在不同组织中的表达量差异较大, 其中在成熟叶片中相对表达量最高, 侧芽、心叶和叶鞘中次之, 茎中微量表达, 根中几乎不表达。
根据荧光定量PCR的数据分析ScLhca3基因在不同外源胁迫下的相对表达量, 如图8所示。ScLhca3能够被CdCl2、H2O2和ABA强烈诱导上调表达。不同的是, 在CdCl2和H2O2胁迫下, ScLhca3的表达量均在12 h达到最大值, 随后下降, 呈上调和恢复的模式, 但从总体看来均高于对照; 而在ABA条件下, ScLhca3的表达量则随时间的增加而增加。另外, 在黑暗、PEG和NaCl胁迫下, ScLhca3基因的相对表达量显著下调。其中, 在PEG和NaCl胁迫下, ScLhca3的表达量急剧下降; 在黑暗条件下, ScLhca3的表达量则随时间的增加呈逐渐下降趋势。
光合作用是光合生物(包括绿色植物、藻类和某些细菌)体内最为重要的同化作用, 是地球上所有生命现象的能量和物质基础。PSI作为光合作用过程中最重要的复合物之一, 在电子转移、抵抗逆境及状态转换等方面起着重要的作用[2, 12]。LHCI蛋白作为PSI中重要的组成部分, 通过与叶绿素结合在光合作用中发挥作用[6, 13]。本研究以具有高光效特性的C4植物甘蔗为试验材料, 获得了ScLhca3基因。生物信息学分析表明, 该基因所编码的蛋白包含一个典型的植物捕光叶绿素a/b结合蛋白的功能域, 推测其可能在与色素分子结合的过程发挥作用; 具有蛋白激酶C的磷酸化位点、酪蛋白激酶II磷酸化位点、N-肉豆蔻酰位点, 这可能与该基因转录后的调节有关[21]。以Lhca3蛋白序列为基础的进化树表明, 该基因在进化过程中呈现出明显的分支, 种属差异性显著。同时, 在单子叶的C4植物分支中, ScLhca3基因与玉米在同一分支, 亲缘关系最近, 表明该基因在近缘物种间的保守性更高。蛋白执行功能与其能否处于正确的场所密切相关。农杆菌侵染烟草试验证实了ScLhca3蛋白定位在叶绿体, 与预测结果一致, 为ScLhca3蛋白与色素分子结合参与光合作用的研究提供了依据。
组织特异性表达分析表明, ScLhca3在甘蔗成熟叶片中的表达量最高, 侧芽、心叶、叶鞘和茎中次之, 根中最低, 这一表达规律与Frank等[7]的研究结果是一致的, 并且这种分布与LHC作为捕光色素结合蛋白基因在光合作用的光反应场所— — 叶绿体的类囊体中表达的结论相符[2]。光合作用主要发生在植物的叶片中, 大量的光能通叶片吸收, 根中几乎不接收光, ScLhca3在甘蔗成熟叶片中的大量表达, 根中几乎不表达, 暗示了该基因可能为植物光合作用所必需。目前, 在拟南芥中Lhca1、Lhca2、Lhca3和Lhca4基因都是以单拷贝形式存在于基因组, 以二聚体形式单独地结合PSI [7], 而在甘蔗中, Lhca3 基因以何种形式结合在PSI上, 有待深入研究。
在Lhc基因家族中, PSII中Lhcb基因的表达受多种逆境胁迫的调控(如氧胁迫、盐胁迫和激素信号ABA [22, 23]), 但关于PSI中Lhca基因在逆境胁迫条件下的应答调控鲜有报道。本研究表明, CdCl2、H2O2和ABA均可诱导ScLhca3基因的上调表达, 推测该基因可能在甘蔗抗重金属、氧胁迫和ABA 信号通路中具重要的保护功能。有研究表明, 植物对重金属的富集能力与能量代谢密切相关[24]。甘蔗作为一种潜在的耐重金属胁迫的超富集植物[25], 这种特性必然与其是高光效C4作物相关, 而ScLhca3基因是否在甘蔗这种特性中发挥关键性作用, 目前尚不清晰, 需要进一步的试验验证。另外, 在黑暗、PEG和NaCl胁迫条件下, ScLhca3基因的表达量显著下降, 这可能是影响了叶绿素的合成和叶绿体的正常生理状态, 进而影响了光合作用[26, 27], 致使甘蔗体内Lhca3基因的需求量降低。这是关于甘蔗Lhca基因家族在胁迫应答方面的首次报道, 为深入研究Lhca基因的功能提供了条件。有趣的是, 本研究还发现, 在镉胁迫、氧胁迫、盐胁迫、黑暗胁迫和干旱胁迫条件下, 对ScLhca3基因表达量的影响与前人对PSII中Lhcb基因的研究结果一致[22, 23, 28, 29, 30]; 而在PSII中, ABA对Lhcb mRNA具有负调控作用[31], 与我们对PSI中ScLhca3的研究结果明显不同。这表明, Lhca基因和Lhcb基因的表达既存在功能上的相似性又有其各自的特异性, 同时, 也体现了PSI和PSII在光合作用以及对逆境胁迫的适应中可能发挥不同的作用。因此, ScLhca3的克隆为研究Lhca家族基因在甘蔗中的功能创造了条件, 为进一步研究甘蔗高效光合作用的分子机制奠定了基础, 同时, 也为研究甘蔗耐重金属胁迫提供了新的方向。
本研究克隆了甘蔗Lhca3基因(GenBank登录号为KU215669)。该基因编码的蛋白被定位于叶绿体, 无信号肽, 存在3个明显的跨膜区域, 是一种亲水性非分泌膜蛋白。ScLhca3的表达具有明显的组织特异性, 对干旱、黑暗、盐、重金属镉、过氧化氢以及ABA胁迫均有表达响应, 表明它可能参与甘蔗的抗逆应答。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|