第一作者联系方式: E-mail:18847123096@163.com
干旱胁迫对向日葵发芽出苗有重要影响。以K55×K58组合衍生的187个F6重组自交系为材料, 利用SSR、SRAP、AFLP标记构建向日葵高密度遗传连锁图谱, 设置正常水分(CK)和模拟干旱(18%聚乙二醇PEG-6000)两种水分条件, 调查9个芽期数量性状, PCR扩增株系, 构建一张包含17个连锁群、1105个标记(368个SSR、368个SRAP和369个AFLP)的高密度遗传连锁图谱。该图谱覆盖基因组长度3846.0 cM, 平均图距3.48 cM, 连锁群长度147.6~295.5 cM, 每个连锁群标记数10~165个。两种条件下检测到33个QTL, 其中干旱条件下检测到发芽指数、发芽率、胚芽长、胚根长、胚芽鲜重和胚根鲜重6个性状的14个QTL, 可解释6.1%~14.0%的表型变异; 正常水分(CK)条件下检测到发芽势、胚根长、胚芽鲜重、胚根鲜重、胚根干重和胚芽干重6个性状的19个QTL, 可解释6.1%~25.8%的表型变异。两种水分条件下检测到 Qefw5-1、Qefw5-2、Qefw5-4、Qrfw5、Qrfw10和 Qrl9共6个QTL的遗传贡献率超过10%, 此外, 还检测到9个影响干旱胁迫与正常水分条件下性状差值的QTL, 可能对抗旱性有直接贡献。这些QTL可为向日葵芽期抗旱分子设计育种研究提供重要参考。
Seed germination and emergence of sunflower are seriously affected by water stress. In this study, SSR, SRAP, and AFLP markers were applied to construct a genetic linkage map by using the F6 population derived from a cross of K55 (drought sensitive) × K58 (drought resistant). For mapping quantitative trait loci (QTLs) for nine traits of seed germination in sunflower, the parents and 187 F6 family lines were used to investigate seed germination traits under normal condition (CK) and 18% polyethylene glycol (PEG-6000) (drought stress). A genetic map consisting of 17 linkage groups was constructed with 1105 loci (368 SSR, 368 SRAP, 369 AFLP) which covers 3846.0 cM and the length of each linkage group varies from 147.6 to 295.5 cM, the number of markers in each linkage group varies from 10 to 165 with an average distance of 3.48 cM. As a result, a total of 33 QTLs were detected. We identified fourteen additive QTLs for germination index (GI), germination rate (GR), embryo length (EL), radicle length (RL), embryo fresh weight (EFW), radicle fresh weight (RFW) under18% PEG condition with explained phenotypic variance ranging from 6.1% to 14.0%. Nineteen additive QTLs were identified for germination energy(GE), radicle length (RL), embryo fresh weight (EFW), radicle fresh weight (RFW), embryo dry weight (EDW), radicle dry weight (RDW) under normal condition with explained phenotypic variance ranging from 6.1% to 25.8%. Each of Qefw5-2, Qefw5-1, Qefw5-4, Qrfw10, Qrfw5, and Qrl9 could explain phenotypic variance over 10%. Nine QTLs affecting trait differences between stress treatment and control were identified, which are considered to directly contribute to drought tolerance. These QTLs identified could provide important reference to molecular breeding for drought-resistance during seed germination in sunflower.
向日葵是世界第四大油料作物, 也是我国主要油料作物。由于其具有耐旱、耐瘠薄的特点, 广泛种植于干旱、半干旱地区, 但这些地区降水量不足且时空分布不均, 干旱问题频发, 已成为向日葵减产的最主要非生物胁迫因素。发芽出苗期作为向日葵生长发育的第一阶段, 芽期抗旱性直接关系到出苗情况, 进而影响后续的生长发育及产量[1], 发芽率、发芽势、发芽指数、胚芽、胚根的长度、鲜重、干重均为衡量种子萌发状况的主要指标, 与芽期抗旱性密切相关[2, 3, 4]。作物抗旱性属多基因控制的复杂性状, 分子标记技术及QTL定位的发展为复杂数量性状的研究及遗传改良提供了有力的工具[5]。
高密度分子遗传连锁图谱的构建是进行QTL定位的基础, 自第一张向日葵图谱使用RAPD标记构建完成以来[6], RFLP、AFLP、SSR等标记被相继成功应用于向日葵遗传连锁图谱构建, 其中较具参考价值的是Tang等[7]利用F7重组自交系群体构建的含有459个SSR标记、平均距离3.1 cM、总长度1368.3 cM的遗传连锁图谱。以SNP标记为代表的第3代分子标记用于向日葵图谱构建方面, John等[8]利用4个群体构建了一张含有10 080个SNP标记的向日葵遗传连锁图谱, Zahirul等[9]利用3个F2群体构建一张向日葵遗传连锁图谱, 该图谱包含SNP标记5019个、SSR标记118个。国内向日葵图谱构建研究进展缓慢, 黄先群等[10]于2012年利用SSR标记加密了遗传图谱, 本实验室利用SSR和AFLP标记构建了一张包含495个标记、平均距离5.6 cM、总长度为2759.4 cM的遗传连锁图谱[11]。向日葵相关性状QTL的定位研究来自国外的较多, 不同水分条件下的株高、茎粗、开花期、水分利用率等性状的QTL均被定位到图谱上[12, 13, 14], 但有关不同水分条件下芽期性状QTL定位研究国内外鲜有报道。本研究拟利用SRAP和SSR标记整合本实验室已有的SSR和AFLP标记[11], 构建一张高密度遗传连锁图谱, 结合2种水分条件下芽期9个性状的表型值, 进行QTL定位分析, 为解析向日葵水、旱条件下芽期相关性状QTL及遗传效应和分子标记辅助育种奠定坚实的研究基础。
以抗旱性差异显著的油用向日葵自选自交系K55 (弱抗旱性)、K58 (强抗旱性)为亲本, 杂交获得F1代, 采用单粒传的方法经过连续自交获得F6重组自交系(RILs)群体, 共187个株系。
按照陈雪等[15]的方法, 设置正常水分(CK)和模拟干旱胁迫(18%聚乙二醇PEG-6000) 两种水分条件, 调查9个芽期性状。选取亲本及187个株系各50粒饱满种子, 经消毒处理(75%酒精消毒30 s, 0.1%的HgCl2消毒8 min, 蒸馏水漂洗2次), 置铺有2层滤纸的培养皿(150 mm)中, 分别加5 mL的18% PEG-6000溶液和蒸馏水, 每个处理重复3次, 于25℃恒温光照培养箱中(光照8 h/黑暗16 h)培养10 d, 期间每天更换滤纸以保持恒定PEG浓度。种子置床后第2天开始, 每天统计种子发芽数, 第4天计算发芽势(%)(germination energy, GE), 发芽结束后计算发芽率(%)(germination rate, GR)、发芽指数(germination index, GI), 从每个重复培养皿中随机选取20株测量胚芽长度(cm)(embryo length, EL)、胚根长度(cm)(radicle length, RL), 称量胚芽鲜重(g)(embryo fresh weight, EFW)、胚根鲜重(g)(radicle fresh weight, RFW), 将称过鲜重的胚芽、胚根105℃烘干30 min, 85℃烘干8 h后称量胚芽干重(g) (embryo dry weight, EDW)、胚根干重(g)(radicle dry weight, RDW)。
发芽率(%)=发芽结束时正常幼苗数/供试种子总数× 100%
发芽势(%)=第4天时发芽的种子粒数/供试种子数× 100%
发芽指数=∑ Gt/Dt, Gt为第t天发芽种子数, Dt为相对应的发芽试验天数。
选取向日葵苗期鲜嫩真叶, 用TIANGEN试剂盒提取双亲及187个株系的基因组DNA。SSR引物ORS系列来自NCBI (http://www. ncbi.nlm.nih.gov/), Ha系列来自Paniego等[16]的文献; SRAP引物来自于Li和Quiros等[17]的文献, 引物由上海生工生物工程有限公司合成。参照房冬梅等[18]和于志贤等[19]改进的PCR体系及程序。
在统计位点时, 对SSR和SRAP标记均采用A, B矩阵, 即和亲本K55带型一样的记作A, 和亲本K58带型一样的记作B, 缺失或模糊不清的带用“ -” 表示。采用引物组合名称命名标记, 同一引物扩增的不同片段加1、2、3代表片段由大到小, 对分离带型以孟德尔分离比1∶ 1进行卡方测验。
应用JoinMap 4.0软件构建图谱, 采用Kosambi函数计算图谱距离, LOD值定为4.0。分析芽期9个性状3次重复的平均值, 利用SPSS17.0软件进行性状表型分析及正态分布检测, 以两种条件下的性状表型值及其干旱与对照的差值为输入数据, 利用Map QTL4.0软件进行QTL定位及效应分析, 将LOD≥ 2.5作为QTL存在的判定标准。
利用560对SSR引物和388对SRAP引物在双亲中筛选, 得到多态性引物266对, 其中SSR引物164对, SRAP引物102对, 引物多态性比率分别为29.29%和26.29%。利用多态性引物在重组自交系群体187个株系中, 共检测到SSR标记位点1025个, 其中多态性位点405个, 多态率为39.51%, 平均每对引物组合扩增出多态性位点2.53个; SRAP标记位点997个, 其中多态性位点430个, 多态率为43.13%, 平均每对引物组合扩增出4.22个。
根据在重组自交系群体F6检测到的835个(405个SSR和430个SRAP)多态性标记, 结合实验室前期在F5:6重组自交系群体检测得到的577个多态性标记(184个SSR标记及393个AFLP标记)共计1412个标记数据, 利用 JoinMap 4.0软件进行遗传连锁分析, 获得一张包含17个连锁群的高密度多标记油葵分子遗传图谱(图1), 该图谱总长度为3846.0 cM, 连锁群长度在147.6~295.5 cM之间, 平均每个连锁群长度为226.2 cM; 图谱含1105个标记(368个SSR、368个SRAP和369个AFLP), 每个连锁群标记数有10~165个不等、平均为65个, 相邻两两标记间的平均距离为3.5 cM。图谱中标记分布不均匀(表1), 标记数最多的连锁群为第8连锁群, 有165个标记, 最少的连锁群是第15和17连锁群, 有10个标记; 相邻标记间的距离也不同, 图谱中相邻两标记之间距离≤ 10 cM的有1016个, 占93.38%, 相邻标记间距离最小为0 cM; 相邻两标记之间距离≥ 20 cM的有30个, 距离最大为68.4 cM, 位于第15连锁群上的ORS-734-2和ORS-1143-2之间。连锁群中共有333个偏分离标记, 占图谱总标记数的31.68%, 这些偏分离标记在图谱上共形成共有27个偏分离热点区域(SDR), 分布于1、2、4、5、6、7、8、9、11、12、15、16连锁群上。
新构建的图谱与AFLP和SSR标记构建的原图谱[11]比较, 长度增加了1086.6 cM, 新增位点610个, 平均距离缩小了2.1 cM, 偏分离比率降低了2.66%。
| 表1 图谱中连锁群标记及其分布 Table 1 Markers of linkage groups and their distribution |
由表2可见, 模拟干旱条件下, 亲本及后代重组自交系群体的发芽率、发芽势等9个芽期相关性状均表现显著降低, 其中亲本K58各性状平均降低48.01%, K55降低58.81%, 说明干旱胁迫明显抑制向日葵种子的萌发, 且亲本K58对干旱胁迫的敏感性显著低于K55。干旱胁迫下, 除胚根干重外, 其他8个性状的变异系数都有不同程度的增加, 其中发芽率增加幅度最大, 为65%, 说明各株系的不同性状间对干旱胁迫的响应差异较大。除胚根长度差值偏度略大于1外, 其余各性状的偏度和峰度的绝对值均小于1, 分离的连续性符合正态分布, 具有数量性状特点, 适合作进一步的QTL定位分析。
| 表2 亲本及RIL群体水、旱条件下芽期相关性状的表现 Table 2 Phenotypic performance of seed germination traits in RILs under water and drought conditions |
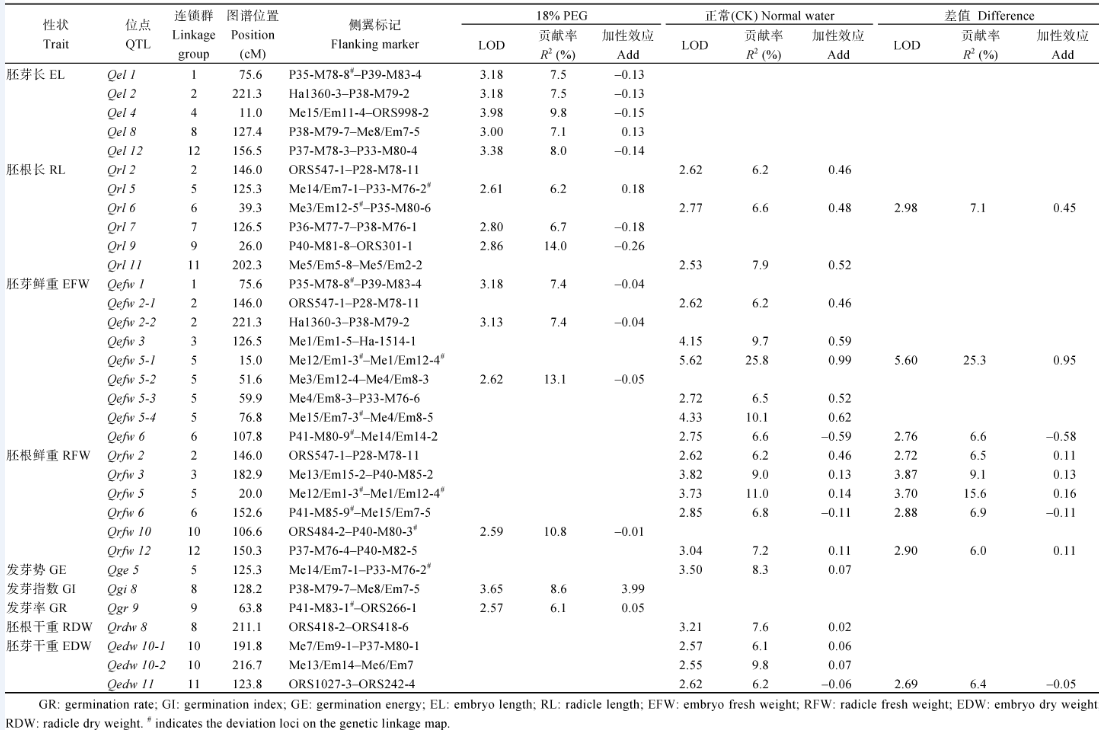
2.4.1 正常水分(CK)条件下芽期相关性状QTL定位 分别检测到发芽势、胚根长、胚芽鲜重、胚根鲜重、胚根干重和胚芽干重6个性状的19个QTL, 分别解释8.3%、20.7%、64.9%、26.2%、7.6%和22.1%的表型变异。其中, 1个发芽势QTL, 位于第5连锁群, 可解释表型变异的8.3%, 加性效应0.07, 增效基因来自K55。3个胚根长QTL, 分别位于第2、第6、第11连锁群上, 可解释表型变异的6.2%、6.6%和7.9%, 加性效应0.46、0.48和0.52, 增效基因均来自K55。6个胚芽鲜重QTL, 分别位于第2、第3、第5、第9连锁群, 可解释表型变异的6.2%、9.7%、25.8%、6.5%、10.1%和6.6%, 加性效应0.46、0.59、0.99、0.52、0.62和-0.59, 除Qefw6增效基因来自K58外, 其余QTL的增效基因均来自K55。5个胚根鲜重QTL, 分别位于第2、第3、第5、第6连锁群, 可解释表型变异的6.2%、9.0%、11.0%、6.8%和7.2%, 加性效应0.46、0.13、0.14、-0.11和0.11, 除Qrfw6增效基因来自K58外, 其余QTL的增效基因均来自K55。3个胚芽干重QTL, 分别位于第10、第11连锁群, 可解释表型变异的6.1%、9.8%和6.2%, 加性效应0.06、0.07和-0.06, Qedw10-1和Qedw10-2增效基因来自K55, Qedw11增效基因来自K58。1个胚根干重QTL, 位于第8连锁群, 可解释表型变异的7.6%, 加性效应0.02, 增效基因来自K55。
2.4.2 模拟干旱条件下芽期相关性状QTL定位
检测到发芽指数、发芽率、胚芽长、胚根长、胚芽鲜重和胚根鲜重6个性状的14个QTL, 分别解释8.6%、6.1%、49.9%、18.9%、10.8%和17.9%的表型变异。其中, 1个发芽指数QTL, 位于第8连锁群, 可解释表型变异的8.6%, 加性效应3.99, 增效基因来自K55; 1个发芽率QTL, 位于第9连锁群, 可解释表型变异的6.1%, 加性效应0.05, 增效基因来自K55; 5个胚芽长QTL, 分别位于第1、第2、第4、第8、第12连锁群, 可解释表型变异的7.5%、7.5%、9.8%、7.1%和8.0%, 加性效应-0.13、-0.13、-0.15、0.13和-0.14, 除Qel8增效基因来自K55外, 其余QTL的增效基因均来自K58。3个胚根长QTL, 分别位于第5、第7、第9连锁群, 可解释表型变异的6.2%、6.7%和14.0%, 加性效应0.18、-0.18和-0.26, Qrl5的增效基因来自K55, Qrl7、Qrl9增效基因来自K58。3个胚芽鲜重QTL, 分别位于第1、第2、第5连锁群, 可解释表型变异的7.4%、7.4%和13.1%, 加性效应-0.04、-0.04和-0.05, 增效基因来自K58。1个胚根鲜重QTL, 位于第10连锁群, 可解释表型变异的10.8%, 加性效应-0.01, 增效基因来自K58。
2.4.3 两种水分条件下QTL比较分析 检测到的QTL中, 3个性状的5个QTL只在正常水分(CK)条件下被检测到, 包括胚根鲜重QTL Qrdw8、Qedw10-1、Qedw10-2、Qedw11和胚芽鲜重QTL Qge5, 占总QTL的15%; 3个性状的7个QTL只在18%PEG模拟干旱条件下被检测到, 包括胚芽长QTLQel1、Qel2、Qel4、Qel8、Qel12, 发芽指数QTLQgi8和发芽率QTLQgr9, 占总QTL的21%; 3个性状的21个QTL在两种条件下均被检测到, 包括胚芽鲜重QTL Qefw1、Qefw2-1、Qefw2-2、Qefw3、Qefw5-1~Qefw5-4、Qefw6, 胚根长QTL Qrl2、Qrl5、Qrl6、Qrl7、Qrl9、Qrl11, 胚根鲜重QTL Qrfw2、Qrfw3、Qrfw5、Qrfw6、Qrfw10、Qrfw12, 占总QTL的64%, 其中6个遗传贡献率超过10%的主效QTL分别是Qefw5-1 (25.8%)、Qefw 5-2 (13.1%)、Qefw5-4 (10.1%)、Qrfw5 (11.0%)、Qrfw10 (10.8%)、Qrl9 (14.0%), 占总QTL的18.2%。两种水分条件下未检测到位点一致QTL, 仅胚芽鲜重QTL (Qefw5-2、Qefw5-3)在水、旱两种条件下定位在第5连锁群Me4/Em8-3的相近位置。正常水分(CK)条件下检测到的19个QTL中, 16个QTL加性效应为正值, 表明多数的增效基因来自于K55, 干旱胁迫条件下检测到的14个QTL中, 10个QTL加性效应负值, 表明多数的增效基因来自于K58。检测到的33个QTL在第1、第2、第5和第8连锁群上有成簇分布现象。
2.4.4 差值QTL 共检测到9个干旱胁迫与正常水分条件差值的QTL, Qrl6对胚根长在干旱与对照条件下的差值有贡献, Qefw5-1、Qefw6对胚芽鲜重在两种条件下的差值有贡献, Qrfw2、Qrfw3、Qrfw5、Qrfw6、Qrfw12对胚根鲜重在两种条件下的差值有贡献, Qedw11对胚芽干重在两件条件下的差值有贡献, 其中K58等位基因在Qefw6、Qrfw6、Qedw11位点降低两种水分条件的差值, K55等位基因在Qrl6、Qefw5-1、Qrfw2、Qrfw3、Qrfw5、Qrfw12位点降低两种水分条件的差值即增加性状在不同环境下的稳定性。
| 表4 两种条件下芽期相关性状QTL定位结果 Table 4 QTL analysis of seed germination traits under two conditions |
本研究在前期用SSR和AFLP标记构建向日葵遗传图谱的基础上, 增加SRAP标记, 探讨多种标记结合构建遗传图谱的效果。SRAP标记主要对开放阅读框(ORF)扩增, 而对基因组相对较少的着丝粒附近以及端粒的扩增薄弱, SSR标记则可以对这些区域扩增, 并且通常用作锚定标记。AFLP标记利用酶切组合对DNA酶切产生多态性, 多态性高, 在图谱构建时通常与其他标记相结合, 对图谱加密[20]。将3种分子标记相结合, 易获得均匀覆盖整个基因组的饱和连锁图[21]。本试验利用SRAP、SSR及AFLP标记相结合构建的图谱覆盖度明显提高, 长度由原来的2759.4 cM[11]增加到3846.0 cM, 增加了1086.6 cM, 位点由495个标记增加到1105个标记, 平均距离由5.57 cM缩短到3.48 cM, 偏分离比例从34.34%降低到31.68%。原图谱中有较多处分子标记聚集区域, 新构建图谱上分子标记分布较为均匀, 饱和度更高, 能够满足QTL定位要求。已有较多选用2~3个标记组合构建遗传连锁图谱的研究报道[21, 22, 23], 与本研究结果相同, 多数研究指出, 多个标记结合使用可以充分利用标记间互补优势, 更有利于构建标记均匀分布、高密度、高饱和性的分子遗传图谱。
不同性状在不同环境下QTL的表达水平有所不同。本研究检测到的两种条件下9个性状的33个QTL中, 21%和15%分别在18%PEG干旱胁迫下和正常水分条件下特异表达, 64%在两种水分条件下均表达, 但没有检测到稳定表达的一致QTL, 说明本试验中不同水分处理下向日葵芽期相关性状QTL稳定性较差。多数研究认为, 只有在两种环境下表现相似的QTL可能对抗旱性有直接贡献, 而受干旱诱导的QTL 可能与耐旱性反应有关, 但未必对耐旱性有实质性贡献[24, 25, 26], 本研究中, 胚芽鲜重、胚根鲜重及胚根长3个性状的QTL在两种水分条件下均被检测到, 其中位于第5连锁群控制胚芽鲜重QTL Qefw5-1、Qefw 5-2、Qefw5-4, 位于第5和第10连锁群控制胚根鲜重QTL Qrfw5、Qrfw10以及第9连锁群控制胚根长QTL Qrl9遗传贡献率都大于10%, 这些受环境影响较小且效应值较大的主效QTL有望应用于芽期抗旱分子标记辅助选择。此外, 第5连锁群18%PEG胁迫下定位到的Qefw5-2与正常水分下定位到的Qefw5-3位点在位置上非常接近, 有待于探讨是否为同一位点。另外检测到的9个QTL包括5个RFW(Qrfw2、Qrfw3、Qrfw5、Qrfw6、Qrfw12)、2个EFW (Qefw5-1、Qefw6)、1个RL (Qrl6)、1个EDW (Qedw11), 对各芽期性状在2种条件下的差值有贡献, 研究表明, 这些QTL能够解释干旱胁迫所造成表型变化的净值, 对抗旱有直接贡献[24]。
QTL的“ 成簇” 分布现象在动植物中普遍存在, 本研究检测到6处QTL“ 成簇” 分布区域。第1连锁群控制胚芽长的Qel1、控制胚芽鲜重的Qefw1均位于P35-M78-8~P39-M83-4标记区间且与P42-M83-4紧密连锁, 说明该区间可能存在控制胚芽生长的QTL; 第2连锁群控制胚根长的Qrl2、控制胚芽鲜重的Qefw2-1、控制胚根鲜重的Qrfw2均位于ORS547-1-P28-M78-11标记区间且与Me7/Em3-2紧密连锁, 说明该区间可能存在同时控制胚芽、胚根生长的QTL, 控制胚芽长的Qel2、控制胚芽鲜重的Qefw2-2均位于Ha1360-3-P38-M79-2标记区间且与P39-M85-4紧密连锁, 说明该区间可能存在控制胚芽生长的QTL; 第5连锁群控制发芽势的Qge5、控制胚根长的Qrl5均位于Me14/Em7-1-P33-M76-2标记区间且与Me3/Em7-3紧密连锁, 说明该区间可能存在控制发芽势及胚根生长的QTL, 控制胚芽鲜重的Qefw5-1、控制胚根鲜重的Qrfw5均位于Me12/Em1-3-Me1/Em12-4标记区间且均为贡献率大于10%的主效QTL, 表明该区间可能存在效应值较大的多效性主效QTL。第8连锁群控制胚芽长的Qel8、控制发芽指数的Qgi8均位于P38-M79-7- Me8/Em7-5标记区间, 说明该区间可能存在控制发芽指数及胚根生长的QTL。QTL“ 成簇” 分布的现象从遗传学角度通常表现为一因多效、基因连锁或重叠, 可能由于一些关键因子的存在而同时控制多种代谢途径, 从而表现出多效性, 使相关性状在自然选择过程中形成相互适应的有利性状[27]。下一步对这些成簇分布的QTL精细定位, 在分子标记辅助选择时可以同时对多个性状进行遗传改良, 提高抗旱育种的选择效率, 但也应注意可能存在遗传累赘, 尽量打破不利连锁。
利用K55× K58的RIL群体构建了覆盖向日葵基因组3846.0 cM的分子遗传连锁图谱, 图谱共有17个连锁群, 1105个标记位点, 平均图距为3.5 cM。每个连锁群上标记数在10~165个之间, 长度在147.6~295.5 cM之间。在两种水分条件下对发芽率、发芽势、发芽指数、胚芽长、胚根长、胚芽鲜/干重和胚根鲜/干重9个芽期相关性状进行了QTL定位及分析, 共检测到33个QTL, 包括18%PEG模拟干旱胁迫条件下6个性状的14个QTL, 正常水分(CK)条件下6个性状的19个QTL。检测到Qefw 5-1、Qefw 5-2、Qefw 5-4、Qrfw 5、Qrfw 10和Qrl9共6个主效QTL, 同时检测到9个差值QTL, 分别为Qrl 6、Qefw 5-1、Qefw 6、Qrfw 2、Qrfw 3、Qrfw 5、Qrfw 6、Qrfw 12和Qedw 11, 对抗旱性有直接贡献。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|