第一作者联系方式: 苏亚春, E-mail:syc2009mail@163.com; 黄珑, E-mail:373889724@qq.com
植物细胞周期依赖性蛋白激酶(cyclin-dependent kinases, CDKs)是一类丝氨酸/苏氨酸蛋白激酶, 与周期蛋白(Cyclins)协同作用, 是重要的细胞周期性调控因子。本研究从甘蔗受花叶病毒侵染的转录组数据库中获得一条与高粱( Sorghum bicolor) CDK基因(GenBank登录号为XP_002466536.1)高度同源的Unigene序列, 通过RT-PCR扩增获得长度为1799 bp的甘蔗 ScCDK基因(GenBank登录号为KR258796)。序列分析显示 ScCDK基因含一个完整的开放阅读框(65~1603 bp), 编码512个氨基酸, 且具有CDK典型保守结构域, 如ATP结合位点、磷酸结合位点及活化环A-loop。此外, 生物信息学预测显示该基因编码的蛋白定位于细胞核, 为可溶性蛋白, 不存在信号肽, 二级结构元件多为无规则卷曲, 主要参与蛋白翻译。实时荧光定量PCR分析表明, ScCDK基因的表达具有组织特异性, 其在蔗芽上的表达量最高, 其次是在蔗肉、蔗根、叶鞘和蔗皮中; 在PEG、NaCl和ABA的胁迫诱导过程中, ScCDK均表现上调作用, 且受ABA胁迫后表达量最高, 约为对照组的1.9倍。推测该基因的表达与甘蔗抗干旱和抗渗透胁迫有关, 同时受ABA的诱导, 参与细胞周期分裂。
Plant cyclin-dependent kinases (CDKs) are a specific class of serine/threonine protein kinases, which synergize with cyclins and play an important role in the process of cell regulation. In this study, a unigene that was highly homologous to the Sorghum biocolor CDK sequence (GenBank accession No. XP_002466536.1) was isolated from the sugarcane transcriptome in response to Sorghum mosaic virus (SrMV) infection. This gene was validated by RT-PCR and named as ScCDK (GenBank accession No. KR258796). ScCDK has a full-length cDNA of 1799 bp and contained a complete open reading frame (65-1603 bp) encoding 512 amino acids. The ScCDK protein contains the typical conservative CDK domains, such as ATP binding site, polypeptide substrate binding site and activation loop. Bioinformatics prediction indicated that ScCDK is soluble protein located in cell nucleus, very likely involved in intermediary metabolism, and has no signal peptide but with random coil according to its secondary structure. qRT-PCR assay revealed that ScCDK gene had tissue-specific expression in sugarcane, with the highest expression level in bud, followed by stem pith, root, leaf sheath and epidermis. The gene expression level was up-regulated by PEG, NaCl, and ABA, particularly ABA treatment resulted in 1.9-fold higher expression of ScCDK compared to the control. These results suggest that ScCDK participates in the response of drought and osmotic stresses and the cell cycle division in sugarcane and can be induced by ABA.
细胞周期(cell cycle)是指细胞从一次有丝分裂开始到下一次有丝分裂结束所经历的全过程, 主要包括间期(G1期、S期和G2期)和分裂期(M期) 2个过程[1]。细胞间期是真核生物细胞有丝分裂或者减数分裂的准备时期, 在这一阶段完成DNA的复制和相关蛋白质的合成等[1]。细胞经分裂期后一分为二, 整个细胞周期完成, 细胞进入下一个细胞周期或者停止分裂[1]。
细胞周期各个阶段的推进依赖各种蛋白的相互调节, 其中细胞周期依赖性蛋白激酶(cyclin-dependent kinases, CDKs)起关键作用。CDKs是一组丝氨酸/苏氨酸蛋白激酶, 和周期蛋白(Cyclin)协同作用, 是细胞周期调控中的重要因子[2]。CDKs可以和Cyclin结合形成异二聚体, 其中CDK为催化亚基, Cyclin为调节亚基, 不同的Cyclin-CDK复合物通过调节CDK的活性催化不同底物的磷酸化, 从而实现对细胞周期不同时相的推进和转化作用[3]。CDK的活性依赖于其正调节亚基Cyclin的顺序性表达和其负调节亚基CDI (cyclin dependent kinase inhibitor, CDK抑制因子)的浓度。同时, CDK的活性还受到磷酸化和去磷酸的调节[4]。CDK家族蛋白均具有一个类似的CDK结构域, 其中含有一段保守序列, 即PSTAIRE区域(Pro-Ser-Thr-Ala-Ile-Arg-Glu区域, 激酶活性区域), 该序列可与cyclin box结合以促使靶蛋白的磷酸化[5]。在结构上, CDKs包含3个重要的功能域[5], 其第1个功能域为ATP的结合部位和该酶的活性部分; 第2个功能域为Cyclin调节亚基的结合部位; 第3个功能域为磷酸盐结合位点P13 (suc1) (能抑制激酶活性, 阻止细胞进入或退出M期)的结合部位。各种CDKs在细胞周期特定的时间内被激活, 通过磷酸化底物, 驱使细胞完成细胞周期[6]。
根据基因编码蛋白的氨基酸序列及其结构不同, CDKs功能存在差异, 但其一些重要位点的功能域, 如丝氨酸/苏氨酸蛋白激酶活性位点、蛋白激酶ATP结合区域、L12螺旋、α l螺旋和T-环等结构较为保守[7]。CDKs序列的保守性说明其功能在进化上也具有高度的保守性, 这一保守性与生物细胞周期的精密调控密切关联[8]。前人研究发现, CDK基因的表达可能与植物体休眠— 生长的规律高度相关[9]。CDK与Cyclin结合形成CDK/Cyclin复合体, 通过信号传导途径控制细胞的生长、分化及死亡[10]。目前植物中已发现的CDKs有9类, 但起作用的只有CDK1~ CDK7类基因[11]。其中, CDK1可与Cyclin (A、B1、B2、B3)结合, 在G2/M交界期起作用; CDK2可与Cyclin (A、E、D1、D2、D3)结合, 主要作用时期为G1/M交界期和S期; CDK3在G1/M交界期起作用; CDK4可与Cyclin (D1、D2、D3)结合并作用于G0/M交界期或G1期; CDK5与p35及Cyclin (D1、D2、D3)形成复合物, 促进神经微丝蛋白的磷酸化; CDK6与Cyclin (D1、D2、D3)结合促进G0/G1期的转化; CDK7与CyclinH及p36结合, 主要作用是激活CDK1~CDK6[12, 13]。前人在研究粟酒裂殖酵母(Schizosaccharomyces pombe)细胞分裂周期基因cdc2和酿酒酵母(Saccharomyces cerevisiae)的cdc28基因时发现其编码蛋白分子质量约为34 kD, 此后有关该基因家族的研究日益加深, 并正式命名为CDKs[14, 15]。李海波等[16]对不同氮、磷状况下水稻CDK基因表达分析表明, 在缺磷和供氮的情况下cdc2OS-1基因被诱导表达, 从而促进细胞分裂, 加速不定根和侧根的生长。同时, 研究还发现干旱[17]、激素[18]等的胁迫会导致CDK基因表达变化, 从而调节细胞周期, 影响细胞的分裂进程。
甘蔗(Saccharumspp.)是最重要的糖料作物, 也是高生物量的能源作物, 蔗糖约占我国食糖总产的92%。我国甘蔗85%种植于盐碱地及旱地, 近年频发的干旱、寒害和日趋严重的病虫害等, 对甘蔗生产造成极大的危害, 因此挖掘甘蔗抗逆性基因乃至解析甘蔗的抗逆性分子机制是甘蔗抗逆性育种中的重要基础工作[19]。本研究从实验室前期甘蔗受花叶病毒侵染的转录组数据库(未发表)中获得一条与高粱(Sorghum bicolor) CDK基因(GenBank登录号为XP_002466536.1)序列同源性达98%的Unigene, 利用实时荧光定量PCR (qRT-PCR, RT-qPCR)技术, 对该基因在甘蔗不同组织中和各种外源胁迫下的表达特性进行分析, 以期进一步揭示该基因的功能和作用模式。研究结果有望为甘蔗CDK基因的克隆和功能验证及甘蔗响应干旱、盐等环境胁迫的分子研究积累基础资料。
从大田中随机取回健康并且长势一致的崖城05-179植株(由福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室保存), 将根部的泥土洗干净, 选取健康乳白色的幼根作为材料, 而后选取第7或者第8节蔗节, 用酒精擦净外皮, 依次进行侧芽、蔗皮、蔗肉取样, 同时进行+1叶的蔗叶和叶鞘取样, 作为基因组织特异性的分析材料。与此同时, 将从大田中取回的崖城05-179植株砍成单芽茎段, 洗净后放入水浴锅, 在100 mg L-1多菌灵(福瑞得, 中国郑州)水溶液中进行50℃温育40 min脱毒处理, 随后将这些茎段种到无菌土中(16 h光/8 h暗, 28℃)培养蔗苗, 切下蔗苗用于无菌苗的诱导、扩繁及生根。将获得的无菌组培苗放入蒸馏水中预培养10 d, 随后选取生长一致的小苗在平底试管中进行可控环境下的试验处理[20], 即100 μ mol L-1脱落酸(abscisic acid, ABA)水溶液、25.0%聚乙二醇(polyethylene glycol, PEG) 8000水溶液和250 mmol L-1氯化钠(sodium chloride, NaCl)水溶液培养处理。分别于0、6、12和24 h (PEG-8000和ABA处理)或0、12、24和48 h (NaCl处理)各取3株蔗苗作为1次生物学重复的材料, 设每个处理3组生物学重复。将以上所有样品放入液氮速冻并于-80℃冰箱中保存备用。
采用TRIzol法提取甘蔗崖城05-179叶片的总RNA, 然后利用反转录试剂盒PrimeScript 1st Strand cDNA Synthesis Kit (TaKaRa, 中国大连)合成第一链cDNA, 作为RT-PCR的模板。基于从甘蔗受花叶病毒侵染的转录组(未发表)中挖掘到的一条与高粱CDK基因(GenBank登录号为XM 002466491.1)同源性高达98%的Unigene序列, 利用Primer Premier 5.0软件设计克隆引物, 其上游引物为5'-CGACCTG ACCCGATTCGAAAG-3', 下游引物为5'-GTGCC ATCCTTCCAGTAAGT-3'。RT-PCR反应体系为25 μ L, 包含10× GC缓冲液2.5 μ L、10 mmol L-1 dNTPs 2.0 μ L、上下游引物(20 μ mol L-1)各1.0 μ L、Ex Taq酶0.125 μ L、cDNA模板1.0 μ L、ddH2O 17.375 μ L。RT-PCR程序为94℃预变性4 min; 94℃变性1 min, 48℃退火30 s, 72℃延伸2 min, 35个循环; 72℃延伸10 min。扩增产物经Gel Extracti on Kit (Tiangen, 中国北京)纯化回收, 并与pMD19-T载体连接转化到大肠杆菌DH5α 感受态细胞中, 在含氨苄青霉素(ampicillin)抗性的LB平板上筛选阳性克隆, 随机挑取单菌落进行PCR鉴定[20], 并送至生工生物工程(上海)股份有限公司测序分析。
测序获得的ScCDK基因cDNA序列经NCBI的ORF finder (http://www.ncbi.nlm.nih.gov/gorf/gorf. html)服务器, 进行开放阅读框分析。此外, 借助ProtParam pI/Mw (http://web.expasy.org/compute_ pi/)、GOR IV (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_ automat.pl?page=npsa_gor4.html)、SWISSMODEL (http://swissmodel. expasy.org/)软件预测目标序列一、二、三级结构; 再依次利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)和ProtScale (http://web.expasy.org/protscale/)软件预测ScCDK基因编码氨基酸的信号肽和疏水性/亲水性; 然后利用Profun 2.2 Server (http://www.cbs.dtu.dk/services/ ProtFun/)和Psort (http://www.psort.org/)软件预测ScCDK基因编码蛋白的功能和亚细胞定位; 最后使用Blastp工具在NCBI上查找甘蔗ScCDK同源氨基酸序列, 并运用MEGA4.0软件中的近邻相接法(neighbor-joining, NJ) (1000 BootStrap)构建同源进化树。
采用TRIzol法提取经ABA、PEG和NaCl胁迫处理的崖城05-179组培苗的总RNA, 用反转录试剂盒PrimeScript RT Reagent Kit Perfect Real Time (TaKaRa, 中国大连)合成第1链cDNA, 作为qRT- PCR模板。利用Primer Premier 5.0软件设计ScCDK定量引物, 其上游引物为5'-CTGTTAGAGAAGATG TTGAC-3, 下游引物为5'-ATGTGATGCCTCATACT T-3'。采用ABI 7500 Real-time PCR System (美国)以CAC(clathrin adaptor complex) (上游引物5'-ACAA CGTCAGGCAAAGCAAA-3', 下游引物5'-AGATCA ACTCCACCTCTGCG-3')和CUL(cullin) (上游引物5'-TGCTGAATGTGTTGAGCAGC-3', 下游引物5'-T TGTCGCGCTCCAAGTAGTC-3')作为内参基因[20, 21]。按照SYBR Green PCR Master Mix Kit (Rox) (Roche, 上海)说明书配置定量反应体系。qRT-PCR扩增程序为50℃ 2 min; 95℃ 10 min; 95℃ 15 s、60℃ 1 min, 45个循环; 增加熔解曲线。每个试验设置3次技术重复。采用2-Δ Δ CT算法[22]分析基因相对表达量, 用DPS软件分析数据显著性, 用Origin 8.0软件作图。
以甘蔗崖城05-179的叶片cDNA为模板, 采用RT-PCR技术扩增获得了约1799 bp的单一条带(图1)。该扩增产物经胶回收、连接转化、菌落PCR检测和菌液测序鉴定, 得到图2序列。使用ORF finder分析发现, ScCDK (GenBank登录号为KR258796)基因含有一个1539 bp的完整ORF (65~1603 bp), 编码512个氨基酸。
2.2.1 ScCDK基因编码氨基酸的一级结构预测
ExPASy-ProtScale软件预测显示, ScCDK编码蛋白的分子式为C2513H3881N727O731S18, 理论分子量为56.5 kD, 等电点为9.32, 负电荷残基(Asp+Glu)有48个, 正电荷残基(Arg+Lys)有62个, 不稳定系数(II)为38.12, 平均疏水性(GRAVY)为-0.775, 脂肪系数(AI)为63.09。由此推测ScCDK蛋白为一个稳定的碱性蛋白。
2.2.2 ScCDK蛋白二级结构预测 由GOR IV软件预测可知, 甘蔗ScCDK蛋白主要由无规则卷曲、α -螺旋和延伸链3种常见的蛋白质二级结构组成, 其中无规则卷曲所占的比例最高为59.57%, α -螺旋和延伸链所占比例分别为20.70%和19.73%, 该预测结果显示ScCDK蛋白缺少β -螺旋结构。
2.2.3 ScCDK蛋白疏水性/亲水性预测 ProtScale软件预测分析发现, 在ScCDK基因的编码氨基酸序列中, 少部分残基为疏水性, 且集中分布于第223~第234位氨基酸之间, 其中第231位具有最高分值, 为2.167, 疏水性最强; 大部分的氨基酸残基为亲水性, 且分值都处于较低的位置, 其中第353位具有最低分值, 为-3.856, 亲水性最强。预测该基因编码蛋白具有较强的亲水性, 为亲水性蛋白。
2.2.4 ScCDK蛋白信号肽预测和分析 SignalP 4.0 Server软件预测结果(表1)显示, ScCDK编码蛋白的第25位赖氨酸残基可能是信号肽原始剪切位点, 其最高预测分值及最高的信号肽分值分别仅为0.127和0.138, 综合分析结果表明ScCDK蛋白无信号肽。
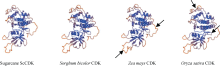
2.2.5 ScCDK蛋白三级结构预测 由蛋白预测三维结构图(图3)可以看出, ScCDK蛋白的空间结构以无规则卷曲和α -螺旋为主。比较甘蔗ScCDK与高粱(Sorghum bicolor, XM_002466491.1)、玉米(Zea mays, XM_008644544.1)和水稻(Oryza sativa, EEC72196.1) CDK蛋白的三级空间结构虚拟图, 显示ScCDK的三级空间构象与高粱高度相似, 而与玉米和水稻CDK蛋白空间结构存在一定的差异(图3)。
| 表1 甘蔗ScCDK蛋白信号肽预测 Table 1 Signal P-NN prediction for sugarcane ScCDK protein |
2.2.6 ScCDK蛋白功能预测 根据Profun 2.2 Server软件预测显示, ScCDK蛋白功能主要参与翻译, 其可能性为1.614; 其次ScCDK也可能参与了嘌呤和嘧啶类合成、脂肪酸代谢及中间代谢, 其概率依次为1.362、1.308和0.762。
2.2.7 ScCDK蛋白的亚细胞定位预测 Psort软件预测结果表明, 甘蔗ScCDK蛋白定位于细胞核的可能性最大(98.0%), 其次是微小体(45.8%), 再次是溶酶体(25.0%), 而被定位在线粒体基质上的可能性最小, 仅为10.0%。
2.2.8 ScCDK蛋白的保守结构域分析 如图4所示, ScCDK含有CDK蛋白的典型结构特征, 包括Ser/Thr蛋白激酶S-TKc结构域、活性位点等。该蛋白属于PKc-like superfamily, 具有PTZ00024多元结构域, 在第30个残基到第180个残基之间有ATP结合位点, 随后在第250个残基到第300个残基之间存在CDK/cyclin interface的结合位点, 同时还具有激酶活性必须的活化环A-loop, 这些典型结构特征都是CDK蛋白所具有的。
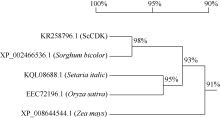
2.2.9 ScCDK蛋白的氨基酸同源性分析 应用NCBI中的BlastP程序, 对ScCDK蛋白的氨基酸序列进行同源性分析发现, 该蛋白与高粱(XP_ 002466536.1)、玉米(P_008644544.1)、谷子(KQL08688.1)和水稻(EEC72196.1)的CDK蛋白氨基酸序列相似性分别为98%、96%、96%和93% (图5)。系统进化树分析显示, ScCDK蛋白与高粱CDK蛋白(XP_002466536.1)亲缘关系较近(图6)。
 | 图5 甘蔗ScCDK蛋白与其他物种CDK蛋白的氨基酸序列比对Fig. 5 Homology analysis of sequences from sugarcane ScCDK and those from other species |
qRT-PCR分析结果如图7显示, ScCDK基因在不同甘蔗组织器官中均有表达, 其在侧芽中表达量最高, 是蔗皮中的3.91倍; 其次是在蔗肉和蔗根中的表达量, 分别为蔗皮中的2.06倍和1.97倍; 而在蔗皮中表达量最少。由此可知, ScCDK基因的表达存在组织特异性。
RT-qPCR分析结果(图8)表明, 甘蔗ScCDK基因在不同非生物胁迫下具有不同的表达特性。从总体上看, ScCDK在应答外源PEG、ABA及NaCl胁迫中均呈现被诱导上调表达的模式。在ABA处理6 h时, ScCDK的相对表达量达最大值, 为对照组的1.92倍, 随后6~24 h的表达量有所下降, 但仍高于对照水平; 在PEG处理下, ScCDK的相对表达量在6 h上调, 在12 h下降至与对照相当的水平, 随后在24 h上调达到最大值, 为对照组的1.49倍; 受NaCl胁迫后, 相比于对照, ScCDK基因表达量均上调, 且其在处理24 h后的相对表达量最高, 为对照组的1.63倍。
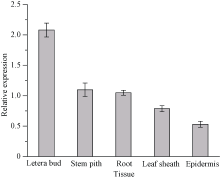 | 图7 甘蔗ScCDK基因在不同组织中的表达 误差线为每组处理的标准误差(n = 3)。Fig. 7 Relative expression of ScCDK gene in different sugarcane tissues Error bars represent the standard error of each treating group (n = 3). |
甘蔗作为一种重要的糖料和能源作物, 在国民经济中发挥着重要的作用。但是, 各种病害等生物胁迫及干旱、低温等非生物逆境条件严重危害甘蔗生产, 造成了甘蔗的产量与糖分损失[21]。近年来, 随着生物技术的迅速发展, 利用基因工程技术尤其是转基因策略对甘蔗品种进行遗传改良被证明是一种有效途径[22]。其中, 具有自主知识产权、经功能鉴定的甘蔗基因资源的挖掘是其前提和基础。
前人研究表明, CDKs属于丝氨酸/苏氨酸蛋白激酶家族, 编码该蛋白的基因较多, 属于多基因家族[23]。本研究参考实验室前期甘蔗受花叶病毒侵染的转录组数据库, 从甘蔗中成功分离获得一条ScCDK基因。生物信息学分析结果表明, ScCDK序列具有完整的开放读码框, 其编码蛋白在不同物种间的保守性较高, 与高粱、玉米、谷子和水稻的CDK蛋白同源性高达93%以上。该目标基因所编码的蛋白极可能定位于细胞核(98%概率)上。前人研究表明, CDK基因具有参与细胞分裂的特性, 其编码蛋白定位于细胞核中的几率较大[24], 这一定位结果与拟南芥(Arabidopsis thaliana)[25]、烟草(Nicotiana tabacum)[26]、茶树(Camellia sinensis)[7]等CDK蛋白的核定位分析一致, 这也与我们ScCDK的核定位预测结果相吻合。此外, ScCDK基因编码的蛋白为亲水、非分泌碱性蛋白, 在蛋白质翻译中可能发挥作用, 这一结果与吴向伟等的研究结果类似[26]。CDK作为细胞周期蛋白的调节亚单位, 其与周期蛋白结合后会表现出激酶活性。细胞周期蛋白序列上均含有一段约100个氨基酸的保守细胞周期框(cyclin box), 这个周期蛋白框能够介导Cyclin与CDK的结合, 不同的周期蛋白可以识别不同的CDK, 组成不同的复合物, 表现出不同的激酶活性[18]。本研究发现的ScCDK基因编码蛋白具有cyclin/CDK结合位点、ATP结合位点等, 属于典型的CDK家族蛋白。
CDK作为细胞周期调控系统的重要成分, 是细胞周期运行的引擎分子[2, 6]。有研究结果显示, 植物CDK基因在休眠体中少量或不表达, 在分裂旺盛的植物器官中高表达以促进细胞的快速分裂, 当达到一定的分化程度后又会表现出低表达的状态, 这时旺盛分裂结束, 细胞分裂进入稳定期或休眠期[27]。本研究对ScCDK基因的组织特异性表达分析显示, 该基因在甘蔗各组织中均有表达, 但在蔗芽中的表达量明显高于其他组织, 这可能是由于芽体细胞分裂旺盛, 细胞处于分裂期, 暗示ScCDK基因可能与蔗芽细胞的分裂生长有关。同样地, 李海波等[16]研究发现CDK基因能够特异性地调控细胞分裂, 在生长旺盛的组织中表达量较高。本研究中ScCDK基因在甘蔗侧芽、蔗肉、根、叶鞘、表皮等组织中均有表达且表达量呈递减趋势, 这可能与各组织的分裂旺盛程度相关。
细胞的周期性分裂受多种激素调节, 不同激素及同一激素不同的含量对其作用不同[28, 29, 30]。赵莉娜[17]对干旱处理后拟南芥中CDKC2基因的功能研究表明, 逆境条件下该基因表达增强, 干旱胁迫下CDKC2基因更多地参与细胞周期调控以抵御逆境造成的伤害。有趣的是, 本研究表明, ScCDK对外源PEG、ABA和NaCl的应答均呈现上调表达模式。吴向伟[31]对克隆到的烟草NtCDK8基因应对不同逆境条件下的时空表达分析时发现, 在盐诱导下, 该基因在3 h时表达量达到峰值, 约为对照组的3倍, 但随后直至48 h其表达量一直下降, 说明NtCDK8基因在NaCl胁迫下表达被抑制; 而在相同处理时间点, ABA和PEG胁迫下NtCDK8基因的表达量明显被诱导且均高于对照水平, 并在48 h达到峰值。本研究中, ScCDK基因在应对ABA、NaCl、PEG等的胁迫中在24 h或者该时间点前表达量就已达到峰值, 应答时间短, 这可能与细胞的防御机制有关。有研究报道, CDK可以通过调节各种信号途径而参与植物抵御各种生物胁迫[32, 33]。Zhu等[33]研究CDK8在拟南芥中的防御功能时发现, 其通过调节抗性基因PDF 1.2的启动子及与中介体复合亚基25互作而参与茉莉酸介导的防御反应。
通过同源克隆获得1个甘蔗ScCDK基因, 其cDNA全长1799 bp, 编码512个氨基酸, 预测为定位于细胞核上的亲水碱性蛋白。ScCDK基因表达存在组织特异性, 其表达量在蔗芽中明显高于其他组织, 该基因广泛存在于各甘蔗组织器官中, 参与细胞分裂过程, 而且受NaCl、PEG和ABA诱导上调表达, 说明ScCDK为潜在的积极响应逆境胁迫的功能基因。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|