第一作者联系方式:仲杰, E-mail:2014101003@njau.edu.cn
灰飞虱是我国水稻生产的主要害虫之一, 不仅直接取食危害水稻, 还是水稻主要病毒病的传播介体, 严重制约水稻生产。籼稻品种MR1523对灰飞虱表现较强的排趋性。为发掘抗灰飞虱新基因, 本研究利用MR1523与感虫粳稻品种苏御糯构建了一个包含200个家系的F2:3分离群体, 进行灰飞虱抗性鉴定。并利用120对均匀分布在水稻12条染色体的多态性SSR标记, 构建了全基因组连锁图谱, 进行抗灰飞虱QTL定位。结果分别在水稻第2、第5和第6染色体上检测到 Qsbph2、 Qsbph5a、 Qsbph5b和 Qsbph6 4个抗灰飞虱QTLs, 分别位于分子标记RM526-RM3763、RM17804-RM13、RM574-RM169和RM190-RM510之间, LOD值分别为2.14、3.13、3.23和2.35, 贡献率分别为12.0%、14.7%、17.4%和14.1%, 各QTL的抗性等位基因效应均来自抗虫亲本MR1523。该结果为后续抗灰飞虱基因的精细定位及通过分子标记辅助选择培育抗灰飞虱水稻新品种奠定了基础。
The small brown planthopper (SBPH), Laodelphax striatellusFallén (Homoptera:Delphacide), is one of the most destructive insect pests in rice ( Oryza sativaL.) production. SBPH not only causes direct damage by sucking plant sap but also transmits the main viral diseases, which seriously threatens the safety of rice production. An indica cultivar MR1523 displayed strong antixenosis against SBPH. In order to identify SBPH resistance genes, an F2:3population derived from a cross between MR1523 and susceptible japonica cultivar Suyunuo was constructed, and then evaluated for SBPH resistance. Moreover, 120 polymorphic SSR markers between the parents uniformly distributed on 12 chromosomes of rice were used to construct the molecular linkage map, and then conducted the QTL assay for SBPH resistance. A total of four QTLs on chromosome 2, 5, and 6, Qsbph2, Qsbph5a, Qsbph5b, and Qsbph6were detected in the interval of RM526-RM3763, RM17804-RM13, RM574-RM169, and RM190-RM510, with LOD score of 2.14, 3.13, 3.23, and 2.35, and explained the phenotypic variance of 12.0%, 14.7%, 17.4%, and 14.1%, respectively. All of the QTLs came from the resistance parent MR1523. The results in this study lay a foundation for furtherly fine mapping SBPH resistance and developing new cultivars by molecular marker assisted selection in the future.
稻飞虱属同翅目(Homoptera), 飞虱科(Delphacide), 是危害水稻生产最严重的害虫之一[1], 主要包括褐飞虱、灰飞虱和白背飞虱3种类型, 这3种害虫均以吸食水稻韧皮部汁液为生, 严重影响水稻的产量及品质[2, 3]。其中灰飞虱(Laodelphax striatellusFallé n)广泛分布于我国长江中下游及华北等地区[4]。灰飞虱危害时主要以成虫、若虫成群聚集在水稻茎、叶、穗部, 刺吸汁液, 引起植株黄叶、早枯萎缩, 甚至霉烂枯死, 或导致稻穗发黑霉变, 严重影响水稻灌浆结实, 造成空秕率上升, 千粒重下降, 稻米品质降低[5]。灰飞虱不仅直接取食危害水稻, 还是水稻主要病毒病水稻条纹叶枯病(Rice stripe virus disease)和水稻黑条矮缩病(Rice black-streaked dwarf virus disease)的传播介体, 这两类病毒病在我国南方粳稻种植区流行发生, 严重制约我国水稻生产。此外, 灰飞虱寄主广泛, 除水稻外, 还可取食小麦、大麦和玉米等绝大部分禾本科植物, 也是玉米粗缩病和小麦丛矮病的传播介体[6, 7]。
目前对灰飞虱及其传播病毒, 主要是依靠化学防治, 但由于灰飞虱具有较强的迁飞特性和爆发性, 且其传毒迅速, 导致防治效果并不理想。同时, 化学农药的过度使用, 不仅污染环境、破坏生态平衡, 还会带来农药残留, 造成灰飞虱抗药性的产生。因此, 培育抗性品种被认为是防治灰飞虱最为经济有效的措施[8, 9, 10]。然而相对其他农艺性状, 受抗性鉴定等因素的限制, 水稻抗灰飞虱研究较为滞后。此外, 依赖表型选择的传统育种方式, 培育抗虫品种, 工作量大, 具有较大的盲目性, 周期较长, 难以满足生产需求。通过分子标记辅助选择(Marker Assisted Selection, MAS)技术, 可显著提高抗虫育种的效率, 缩短育种年限。抗灰飞虱基因的发掘及其紧密连锁标记的鉴定, 是利用MAS培育抗性品种的前提与基础。为此, 前人已相继从各类水稻资源中鉴定了一批抗灰飞虱水稻资源。迄今, 已利用上述资源相继在水稻9条染色体上定位抗灰飞虱QTL约30个[11, 12, 13, 14, 15]。但目前尚未见抗灰飞虱基因精细定位和克隆的报道。
为进一步发掘与定位抗灰飞虱基因, 本研究利用筛选到的抗灰飞虱水稻品种MR1523与感虫品种苏御糯构建遗传群体, 进行灰飞虱基因的遗传分析及QTLs检测。以期为抗灰飞虱基因的精细定位和育种利用提供有用的基因资源和分子标记。
以高抗灰飞虱水稻品种MR1523为母本, 高感品种苏御糯(SYN)为父本, 构建了一个包含200个单株的F2群体, F2单株自交获得相应的F2:3家系, 用于灰飞虱抗性鉴定。
灰飞虱最初采集于南京水稻田, 饲养于苏御糯植株上, 并在南京农业大学温室内大量饲养和繁殖作为供试虫源。
灰飞虱抗性采用改进的标准苗期集团筛选法(standard seed box screening test, SSST)鉴定。主要参照SSST方法, 并针对灰飞虱食量相对较小的特性, 在反复试验的基础上, 进行了改进即在水稻幼苗1.5~2.0叶期接虫, 接虫量增加至每株15头; 以苏御糯为感虫对照品种, MR1523为抗虫对照; 接虫后, 当感虫对照幼苗死亡率达100%时, 参照IRRI制定的抗性评价标准[16], 对各个材料进行评级, 通过加权平均计算各材料的平均抗虫级别, 分别为0, 免疫; 0.1~1.9, 高抗; 2.0~3.9, 抗虫; 4.0~5.9, 中抗; 6.0~7.9, 感虫; 8.0~9.0, 高感。为确保各材料生长一致, 所有供试品种均浸种催芽。将每个材料分别播种于一个直径8.0 cm、高9.0 cm, 盛满营养土的圆形塑料钵中(钵底部有一小孔, 便于渗透吸水), 每60钵置于65 cm× 44 cm× 14 cm的塑料箱内, 随机排列, 箱内保持2 cm左右水层, 外加亲本和感虫对照各2钵。每钵播种35粒发芽种子, 接虫前3 d间苗, 淘汰病弱苗, 每钵保留30棵苗用于接虫, 每个材料两钵。自然光照, 室温25~27℃。
将催芽后的水稻种子播于5 L的玻璃烧杯内, 每个品种25株, 随机排列, 重复3次。待幼苗长至1.5~2.0叶期, 剔除弱苗, 每个品种留苗20株, 按每株5头接入2~3龄的灰飞虱若虫, 自然光照, 室温25~27° C。24 h 后开始调查每个单株上的虫数, 每天1次, 调查后保持烧杯内状态不变, 连续调查5 d。5 d 后计算每个品种上的平均虫数, 作为排趋性测验值。
将催芽后的水稻种子播于直径为6 cm, 高15 cm的无色透明塑料杯中, 每个品种5株, 重复3次, 待秧苗长至1.5~2.0叶期, 接入每杯25头1~2龄灰飞虱若虫, 纱布封口, 1 d后统计每个杯子剩余的虫数, 计算灰飞虱若虫的残存率, 作为抗生性测验值。
采用CTAB法制备DNA样品。取新鲜水稻叶片200~300 mg, 研磨成细粉; 加入600 μ L的10× CTAB, 置65° C水浴30 min; 加入700 μ L氯仿, 12 000× g, 离心5 min; 转移上清液至另一离心管中, 加入240 μ L异丙醇, 13 000× g, 离心5 min; 弃上清液, 加入400 μ L的70%乙醇, 12 000× g离心5 min; 弃70%乙醇, 风干; 加100~200 μ L TE, 溶解后4℃保存。
10 μ L反应体系包括10 mmol L-1 Tris-HCl, pH 8.3, 50 mmol L-1 KCl, 1.5 mmol L-1MgCl2, 50 μ mol L-1 dNTPs, 0.2 μ mol L-1引物, 0.5 U Taq polymerase和20 ng DNA模板。在PCR仪中进行扩增反应, 94° C 4 min; 94° C 1 min, 55° C 1 min, 72° C 1.5 min, 35个循环; 72° C 7 min。扩增产物经8%的非变性PAGE胶分离后, 银染显色。利用装有荧光灯的灯箱观察DNA条带, 将扩增产物在双亲间表现明显多态的引物用于F2群体的分析。
根据分子标记分析的结果, 将具有MR1523带型的个体赋值为1, 具有苏御糯带型的赋值为2, 具有双亲带型(杂合带)的个体赋值为3, 数据缺失的记为0。利用MapMaker 3.0软件和120对均匀分布在水稻12条染色体的多态性SSR和InDel标记, 构建全基因组连锁图谱, 检测抗灰飞虱QTL, 以LOD≥ 2.0为阈值判断QTL是否存在。
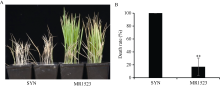
如图1所示, 在接虫后约15 d, 粳稻品种苏御糯的死苗率达100%, 籼稻品种MR1523的死苗率仅约为18%。表明MR1523和苏御糯对灰飞虱的抗性存在较大差异, MR1523高抗灰飞虱, 而苏御糯高感灰飞虱。
为进一步探明MR1523抗灰飞虱机制, 对2个亲本分别进行了排趋性和抗生性检测。排趋性实验表明, 接种灰飞虱后抗虫品种MR1523植株上的虫数明显少于感虫品种苏御糯, 且在接虫第4天之后, 两品种上灰飞虱的数目达到差异显著水平(图2-A), 表明MR1523对灰飞虱具有较强的排趋性。而在抗生性实验中, 接虫后1~5 d, 2个品种灰飞虱的存活率均没有显著差异(图2-B), 表明抗生性并不是引起两品种抗感差异的主要因素。
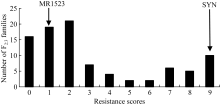
为解析MR1523抗灰飞虱的遗传基础, 利用MR1523与苏御糯构建F2分离群体, 并自交获得相应的F2:3家系, 进行灰飞虱抗性鉴定。从中筛选出92份表型鉴定重复性较好的家系(重复间误差< 10%), 用于抗灰飞虱基因的定位。92个F2:3家系的灰飞虱抗性级别从0~9级呈连续性分布, 最小为0级, 最大为9级(图3)。根据分级标准将对应F2的表型分为0~1级:纯合抗虫(RR); 2~6级:杂合型(Rr)和7~9级:纯合感虫(rr), 92个F2:3家系表型分离比为35∶ 36∶ 21, 适合性测验表明RR∶ Rr∶ rr的分离比不符合1∶ 2∶ 1 (表1), 表明MR1523对灰飞虱的抗性可能受多个基因控制。
| 表1 MR1523/苏御糯F2群体对灰飞虱的抗性分离 Table 1 Segregation of SBPH resistance in F2 population derived from the cross MR1523/SYN |
利用覆盖全基因组的500余对SSR和InDel标记进行MR1523和苏御糯的多态性筛选, 共筛选出两亲本间有多态性的分子标记140对, 选用多态性较好, 且均匀分布于12条染色体上的120对分子标记, 构建分子连锁图谱。分子图谱覆盖整个水稻基因组的1074.3 cM, 每两个标记之间的平均遗传距离约为8.95 cM, 达到了QTL检测的基本要求。
利用IciMapping进行复合区间作图分析[17], 在第2、第5和第6染色体上共检测到4个抗灰飞虱QTL, Qsbph2、Qsbph5a、Qsbph5b和Qsbph6, 分别位于标记RM526-RM3763、RM17804-RM13、RM574-RM169和RM190-RM510之间(图4), LOD值分别为2.14、3.13、3.23和2.35, 贡献率分别为12.0%、14.7%、17.4%和14.1% (表2)。各QTL的加性效应推测结果显示, 增强抗性等位基因均来自MR1523。
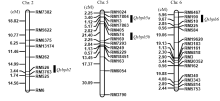 | 图4 在MR1523/苏御糯F2群体中检测到抗灰飞虱QTL在染色体上的分布Fig. 4 Chromosomal locations of QTLs for SBPH resistance detected in MR1523/Suyunuo F2 population |
| 表2 在MR1523/苏御糯F2群体中检测到的抗灰飞虱QTL Table 2 QTLs for SBPH resistance detected in MR1523/Suyunuo F2 population |
灰飞虱寄主范围广, 群体密度大, 爆发性强, 近年来在我国各地危害日益严重, 给我国农业生产造成严重损失。目前我国主栽水稻品种, 尤其是粳稻品种, 大多易感灰飞虱及其传播的病毒病, 在一定程度上加重了其危害。因此, 培育抗灰飞虱水稻品种, 对于防治灰飞虱及其传播病毒病均具有十分重要的意义。
根据已有的报道, 籼稻品种MR1523不仅高抗灰飞虱, 同时还兼抗褐飞虱、白背飞虱和稻瘿蚊等多种吸汁类害虫, 表现广谱的抗虫性, 具有较大的应用前景[18, 19, 20]。遗传分析表明, 其白背飞虱抗性受1对隐性基因wbph4控制, 但其携带的抗灰飞虱和褐飞虱基因的染色体位置尚未明确。Himabindu等[21]发现MR1523对稻瘿蚊的不同生物型均表现较强的抗性, 并利用以TN1为背景的近等基因系将其定位在第12染色体RM28574和RM28706之间约1.7 Mb的区间内, 分别相距4.4 cM和3.8 cM, 命名为GM11。本研究首次解析了MR1523抗灰飞虱的遗传基础, 分别在3条染色体上检测到4个抗灰飞虱QTL。然而并未在第12染色体GM11位点检测到抗灰飞虱QTL, 表明MR1523对不同吸汁类害虫的抗性可能分别由不同的抗性基因控制。
抗灰飞虱基因的发掘是培育抗性品种及利用品种抗性防治灰飞虱的前提和基础。此前, 研究者已相继定位了多个水稻抗灰飞虱QTL[22]。利用水稻品种Mudgo鉴定到3个抗灰飞虱QTL, 即Qsbph2b、Qsbph3d和Qsbph12, 分别定位于第2、第3和第12染色体上[11]。利用籼稻品种Kasalath检测到3个趋避性QTLs和2个抗生性QTL, 分别定位在第2、第3、第8和第11染色体上, 其中位于第11条染色体S2260和G257之间的Qsbph11为一个抗灰飞虱的主效QTL[12]。利用RathuHeenati/02428 F2和BC1F2, 在水稻第2、第4、第5和第12染色体上检测到4个抗灰飞虱QTL, 即qSBPH2b2、qSBPH4a、qSBPH5c和qSBPH12a1, 其中qSBPH12a1的LOD值为18.99, 贡献率为37.84%, 为一主效QTL[23]。2013年, Wang等[24]在籼稻品种N22中发现了5个抗灰飞虱的QTL, 即qSBPH2、qSBPH3、qSBPH5、qSBPH7和qSBPH11, 其中利用排趋性、抗生性和耐害性3种不同的表型鉴定方法, 均检测到qSBPH7。Zhang等[25]在利用Oryza officinalis, 在第3、第7和第12染色体上鉴定了3个抗灰飞虱QTL。本研究利用MR1523/苏御糯的F2群体, 在水稻3条染色体上检测到4个抗灰飞虱QTL, 即Qsbph2、Qsbph5a、Qsbph5b和Qsbph6。通过与之前定位的抗性位点比较分析, 发现Qsbph2与N22中检测到的qSBPH2和来自Rathu Heenati的qSBPH2a位置相邻; Qsbph5a与来自N22的qSBPH5位于相同染色体区间, 表明这2个QTLs可能与前人报道的位点等位。而另外2个QTL, Qsbph5b和Qsbph6, 此前未见报道, 可能为新的抗灰飞虱位点。
检测到4个灰飞虱抗性位点并鉴定其连锁分子标记, 为利用分子标记辅助选择培育抗灰飞虱水稻品种、防治灰飞虱及其传播病毒病提供了有用的基因资源, 并为进一步精细定位和克隆抗灰飞虱基因、解析水稻抗灰飞虱的分子机制奠定了基础。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|