第一作者联系方式:E-mail:hao_ling2011@163.com
丙环唑(propiconazole, 简称Pcz)作为一种杀菌剂被广泛应用于作物生产, 它同时具有调节作物生长发育的作用, 但关于丙环唑在玉米上的应用研究较少。本研究以玉米品种郑单958为材料, 研究丙环唑(Pcz)对玉米苗期植株生长、细胞形态和激素信号的影响。结果表明, Pcz处理显著抑制玉米中胚轴与胚芽鞘的生长, 降低株高, 缩短叶片和叶鞘长度, 减小叶夹角, 同时显著抑制叶片和叶鞘细胞的纵向伸长, 促使叶枕细胞排列由疏松变为紧密; Pcz处理显著降低玉米中赤霉素(GA1和GA3)的含量, 下调GA合成酶基因 GA3ox1基因的表达, 上调GA钝化酶基因 GA2ox5和 GA2ox8表达, 而GA合成酶基因 GA20ox1的表达呈现先上调后下调模式; Pcz处理显著降低油菜素内酯(BR)含量, 但BR合成基因 CPD和 DWF4的表达上调, 可能是由于反馈调节。此外, Pcz处理下调扩张蛋白基因 EXPA4、 EXPA5和木葡聚糖内糖基转移酶/水解酶基因 XTH1、 XET1的表达。综上所述, Pcz处理调节GA和BR信号转导途径, 抑制GA和BR在植株内积累, 调控扩张蛋白、木葡聚糖内糖基转移酶/水解酶基因表达, 操纵细胞生长, 有效调控株型。
Propiconazole (Pcz) has been widely used as fungistat in crop production. Meanwhile, Pcz can be used as plant growth regulator to influence plant growth. There is less study on the application of Pcz in maize. The present experiment using maize variety Zhengdan 958 was conducted to study the effect of Pcz on maize seedling growth, cell morphology and hormone signal. Pcz treatment inhibited the growth of mesocotyl and coleoptile, reduced plant height, shortened the length of sheath and leaf, and decreased leaf angle significantly. At the same time, longitudinal growth of sheath and leaf was inhibited and the shape of pulvinus cells changed from loosened rectangle type or oval type to closely spaced spindle cell. Furthermore, the GA (GA1 and GA3) content was reduced significantly and the expression of GA biosynthesis gene GA3ox1 was down-regulated, the expression of GA2ox5 and GA2ox8, genes involved in GA inactivation, was up-regulated, and the expression of GA biosynthesis gene GA20ox1 was up-regulated at the beginning and down-regulated later; the BR content was reduced significantly and the expression of BR biosynthesis genes CPD and DWF4 was up-regulated, which might be feedback regulated by endogenous BR levels. In addition, the expression of expansin genes EXPA4, EXPA5and xyloglucan endotransglucosylase/hydrolase genes XTH1 and XET1 was down-regulated. In conclusion, Pcz treatment can adjust the signal transduction of GA and BR, inhibit the accumulation of GA and BR, regulate the expression of EXPs and XTHs, control the cell growth, and adjust plant type of maize effectively.
玉米(Zea maysL.)作为我国主要的粮食作物, 对确保我国的粮食安全有着至关重要的作用。目前, 提高玉米产量主要是通过培育良种和改进栽培措施[1]。大量研究表明, 群体密度的增加有利于提高玉米产量, 然而密度增大会降低玉米抗倒伏的能力[2, 3]。化控技术是栽培措施中很重要的一项, 有利于改善株型和构建理想群体, 为玉米的高产稳产提供保障[4]。如冠菌素作为一种玉米延缓剂, 既能延缓节间伸长生长, 又能增加产量[5]; 氮肥和己· 乙水剂的配合使用, 可改善株型和群体结构, 提高春玉米的产量[6]; 乙烯利可塑造凹形冠层结构, 提高群体的光合利用率, 从而提高玉米产量[7]; 乙烯利使玉米基部节间缩短增粗, 有助于提高玉米的抗倒伏能力等[8]。
在农业上, 三唑类化合物不仅可被用作杀菌剂和除草剂, 而且可以用作植物生长调节剂, 调节植物的生长。如多效唑有利于提高油菜田块的抗倒伏与抗裂角能力, 从而提高产量[9]; 在小麦上, 多效唑提高了茎秆木质素合成相关酶的活性和木质素含量, 进而增强了茎秆抗倒伏能力[10]; 烯效唑可以缩短水稻基部节间长度, 增加节间粗度, 增强水稻抗倒伏能力[11]; 烯效唑拌种能改善茎秆质量, 提高茎秆的抗倒性, 增加产量[12]。丙环唑(propiconazole, 简称Pcz)是一种三唑类复合物, 化学名称为, 1-[2- (2, 4-二氯苯基)-4-丙基-1, 3-二氧戊环-2-甲基]-1氢-1, 2, 4三唑。在生产中, 丙环唑被广泛用作杀菌剂[13]。另外, 丙环唑可以用作植物生长调节剂, 调控植物的生长, 作用位点是钝叶醇14R-脱甲基酶[14]。但是, 关于丙环唑调节玉米生长的研究比较少。本研究对丙环唑调控玉米幼苗形态的机制做了初步的探讨, 旨在为丙环唑在玉米栽培上的合理使用提供参考。
供试玉米品种为郑单958; RNA提取试剂购买于华越洋生物科技有限公司; M-MLV反转录试剂盒购买于北京天根生化科技有限公司; 荧光定量试剂购买于宝生物工程大连有限公司TaKaRa; 丙环唑和石蜡购买于西格玛奥德里奇(上海)贸易有限公司Sigma-Aldrich。试验中所用其他试剂均为进口或国产分析纯试剂。
于恒温培养箱中进行沙培试验, 设4个Pcz浓度0、1.0、5.0和10.0 µ mol L-1, 其中0 µ mol L-1为对照, 每个处理3个重复, 完全随机排列。每个重复选饱满一致种子40粒, 用10% NaClO消毒, 在相应浓度Pcz溶液中室温浸种12 h。之后, 播于含300 mL相应浓度Pcz溶液的蛭石中, 保持相对含水量约为80%。25℃, 黑暗培养7 d, 测定幼苗中胚轴和胚芽鞘的长度。
于中国农业大学人工气候室中进行水培试验, 设置4个Pcz浓度0、0.2、1.0和5.0 µ mol L-1, 其中0 µ mol L-1为对照, 每处理4个重复。利用石英育苗至一叶一心, 挑选生长一致的幼苗移至霍格兰营养液中。2 d后, 移入含有不同浓度Pcz的霍格兰营养液中培养, 所有处理和重复完全随机排列。培养条件为光(24℃)、暗(18℃)各12 h, 室内相对湿度50%~60%, 光照强度400 µ mol m-2 s-1。3 d后取样, 观察、照相记录表型, 测定株高、根长、叶鞘长和生物量等指标。
Pcz处理3 h、12 h、24 h和72 h取样, 选取玉米第2叶鞘下部, 长度约为3 cm。将样品立即置于液氮中冷冻, 并保存于-80℃冰箱。采用华越洋生物公司的植物总RNA提取试剂盒提取玉米的总RNA, 反转录成cDNA。使用TaKaRa的Real-time PCR (SYBR)试剂盒, 荧光定量PCR仪(ABI7500)进行Real-time PCR。以ZmACTIN为内参, 测定相关基因的表达(表1)。15 µ L反应体系含2× SYBR Premix Ex Taq 7.5 µ L, 50× ROX Reference Dye II 0.3 µ L, 正向引物和反向引物(10 µ mol L-1) 各0.3 µ L, cDNA模板(40 ng µ L-1) 1.5 µ L, ddH2O 5.1 µ L。采用两步法反应程序, 95℃ 5 min; 95℃ 10 s, 60℃ 34 s, 40个循环。根据各样品特定的荧光阈值下的Ct值, 采用2-Δ Δ Ct法计算基因在不同样品中的相对表达量。
| 表1 qRT-PCR引物 Table 1 Primers used for qRT-PCR |
Pcz处理后7 d, 取第2叶的叶片、叶鞘和叶枕中部, 长度为3~4 mm, 制作石蜡切片。将上述样品立即用含70%酒精的FAA固定液固定。抽真空10~20 min, 固定24 h。用酒精梯度脱水、浸蜡包埋后, 将修整好的蜡块置于石蜡切片机切片, 轮转式切片机型号为Leica RM2235, 厚度为10 µ m。展片后经梯度二甲苯和酒精脱蜡, 用番红-固绿染色, 加拿大树胶封片, Olympus彩色CCD光学显微镜观察和照相。
Pcz处理3 d取样, 称取每份样品0.2 g, 3个重复。用3 mL样品提取液研磨和提取。离心, 取上清液, 用氮气吹干, 用酶联免疫法测定[15]。
采用 Microsoft Excel 2010和SPSS 18.0软件处理数据和统计分析。
从图1看出, 黑暗条件下, 用不同浓度的Pcz处理玉米7 d, 与对照相比, 玉米幼苗中胚轴的长度分
别减小了12%、23%和29%, 胚芽鞘的长度分别减小了22%、36%和39%。由此可知, Pcz处理显著地抑制了中胚轴和胚芽鞘的生长, 且随着Pcz浓度的增大抑制程度加强。
从图2和表2可见, 水培条件下, 用不同浓度的Pcz处理3 d, 与对照相比, 玉米幼苗的生长受到了显著的影响:地上部生物量减少, 株高降低, 叶片和叶鞘的长度变短, 叶片卷曲, 叶夹角变小。根的生长也受到了一定程度的抑制, 其中5 µ mol L-1 Pcz对根的抑制达到了显著水平。
| 表2 Pcz对玉米幼苗株高、根长和干物质积累的影响 Table 2 Effects of Pcz on plant height, root length, and dry matter accumulation of maize seedlings |
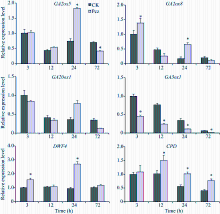
从图3可看出, Pcz处理玉米幼苗叶鞘中GA和BR含量与对照相比分别下降30%和80%, 差异达到显著水平。从图4可看出, Pcz处理下, GA合成酶基因GA20ox1和GA3ox1的表达模式不同:GA20ox1在处理24 h表达上调, 72 h表达下调; 而GA3ox1在处理过程中, 表达水平一直显著低于对照。GA钝化酶基因GA2ox5和GA2ox8在处理24 h表达上调, 加速GA的代谢, 72 h表达回调。然而, BR合成酶基因CPD和DWF4的表达与对照相比, 有上调的趋势。
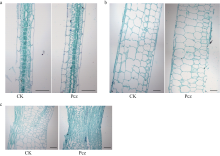
从玉米幼苗叶片的纵切面看出(图5-a), 与对照相比, Pcz处理下叶片表皮细胞纵向伸长受阻, 引起叶片长度变短; 从玉米幼苗叶鞘的纵切面看出(图5-b), 与对照相比, Pcz处理细胞轴向生长受到了抑制, 引起叶鞘变短; 从玉米幼苗叶枕的纵切面看出(图5-c), 对照叶枕细胞排列较为松散, 但Pcz处理叶枕细胞排列紧密, 且细胞显著变小, 这导致了叶夹角变小。
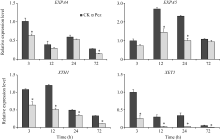
从图6可看出, 与对照相比, Pcz处理扩张蛋白基因EXPA4的表达3 h下调40%左右, 24 h表达回调; EXPA5的表达在12 h和24 h下调50%左右, 72 h表达回调。与对照相比, Pcz处理后, 木葡聚糖内糖基转移酶XTHs家族的XTH1和XET1基因的表达一直处于被抑制的状态, 特别是XET1基因下降了5倍左右。
利用丙环唑处理玉米不仅可以降低株高, 而且使叶夹角变小, 玉米株型更加紧凑(图2)。石蜡切片结果表明, 丙环唑处理抑制了叶片和叶鞘细胞的纵向伸长, 缩短了叶片和叶鞘长度, 而叶枕细胞变小且排列紧密, 引起了叶夹角变小(图5), 这与BR合成和信号途径关键基因缺失的突变体表型类似[16, 17]。定量分析发现, 丙环唑处理显著降低了玉米中BR的含量, 但BR合成的关键酶基因CPD和DWF4的表达上调(图3和图4), 这可能是由于BR合成限速酶的表达受到了反馈调节[18]。前人研究发现, 丙环唑处理抑制十字花科植物和玉米幼苗的生长, 且抑制效果可以被BR特异性恢复[19, 20]。通过本研究, 也说明丙环唑通过影响BR合成进而实现对玉米株型的调控。
细胞伸长的过程受到细胞壁松弛因子的调节, 扩张蛋白和木葡聚糖内糖基转移酶/水解酶是两大类重要的细胞壁松弛因子, 在调控细胞生长方面发挥了重要的作用[21, 22]。众多研究表明, GA诱导扩张蛋白和木葡聚糖内糖基转移酶/水解酶基因的表达活性, 调控细胞壁的延伸。如在高羊茅草中, GA调控扩张蛋白基因EXPA4、EXPA5、EXPA6、EXPA8和XTHs家族的XET1、XET3基因的表达, 促进叶片细胞的生长[23]; 在棉花中, GA调控扩张蛋白和木葡聚糖内糖基转移酶/水解酶基因的表达, 促进棉花纤维的生长[24]; 在水稻的生长发育过程中, GA调控扩张蛋白的表达使细胞壁松弛[25, 26]。本研究分析了丙环唑对玉米扩张蛋白家族基因EXPA4、EXPA5和XTHs家族基因XTH1和XET1表达的调控表明, 丙环唑处理使扩张蛋白基因的表达在短期内受到抑制, 后期表达回调; 木葡聚糖内糖基转移酶/水解酶基因一直处于被抑制的状态(图6)。另外, 丙环唑处理使GA合成酶基因GA3ox1表达下调, GA代谢基因GA2ox5和GA2ox8表达上调, 导致GA的含量显著下降。由此推测丙环唑处理下, GA含量降低, 致使扩张蛋白和木葡聚糖内糖基转移酶/水解酶基因的表达下调, 从而影响细胞的生长。
油菜素内酯(BRs)是一种甾醇类植物激素, 主要通过调节细胞的伸长和分裂, 促进植物器官的生长[27]。BR能够调控细胞壁松弛因子的表达, 促进细胞的生长。在拟南芥中, BR处理使扩张蛋白基因AtEXPA5、AtEXPA1和AtEXPA8表达上调, 促进细胞伸长[28, 29]; Bae等[30]发现在拟南芥种子萌发和产量形成的过程中, BR可以促进外源基因IbEXP1的表达; 在鹰嘴豆中, BR通过调节扩张蛋白基因CaEXPA1、CaEXPA2、CaEXPA3、CaEXPA4和木葡聚糖内糖基转移酶/水解酶基因CaXTH1的表达, 调控植物的生长[31, 32]; Keuskamp等[33]发现在拟南芥中, BR通过调控特定XTHs家族基因的表达, 影响下胚轴的生长。而在本研究中, 丙环唑处理使玉米中BR的含量显著下降。由此推测, 丙环唑处理下, BR可能通过调控细胞伸长基因的表达, 进而影响细胞生长。
丙环唑处理显著抑制玉米中胚轴和胚芽鞘的生长, 降低株高, 缩短叶片和叶鞘长度, 减小叶夹角; 同时显著抑制叶片和叶鞘细胞的纵向伸长, 使叶枕细胞的排列更加紧密。丙环唑处理可调节GA和BR信号转导途径, 抑制GA和BR在植株内积累, 调控扩张蛋白、木葡聚糖内糖基转移酶/水解酶基因表达, 操纵细胞生长, 有效调控株型。本研究发现丙环唑可作为一种植物生长调节剂, 有效地塑造玉米株型, 在生产上具有一定的应用价值。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|