第一作者联系方式:E-mail:huaizhizhang0066@163.com
郑麦103是一个高抗条锈病的小麦新品种, 为明确其携带的抗病基因, 用郑麦103与感条锈病品种农大399杂交构建分离群体, 用条锈菌CYR32、CYR33和CRY34 (V26)混合菌系进行田间接种和成株期抗性鉴定, 对214个F2:3家系的条锈病抗性进行遗传分析, 初步确定郑麦103的抗条锈性由单个主效基因控制, 定名为 YrZM103。通过BSR-Seq技术开发了6个与 YrZM103紧密连锁的分子标记, 将 YrZM103定位于染色体臂7BL分子标记 ZM215和 ZM221之间, 遗传距离分别为11.8 cM和6.9 cM。利用7BL染色体上与其他已知抗条锈病基因紧密连锁的分子标记进行比较作图, 发现 YrZM103是不同于7BL末端其他抗条锈病基因的新基因。
Zhengmai 103 is a new wheat cultivar highly resistant to stripe rust. In order to detect the stripe rust resistance gene in Zhengmai 103, a segregating population was developed by making cross between Zhengmai 103 and a highly stripe rust susceptible wheat cultivar Nongda 399. The 214 F2 derived F2:3progenies were inoculated with mixed prevailing Pst races CYR32, CYR33 and CYR34 (V26) in field condition for disease resistance evaluation at adult plant-stage. Genetic analysis revealed that the stripe rust resistance of Zhengmai 103 is controlled by a single gene, temporarily designated YrZM103. By applying RNA-seq with bulked segregant analysis (BSA), six polymorphic markers were developed to map YrZM103 on chromosome 7BL flanked by markers ZM215 and ZM221 with genetic distances of 6.9 cM and 11.8 cM, respectively. Comparative genetic mapping indicated YrZM103was located on different genetic interval from that of known stripe rust resistance genes on 7BL.
小麦条锈病是由小麦条锈菌(Puccinias triiformis f. sp. tritici)引起的叶部病害, 是中国及世界小麦产区最重要的真菌病害之一[1]。自1949年以来, 我国曾发生4次(1950、1964、1990和2002年)小麦条锈病大流行, 导致当年小麦产量损失超过100万吨[2]。小麦抗病品种在条锈病防治中发挥了极其重要的作用, 目前已经从小麦及其近缘物种中发现了70多个小麦抗条锈病基因或等位基因, 正式命名编号从Yr1至Yr78[3, 4, 5, 6]。由于条锈菌变异和新毒性菌系的产生, 特别是强毒性菌系CYR33和V26出现以后, 部分小麦品种中的抗条锈病基因丧失了抗性[7], 如人工合成小麦后代川麦42所携带的抗条锈病基因YrCH42已丧失对条锈菌系V26的抗性[8], 6VS/ 6AL易位系和贵农号品系所携带的全生育期抗性主效基因Yr24/Yr26也已开始感病[9], 对我国小麦生产造成了巨大威胁。因此, 发掘和利用新的抗条锈病基因、开发与其紧密连锁的分子标记并应用于培育新的抗病品种对条锈病的持久防治具有重要意义。
集群分离分析(BSA)结合转录组测序(RNA-Seq)是一种快速定位基因的新方法[10], 通过在分离群体中选择极端性状的个体构建两个混合池, 提取混合池RNA进行转录组测序, 根据混池个数和物种的基因组大小来设定测序层数, 最后通过经典贝叶斯算法分析转录组数据, 开发SNP标记, 预测目标基因所在的基因组区段。该方法在四倍体硬粒小麦遗传背景下找到了与高蛋白基因GPC-B1紧密连锁的SNP标记[11], 在普通小麦遗传背景下成功用于开发与抗条锈病基因Yr15紧密连锁的分子标记[12]。
郑麦103是由河南省农业科学院小麦研究所育成的新品种, 2014年在河南省审定(豫审麦2014019), 其系谱为“ 周麦13× (郑8904-7-1× 郑麦004)” 。该品种综合农艺性状好, 高抗条锈病, 但其条锈病抗性遗传基础却不甚清楚。本研究对郑麦103的抗条锈病基因进行抗病性遗传分析, 并利用RNA-Seq法进行分子标记定位, 通过与已发表的遗传连锁图谱比对, 发现郑麦103携带的抗条锈病基因是一个新基因。本研究构建的遗传图谱为精细定位和克隆该抗病基因, 以及分子标记辅助选择育种奠定了基础。
利用感条锈病品种农大399和抗条锈病品种郑麦103配制杂交组合农大399× 郑麦103, 杂种F1代自交获得F2代分离群体, F2代单株自交获得214个F2:3家系, 对亲本和F2:3代进行条锈病菌接种和单株抗性鉴定。
2014年10月, 将亲本品种和F2:3家系种植在中国农业科学院棉花研究所(河南安阳)南场试验田, 每个家系种1行, 每行50株, 每隔20行种植感病亲本农大399为诱发行, 鉴定圃周围小麦田未进行其他菌株和其他病原菌接种。
2015年3月中旬, 在诱发行上接种CYR32、CYR33和CYR34 (V26) 3个条锈病菌混合菌系, 2015年5月下旬待诱发行严重感病时进行条锈病成株期抗性鉴定, 每个家系单株的条锈病抗性反应型按6级记载[13], 鉴定级别依次是免疫(0)、过敏性坏死(0; )、高抗(1)、中抗(2)、中感(3)、高感(4), 并用“ +” 、“ – ” 表示发病程度, 根据家系单株的抗性反应型及其分离情况, 推断该家系抗病基因位点的纯合或分离特性。
根据农大399× 郑麦103的F2:3家系条锈病抗性分离特点, 分别选取20个纯合抗病和20个纯合感病F2:3家系的种子种植于穴盘中, 待幼苗长到二叶一心期时, 从每个家系取等量叶片分别构建抗、感混合池提取RNA, 用Illumina Hiseq 2000进行RNA-Seq, 之后对转录组数据进行质量控制, 比对和过滤, 最终对SNP进行变异挖掘, 寻找与抗、感显著相关的候选SNP位点, 用于标记开发, 预测目标基因所在的基因组区段。
将候选SNP标记所在的Contig序列与小麦基因组测序数据库和粗山羊草D基因组数据库比对, 寻找同源的Contigs序列, 经综合比较分析, 利用Primer3软件在线平台上(http://primer3.ut.ee/)设计特异性引物[14]。
应用改良CTAB法提取小麦叶片DNA[15]。PCR体系10 µ L, 含5 µ L 2× Taq Plus Master Mix, 20 ng µ L-1上、下游引物各1 µ L, 20 ng µ L-1基因组DNA 1 µ L和去离子水3 µ L。扩增程序为94° C变性5 min; 94° C变性30 s, 50~60° C (因引物不同而异)复性30 s, 72° C延伸30s , 35个循环; 72° C延伸10 min。扩增产物经8%非变性聚丙烯酰胺凝胶(Acr与Bis质量比为39︰1)电泳, 硝酸银染色后观察照相。
利用χ 2测验对F2:3家系的抗感分离比例进行适合性检验。利用MapMaker 3. 0软件进行分子标记与抗病基因之间的连锁分析, LOD值为3.0。利用MapDraw V2.1软件绘制遗传连锁图谱[16]。
利用条锈菌CYR32、CYR33和CYR34 (V26)混合菌系进行田间接种鉴定, 结果显示, 成株期郑麦103为免疫, 农大399为高感, 农大399× 郑麦103杂种F1代表现抗病, 表明郑麦103的条锈病抗性呈显性遗传。其后代214个F2:3家系中有68个表现纯合抗病, 75个表现抗病性分离, 71个表现纯合感病, 经卡方检验偏离1∶ 2∶ 1显性单基因遗传的分离比例(表1)。
| 表1 郑麦103条锈病成株期抗性遗传分析 Table 1 Genetic analysis of stripe rust resistance in wheat cultivar Zhengmai 103 at adult plant stage |
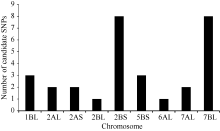
利用农大399/郑麦103的F2:3家系构建抗、感池进行BSR-Seq分析, 通过质量控制, 抗病池和感病池转录组测序数据2条双末端Read都保留下来的比例超过99%, 每个样本过滤后的数据总量在15 Gb左右。在抗感池转录组数据间找到SNP 345 524个, 高质量SNP 107 939个, 高质量SNP在各染色体上的数量和各染色体大小成正比。经过生物信息学分析, 筛选出30个可能与郑麦103中抗条锈病位点相关的候选SNP位点, 分布于小麦7条染色体上, 其中有8个SNP位于2BS染色体, 8个SNP位于7BL染色体(图1)。
依据BSR-Seq分析结果, 首先利用分布在2BS和7BL染色体上的SNP位点开发设计SNP标记, 分
别在抗、感亲本和抗、感F2:3家系中验证。发现位于2BS染色体的候选SNP位点开发出的多态性标记在抗、感亲本间均存在多态性, 但经在F2:3家系分离群体中验证, 发现这些SNP标记的多态性与条锈病抗性并不连锁。
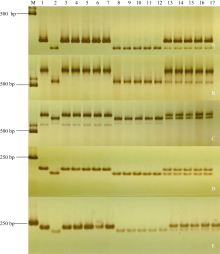
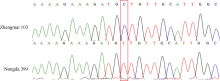
利用7BL染色体上的候选SNP位点开发标记, 发现ZM215、ZM221、ZM229、ZM639、WGGC7051和WGGC13073在抗、感亲本和F2:3家系分离群体中抗病、感病家系间存在多态性。利用这6个多态性分子标记对农大399× 郑麦103的214个F2:3家系进行基因型检测, 其中ZM215、ZM221、ZM229、WGGC7051和WGGC13073的多态性可以通过凝胶电泳检测(图2), ZM639的多态性可以通过Sanger测序来检测(图3)。据此构建了郑麦103抗条锈病基因遗传连锁图谱, 将郑麦103抗条锈病基因定位在7BL染色体上, 命名为YrZM103, 介于分子标记ZM221与ZM215之间18.7 cM的遗传区间(图4)。
小麦7BL染色体末端已定位的抗条锈病基因有Yr52[17]、YrZH84[18]和YrC591[19]。利用与这些已知基因连锁的多态性分子标记在农大399× 郑麦103分离群体上验证, 发现Xgwm577、Xbarc32、Xwmc273和Xcfa2040在郑麦103与农大399间存在多态性, 并与YrZM103连锁, 经分离群体分析, 分子标记Xgwm577等均位于YrZM103的近端粒侧(图4)。
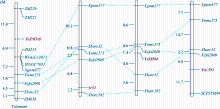 | 图4 YrZM103与Yr52、YrZH84和YrC591基因遗传连锁图谱的比较 从左至右连锁连锁图谱分别是本研究、Ren等[17]、Li等[18]和Li等[19]构建。Fig. 4 Comparative genetic linkage maps of stripe rust resistance genes YrZM103, Yr52, YrZH84 andYrC591 From left to right, the genetic linkage maps were constructed by this study, Ren et al. [17], Li et al. [18], and Li et al. [19], respectively. |
为探明郑麦103抗条锈病基因来源, 利用本研究开发的分子标记检测了郑麦103的2个亲本周麦13和郑麦004。结果显示, 从分子标记ZM229到WGGC13073的染色体区段郑麦103与周麦13相同, 为抗病类型; 郑麦103与郑麦004仅在分子标记ZM229和ZM221处相同(表2), 推测郑麦103抗条锈病基因来源于周麦13的可能性大于郑麦004。由于没有鉴定另一亲本郑8904-7-1, 因此无法准确判断郑麦103所含的抗条锈病基因是来源于周麦13还是郑8904-7-1。
| 表2 与YrZM103连锁的分子标记在郑麦103、周麦13和郑麦004上的扩增结果 Table 2 Amplification results of molecular markers linked to YrZM103 on Zhengmai 103, Zhoumai 13, and Zhengmai 004 |
利用农大399× 郑麦103的F2:3分离群体, 通过田间成株期条锈病抗性鉴定分别构建抗、感混合池进行RNA-Seq, 经过BSR-Seq分析快速确定了郑麦103中抗条锈病基因可能位于2BS和7BL染色体区段, 并筛选出多个可能与抗条锈病基因相关连的SNP位点, 用于开发分子标记。经多态性分子标记筛选和分离群体验证, 证实郑麦103的抗条锈病基因YrZM103位于7BL染色体上分子标记ZM221和ZM215之间18.7 cM的遗传区间。由于这些标记为通过RNA-Seq分析找到的SNP标记, 来源于基因的表达序列, 因此便于后续利用短柄草和水稻等基因组序列进行比较基因组分析, 开发新的分子标记, 进而加密遗传连锁图谱, 缩小目标基因定位区间。尤其是普通小麦品种中国春基因组测序完成后, 可以快速利用这些SNP标记找到YrZM103在7BL染色体上的基因组区段, 对YrZM103进行精细定位和克隆。
传统的BSA分析筛选与目标基因连锁的SSR或EST标记通常需要进行PCR扩增、凝胶电泳和大量的多态性引物筛选, 以确定目标基因可能所在的染色体(臂), 再进一步开发该染色体区段的多态性分子标记加密遗传图谱。采用BSR-Seq的策略可以快速确定目标基因可能所在的染色体(臂), 并同时提供大量的多态性SNP位点信息用于多态性标记开发和遗传图谱加密。随着测序成本的不断下降和小麦参考基因组序列的释放, BSR-Seq方法将会越来越广泛地应用于小麦目标基因定位。
此外, 在进行抗性遗传分析和基因定位时通常采用单一菌系接种, 以确保抗性基因对单一菌系的抗性反应。本文采用CYR32、CYR33和CYR34混合菌系接种, 在后代分离群体中选择抗、感极端家系进行BSR- seq分析对抗性基因定位, 结果表明方法是可取的, 因为这些抗、感极端家系(个体)对3个菌系的反应是一致的, 可以视为同一个抗性基因对不同菌系相同的作用。
目前在已正式命名和暂时命名的小麦抗条锈病基因中, Yr52、YrZH84和YrC591均位于7BL上。选取与这3个抗条锈病基因连锁的分子标记在YrZM103遗传群体上检测, 其中4个标记(Xgwm577、Xwmc273、Xcfa2040和Xbarc32)可整合到YrZM103连锁图谱上, 但均位于YrZM103的近端粒一侧(图2)。与此相反, 这4个标记却位于Yr52和YrC591连锁图谱的近着丝粒端, 而Xgwm577、Xwmc273和Xcfa2040也位于YrZH84连锁图谱的近着丝粒端, 只有Xbarc32位于该图谱的近端粒一侧(图4)。尽管分子标记之间的位置关系在不同的遗传群体和遗传背景下存在一些差异, 但通过比较这4个抗条锈病基因的遗传连锁图谱, 从共同的分子标记与这4个抗条锈病基因的位置关系推测, YrZM103可能是与Yr52、YrZH84和YrC591不同的抗条锈病基因。
郑麦103是河南省农业科学院小麦研究所通过组配复交组合周麦13× (郑8904-7-1× 郑麦004), 经过连续多年选育与鉴定育成的高抗条锈病小麦新品种, 2014年通过河南省审定。周麦13系河南省周口市农业科学院利用周8425B/周麦9号杂交育成, 中抗条锈病[20]; 郑麦004系河南省农业科学院小麦研究所育成, 亲本为豫麦13/90M434//石89-6021 (冀麦38), 高抗条锈病[21]。郑8904-7-1是育种中间材料, 高抗条锈。从郑麦103的亲本来源看, 3个亲本均具有条锈病抗性。从分子标记检测结果可以初步判断郑麦103的抗条锈病基因来源于郑麦004可能性较小, 而最可能来源于周麦13或育种中间材料郑8904-7-1, 但由于无法找到郑8904-7-1种子, 因此未能明确郑麦103中的抗条锈病基因确切来源。另外, 由于YrZM103两端的分子标记距离依然较大, 需要进一步开发更多的分子标记加密该遗传区间, 以便于该基因的精细定位和分子标记辅助选择育种。
农大399/郑麦103杂交组合F2:3家系田间成株期条锈病抗性分离比率偏离理论上的显性单基因分离比率。部分染色体区段存在偏分离的位点, 从而导致后代群体在该染色体区段的基因或性状存在偏分离。小麦7BL染色体上存在偏分离基因Sd2[22], 本研究分离群体的条锈病抗性偏分离是否与Sd2有关还有待进一步研究。同时, BSR-Seq分析结果表明, 2BS染色体和7BL染色体上均有最多的可能与抗条锈病基因相关的SNP位点。但经对2BS染色体上的8个SNP开发标记进行群体验证, 发现这些亲本间存在的SNP与田间成株期条锈病抗性没有连锁关系。这可能与本研究田间成株期鉴定所用的条锈病菌为CYR32、CYR33和V26混合菌系有关, 3个毒性不同的菌系可能对郑麦103中的抗条锈病基因具有一定的致病力差异, 导致在条锈病抗性表型鉴定和抗性级别划分上存在一定的差异, 后续的研究中将采用单一的条锈病菌系进行人工接种鉴定, 以排除不同菌系致病性差异带来的影响。也可能在2BS染色体上存在微效的条锈病抗性QTL, 对3个条锈病菌系中的个别菌系存在一定抗性, 但对另外的菌系表现一定的感病性, 在混合菌系接种情况下以及7BL条锈病抗性基因YrZM103的背景下难以表现出来, 从而影响到抗病和感病混合池的构建和与其连锁的多态性SNP标记开发。
利用BSR-Seq将小麦品种郑麦103的抗条锈病基因YrZM103定位在7BL染色体末端18.7 cM遗传区间, 比较遗传学图谱表明YrZM103是与Yr52、YrZH84和YrC591不同的抗条锈病新基因。该研究为郑麦103的推广和育种利用以及抗条锈病基因的精细定位和分子标记辅助选择育种奠定了基础。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|