第一作者联系方式:尹能文, E-mail:nwyin80@126.com
以正常生长和高温干旱复合胁迫下甘蓝型油菜中双10号的茎和根为材料, 采用组织化学、生物化学、气相色谱-质谱联用(GC-MS)分析技术, 研究了木质部结构和木质素成分的胁迫应答规律及其在茎和根中的差别。冰冻切片组织化学染色显示, 与正常生长的网室植株(正常植株)相比, 高温干旱下生长的温室植株(胁迫植株)的茎和根中木质部均显著加厚, 染色更深; 与此对应, 溴乙酰法测定的茎木质素总量比对照增加31.64%。此外, 胁迫茎中的导管孔径明显变小, 但根中的导管孔径和导管数量均明显增加。硫代酸解法测定木质素单体表明, 胁迫茎中被解离出的木质素单体总量比对照降低40.08%, 说明有更高的缩合键比例; S/G值(1.82)比对照(1.29)大大增高, 说明S型木质素比例增加而G型木质素比例下降。油菜茎与根木质化性状比较显示, 根木质素比茎木质素含有更高比例的缩合键, 茎中S型木质素占主体(S/G=1.29), 而根中G型木质素占主体(S/G=0.49)且H型木质素含量(7.43%)比茎中(0.83%)高近10倍。H型和G型木质素单体的苯环甲基化程度比S型低, 单体间更容易形成缩合键, 根中高比例H型和G型木质素单体可能是导致其具有高比例缩合键的主要原因。
Using histochemical, biochemical, and gas chromatography-mass spectrometry (GC-MS) technologies, the responsive trends of xylem structure and lignin components in the stem and the root of rapeseed ( Brassica napus) cultivar Zhongshuang 10 under heat and drought stresses were investigated as compared with normal-growth plants. Histochemical staining of the frozen sections showed that, compared with the cage-grown plants (normal plants), the plants grown in greenhouse (stressed plants) had a thicker xylem part in both stem and root, with deeper staining color. Correspondingly, the total lignin content in the stem of stressed plants tested by acetyl bromide method increased by 31.64% compared with that of the normal plants. Besides, heat and drought compound stress reduced vessel inner diameter in the stem, while increased both vessel number and vessel inner diameter in the root. Stem total lignin monomer yield prepared by thioacidolysis of stressed plants was 40.08% lower than that of the normal plants, indicating higher condensed bonds in stressed plants. Meanwhile, the S/G ratio (1.82) was significantly higher than that of the normal plants (1.29), indicating increased proportion of S units and decreased proportion of G units. Furthermore, this study also revealed the difference of lignification traits between the stem and the root. The stem had lower condensed bonds and major proportion of S units (S/G=1.29), while the root had more condensed bonds and major proportion of G units (S/G=0.49). Moreover, the H unit percentage in the root (7.43%) was almost 10 folds as that in the stem (0.83%). Since H and G units have lower methylation levels and are easier to form condensed bonds, the high proportions of H and G units might be the main reason for the high proportion of condensed bonds in root lignin structure.
木质素是地球上仅次于纤维素的第二丰富的生物高聚物, 是一类复杂的苯丙烷类高分子聚合物, 是由木质素单体之间以碳键(少数)或醚键的形式连接聚合而成, 分子量变异很大, 从几百至几百万不等[1]。木质素对植物生长发育和适应逆境都起着非常重要的作用, 它是一种多酚类聚合物(芳香族聚合物), 主要沉积在植物的次生壁中, 其含量可占细胞壁成分的30%[2]。特别是在管胞、石细胞、维管束间纤维和木质部中, 木质素在次生细胞壁中与纤维素、半纤维素、果胶等成分交联在一起发挥作用[3], 为细胞壁提供机械支撑强度和疏水性, 以防止在植物蒸腾作用时产生的负压使细胞壁塌陷[4, 5]。因此, 木质部结构和木质素成分对植物茎秆的硬度起着至关重要的作用, 使植物在重力的环境下可以生长得高大挺拔[6, 7, 8], 保障水分、矿质营养、光合产物的运输[9], 抵抗病原微生物和食草动物的侵入和损伤[10, 11]。所以, 木质素的形成和木质部的发育常被认为是陆生维管植物从水生栖息地转向陆地生态系统进化过程中的一个关键事件[7, 12]。
木质素这种异质多酚聚合物通常情况下在被子植物中可分为3种主要类型, 即对羟基苯基木质素(p-hydroxyphenyl lignin, H型木质素), 愈创木基木质素(guaiacyl lignin, G型木质素)和紫丁香基木质素(syringyl lignin, S型木质素), 它们分别是由各自对应的木质素单体构成, 即对香豆醇(p-coumaryl alcohol)构成H型木质素, 松柏醇(coniferyl alcohol)构成G型木质素, 芥子醇(sinapyl alcohol)构成S型木质素[1, 13, 14, 15], 而这3种木质素单体的主要区别就在于它们苯环的羟基化和甲基化水平不同。在被子植物中, S型木质素主要沉积在纤维细胞, 而G型木质素主要沉积在管状细胞壁中[16, 17]。Li等[18]指出S型木质素在植物中拥有较高的机械支撑属性, 然而在单子叶植株中含有高比例S型木质素不利于动物对其进行消化吸收[19, 20]。
植物中木质素的含量及其结构成分会受生物或是非生物胁迫的影响而改变[21], 木质素在增强植株机械强度和抵御高温干旱和病虫害方面起着积极的作用。在桉树中较高的S/G值有利于植株的抗旱[22]。Eynck等[23]报道了在对核盘菌抗性较高的亚麻荠(Camelina sativa)中, 其组成型木质素中的S型木质素含量比抗性较弱的植株要明显高很多, 指出S型木质素促进了亚麻荠植株组成型抗病性机制。当小麦受到低温胁迫的时候, 叶片中可溶性酚类物质有所增加并且木质素含量会有所降低, 但在根中却是相反的[24]。杜鹃花在低温胁迫下, 木质素合成相关基因C3H的表达量有明显上调[25]。在干旱胁迫下, 植株的木质素生物合成途径中一些关键基因的表达将会受到诱导显著上调, 植株木质化程度也会明显增强[26, 27, 28, 29, 30]。徐宇强等[31]发现, 耐旱性强的自交系比耐旱性弱的自交系的木质素含量升高幅度更大。
木质部结构的发育以及木质素的单体比例与植物发育生物学和环境生物学息息相关, 而且地上部与地下部由于所处环境及担负功能不同, 茎与根之间也可能在木质部结构和木质素单体比例上存在差异, 但这方面目前还缺乏比较研究。此外, 正因为木质部结构和木质素含量的改变是植物适应环境变化的重要基础, 因此揭示植物根和茎的木质部结构和木质素单体含量响应逆境胁迫的变化规律并开展比较研究, 对于植物学和作物学研究具有重要的参考和指导意义。
甘蓝型油菜(Brassica napus)是我国和世界的重要优质植物食用油的来源, 还是动物饲料和生物柴油的重要原料, 但生产上广泛因高温干旱胁迫而影响产量和品质[32]。本研究以甘蓝型油菜常规品种中双10号为材料, 分别种植于网室(正常植株)和温室(高温干旱胁迫植株), 分别对茎和根的木质部进行解剖学观察与比较及组织化学和生物化学比较研究, 探索了高温干旱胁迫下油菜的木质化应答, 并揭示了油菜茎与根在木质化上的差异。
甘蓝型油菜常规品种中双10号(ZS10)原始种子由中国农业科学院油料作物研究所张学昆研究员惠赠。为尽量提高试验结果的准确性, 将非胁迫植株种植在温室临近的田间网室, 接近自然条件, 整个生长期间没有显著的高温和干旱胁迫。将胁迫植株种植在玻璃温室, 在油菜植株进入抽薹期至收获期期间, 也就是在植株木质素合成与积累的旺盛期, 玻璃温室内温度在阴雨天比田间网室平均高2~5℃, 在强日照时平均比田间网室高5~10℃ (最高达38℃), 可以很好模拟高温干旱胁迫环境。当胁迫植株叶片出现萎蔫迹象时适当浇水(土壤含水量长时间保持在15%以下)。
取成熟期植株的中部茎秆和根, 用于冰冻切片组织化学染色观察和木质素总体含量极其单体成分的分析。本研究创立了针对油菜各组织器官的切片方法。
1.2.1 样品包埋 首先打开Leica CM1850冰冻切片机, 将机箱温度降到-20℃, 切取适合大小的新鲜茎秆和根的样品包埋, 在包埋样品时避免样品周围形成气泡。
1.2.2 回温处理 将机箱温度回升到-8 ~ -12℃保持30 min以上, 切片时的机箱温度可根据切片效果再次具体优化。
1.2.3 切片 按照切片机使用说明书切片。将切好的样片用预冷的毛笔或毛刷刷到盛水的培养皿里(最好事先在冰面预冷), 然后将培养皿放在冰面暂时保存。
1.2.4 切片组织化学染色 采用Phloroglucinol- HCl和Mä ule染色法[16, 33]。Phloroglucinol HCl染色顺序为, 滴加适量1%间苯三酚溶液在切片上处理3~5 min→ 滴加适量浓HCl显色→ 盖上盖玻片吸掉多余的染液。Mä ule染色:在切片上滴加适量的1%高锰酸钾溶液, 浸染5 min→ 用蒸馏水清洗3次→ 滴加3% HCl浸泡2 min→ 用蒸馏水清洗3~5次→ 滴加29%氨水浸2 min→ 盖上盖玻片吸掉多余的染液。Mä ule染色可使G型木质素染为棕色, 使S型木质素染为红色[7, 16, 19]。
1.2.5 显微观察 将染色的样片或者没有经染色处理的样片放在Nikon SMZ1500和Olympus MUX10体视显微镜以及Nikon Eclipse E600显微镜下, 根据仪器使用说明书观察。
所有提取试验过程都在通风橱内完成, 依据前人研究报道的方法[34, 35, 36, 37, 38, 39, 40, 41], 并适当调整和优化处理。
1.3.1 细胞壁分离 将待测材料烘干打粉, 过80目筛; 称取60~70 mg样品装入带螺旋盖的2 mL离心管中进行细胞壁分离[34], 完成后加入无水乙醇脱水。
1.3.2 总木质素含量测定 采用溴乙酰法[35, 36, 37]并有改进, 测定总木质素含量。称取上一步所得的细胞壁成分1.5~2 mg, 加入200 µ L新鲜配制的25%溴乙酰溶液(用冰醋酸配制), 50℃条件下反应3 h, 期间每15 min振荡混匀一次。反应结束后冰浴至室温, 加2 mol L-1氢氧化钠溶液800 µ L和新鲜配制的0.5 mol L-1盐酸羟胺溶液140 µ L, 振荡混匀。将混合液转至15 mL具塞刻度试管中, 加冰醋酸稀释至15 mL, 混匀, 测定280 nm波长下的吸光度值。根据公式%ABSL= 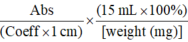
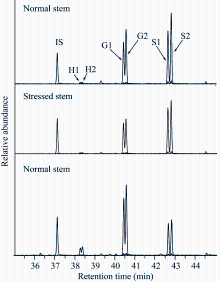
1.3.3 木质素单体测定 采用硫代酸解法[34, 38, 39, 40, 41]并有改进, 测定木质素单体成分。称取第(1)步中得到的细胞壁成分5 mg, 加入带螺旋盖(带有聚四氟乙烯材质内垫)的5 mL刻度试管中。加新鲜配制好的裂解液1 mL (2.5%BF3和10%EtSH)。向试管中填充氮气, 100℃加热反应4 h, 每1 h振荡一次。待反应完成后冰浴冷却5 min。加0.4 mol L-1 NaHCO3溶液300 µ L, 调pH值到3~4。加蒸馏水2 mL、1 mg µ L-1的用乙酸乙酯配制的二十四烷内标溶液100 µ L和乙酸乙酯900 µ L, 充分涡旋振荡30 s, 静置10 min使溶液分层。吸取300 µ L上层有机相到2 mL的离心管中。氮气吹干, 加200 µ L丙酮溶解, 继续用氮气吹干, 重复操作一次。最后加入500 µ L乙酸乙酯溶解, 用孔径为0.22 µ m的尼龙膜过滤。
上机前样品衍生化处理:取100 µ L上述得到的提取液到内插管内, 加入20 µ L吡啶, 100 µ L N, O-双(三甲基硅基)乙酰胺进行TMS衍生化, 25℃条件下反应2 h后采用Agilent 7000C三重四极杆GC-MS。上机条件:气象色谱柱采用Agilent HP-5 MS column (30.00 mm × 0.25 mm × 0.25 μ m); 进样量1 µ L, 分流模式; 进样口和检测器温度设为250℃; 载气为高纯氦气, 载气流速1.1 mL min-1; 柱初始温度130℃下保留3 min, 然后以3℃ min-1升温到250℃并且保留5 min, 再回到初始温度130℃, 其中溶剂延迟时长为30 min。
最后根据内标二十四烷进行各木质素单体的定量分析。H、G和S型分别对应的特征质荷比为239、269和299 m z-1, 二十四烷对应的特征质荷比为57 m z-1。
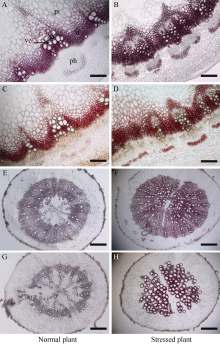
通过对比分析发现, 胁迫植株的茎和根中木质化组织被Phloroglucinol-HCl染色法[42]和Mä ule染色法染出的颜色都比正常植株更深, 表明高温干旱胁迫导致全株木质素积累量明显增高(图1)。
对比经Mä ule染色法染色的茎秆切片(图1-C, 图1-D), 很容易看出胁迫植株的维管束间纤维被染出的红色更深, 表明其S型木质素含量更高。从形态学看, 胁迫植株的木质部比正常植株更厚(图1), 茎杆中导管的孔径明显变小(图1-A, 图1-D), 但是胁迫植株的根中导管的孔径却比正常植株明显大很多(图1-E和图1-F), 尤其是在纤维细胞所占比例较小的类型中(图1-G, 图1-H), 我们将油菜植株的根分为2个主要类型, 一种是纤维细胞所占比例较大的, 另一种是纤维细胞所占比例较小的, 另外其导管数量也明显增加。以上表明, 长期高温干旱胁迫下茎和根的木质化程度会大大提高。
2.2.1 木质素总体含量分析 根中木质素的含量比茎中显著高很多(图2), 根中木质素的百分含量(15.56%)比茎(12.29%)平均高3.27个百分点, 这主要是因为根部木质化组织所占体积比例比茎中高, 茎中存在大量髓部。胁迫茎的木质素含量(16.18%)比正常植株茎中(12.29%)显著高, 平均高3.89个百分点(图2)。这与前面的组织化学染色观察分析结果一致。进一步证明长期高温干旱胁迫下的油菜植株更加倾向于合成较多木质素, 以增加抗逆性。
2.2.2 木质素单体成分分析 不同环境下生长的植株茎秆中木质素单体构成之间存在显著差异(表1)。就被解离出的木质素单体总量(H + G + S)而言, 虽然胁迫茎的木质素含量比正常茎高31.64%, 但是胁迫茎被解离出的木质素单体总量却比正常茎降低了40.08%, 这也说明胁迫茎木质素的结构中含有更高比例的缩合键。另外胁迫茎中S型木质素所占比例比正常植株茎有显著增高, 胁迫茎的S/G值(1.82)比正常植株茎(1.29)高出41.09%。表明长期高温干旱胁迫下植株倾向积累更高比例的S型木质素。
油菜植株的茎秆和根的木质素单体成分构成之间也存在巨大差异(表1和图3)。虽然正常植株的根中测得的木质素含量比茎中高26.60%, 但对于木质素单体总量而言根却比茎低62.71% (表1), 这一结果表明根中木质素的结构含有更高比例的缩合键。H型木质素在双子叶被子植物中普遍很低, 一般所占单体总量的比例都低于1%或1%左右。经过测定显示, 油菜植株根中的H型单体所占比例基本都高于5%, 接近于茎的10倍(表1和图3)。另外, 根中G型木质素所含比例(62.28%)比茎中(43.35%)明显高很多, 根的S/G值(0.49)比茎中(1.29)也就低很多, 表明油菜茎中是S型木质素占主体, 而根中却是G型木质素占主体(表1和图3)。
| 表1 木质素单体含量 Table 1 Lignin monomer content (%) |
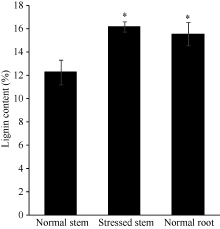 | 图2 成熟期植株茎和根的总木质素含量 * 表示在0.01水平差异显著。Fig. 2 Total lignin content of mature plant stem and root * Significantly different at the 0.01 probability level. |
对比分析发现, 胁迫植株的茎和根的切片被染出的颜色比正常生长下更深, 显示茎和根的木质化程度要高很多, 木质部也更厚, 木质素含量更高, 说明高温干旱下会促进木质素合成和细胞壁增厚, 减少水分散失, 并抵抗其他各种逆境[23, 43]。
从形态学对比分析表明, 胁迫茎中木质部面积占比更大, 导管孔径更小, 但其根中的导管孔径更大, 且导管数量更多, 推测其原因是高温干旱下根部适应于吸取更多水分而其维管系统变得更发达, 地上部则适应减少水分散失其导管孔径就变小, 胞壁木质化程度就提高。总而言之, 油菜植株在抵御长期高温干旱逆境时, 其维管系统生长发育从不同器官组织的多个方面发生针对性的适应性改变。
硫代酸解法测定木质素单体, 主要是使木质素单体之间稳定性较差的β -O-4化学键断裂, 从而解离出对应的木质素单体, 它并不能解离内部含有抗性键(resistant inter-unit bonds)或被称为缩合键(condensed bonds)类型的木质素[38, 44]。虽然胁迫茎所含木质素含量比正常茎高出很多, 但是胁迫茎被硫代酸解出来的木质素单体总量却下降了不少, 胁迫茎被解离出的H、G和S的总量比正常茎降低了40.08%, 这也说明在高温干旱下植株所合成的木质素结构中含有更高比例的缩合键, 造成被解离出的木质素单体含量较少。另外胁迫茎的S/G的比值比正常茎也高41.09%, 可能是因为长期高温干旱胁迫下植株在增强木质素合成以及提高木质素单体间缩合键的同时, 也合成了较高比例的S型木质素, 从而增强植株茎秆的机械强度和致密度, 进而增强抗旱和耐高温的能力。目前关于高温干旱对植株木质素结构的影响还很少有报道。Moura-Sobczak等[22]对桉树干旱胁迫处理发现, 桉树中S/G值明显升高, 并指出不管是S型木质素含量的升高还是G型木质素含量的下降都在桉树适应干旱环境中起到重要的作用。
对比正常植株的茎和根之间解离出的木质素单体总量, 发现虽然根中的木质素含量比茎要高, 但是其被解离出的木质素单体总量却低很多, 说明根比茎含有更高比例的缩合键。其原因很可能是由于根木质素组成中含有更高比例的H和G型木质素单体, 因为H型和G型木质素单体的苯环甲基化程度比S型更低, 所以它们之间的连接就更容易形成缩合键[1]。Ruel等[45]指出缩合型木质素主要含G型木质素, 而非缩合型木质素主要含S型木质素。
在根中, S型木质素单体都比G型含量明显低很多, 并且H型木质素含量所占比例也比茎高, 茎中H含量所占比例为0.83%, 而根中则达到7.43%。根木质素结构中这种高比例H型和G型木质素有可能是因为其硬度或刚性不必像茎秆那么强, 而韧性或可弯曲性则应该更强, 便于其在地下弯曲生长, 高比例的H型和G型木质素就很有可能是有助于根这种本身特性的形成。
从系统性讲, 本研究理应对高温干旱胁迫处理后根木质素的变化也进行GC-MS测定, 但却没有测定, 这是由于从组织切片已看出根中发生了与茎中类似的变化趋势。现在看来这是本研究的一个不足, 有待于以后的研究来完善, 不排除根中木质素的成分比例和结构变化与茎中存在不同的特点。
高温干旱胁迫可以显著增强油菜植株木质素总量的合成, 增加木质部厚度, 且不同木质素单体的比例和木质素单体间的缩合方式也会发生变化, 高温干旱促进了油菜茎中S型木质素的积累。油菜茎与根的导管形态响应长期高温干旱的变化显著不同, 茎中导管孔径变小, 而根的导管孔径变大且导管数量变多。油菜植株的茎与根在木质素结构的差异非常显著, 与茎相比, 根木质素中含有更高比例的缩合键, H和G型木质素比例也高得多。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|