第一作者联系方式: E-mail: 929722415@qq.com, Tel: 020-85211378
通过酵母双杂交系统, 以花生组蛋白去乙酰化酶AhHDA1为诱饵, 对花生cDNA文库筛选并分析互作蛋白的生物学特性。结果获得一个AhHDA1互作蛋白 Arachis hypogaeaL . Golden 2-like (AhGLK); 体外荧光双分子试验证实, AhHDA1与AhGLK蛋白存在相互作用; 利用生物信息学软件分析表明, AhGLK含有MYB保守域, 其氨基酸序列与大豆( Glyine soja) GsGLK、拟南芥( Arabidopsis thaliana) AtGLK分别具有较高同源性; AhGLK定位在细胞核中并具有转录因子活性, 主要在花生的叶片中表达; 在30% PEG条件下, AhGLK表达下调。
With AhHDA1 as bait, the peanut ( Arachis hypogaeaL .) cDNA library were screened and the characteristics of the interacting-protein was analysed. The yeast two-hybrid experiment indicated that Arachis hypogaea Golden 2-like (AhGLK) interacts with AhHDA1, and interaction between AhHDA1 and AhGLK was further confirmed by bimolecular fluorescence complementation (BiFC) assay. There has a MYB conserved domain in AhGLK, and the domain shows high homology with GsGLK ( Glyine soja) and AtGLK ( Arabidopsis thaliana) though bioinformatics software analysis. AhGLK was found located in nucleus and was testified as a transcriptional activation factor. Tissue specific analysis showed that AhGLK accumulated in leaves mainly, and the expression level was down-regulated under 30% PEG treatment. Above all, the results lay the foundation for further study on AhGLK, which might be involved in drought stress resistance of peanut.
干旱严重影响着花生的产量和质量, 花生在长期的进化过程中, 体内逐渐形成一系列复杂的逆境应答机制, 以抵御逆境胁迫对植物的损害[1]。因此, 研究花生的逆境响应机制, 对于提高其产量有着重要意义。
组蛋白乙酰化在植物表观调控中起着重要的作用。根据底物特异性, 组蛋白去乙酰化酶分为RPD3/HDA1-like HDAs、SIR2-like HDAs和HD2三类蛋白[2, 3, 4]。目前报道拟南芥存在HDA2等12个转录因子成员[5]。其中, AtHDA6参与茉莉酸介导的植物防卫反应, 也参与转基因沉默和rRNA基因转录的调控[6, 7]。AtHDA19在应对病原体期间参与茉莉酸和乙烯信号, 并在种子萌发过程中与AtHDA6一起抑制胚的发育[8]。在不同生长发育阶段, AtHDA7和AtHDA18的上调和下调都会延缓拟南芥的生长发育[9, 10]。AtHDA9在种子萌发过程中是个负调控因子[11]。HDAs在植物抗逆及在植物生长发育过程中发挥着重要作用。在植物中, 对组蛋白乙酰化的研究主要集中在乙酰化对H3和H4的修饰上, 这些修饰参与细胞发育、开花、转座子压制和非生物胁迫应答[12]。在前期研究中我们分析花生转录组数据库时发现, 在干旱处理和外施ABA下, 有一个与拟南芥HDA6同源的基因表达上调[13], 进一步克隆该基因并命名为AhHDA1 (Arachis hypogaeahistone deacetylase 1), 推测AhHDA1参与了花生渗透胁迫和ABA响应抗逆基因的表观遗传调控[14]。在研究AhHDA1功能时需要了解其互作蛋白及作用。
本文以AhHDA1为诱饵筛选花生cDNA文库, 获得AhHDA1互作蛋白, 分析候选蛋白的结构特征和表达特性及可能的生物学功能, 以便为研究其在逆境响应中的功能和机制奠定基础。
供试花生品种为粤油7号, 由广东省农业科学院作物科学研究所梁炫强研究员赠送, 试验所需E. coli DH5α 、亚细胞定位载体pCAMBIA1301-eGFP由实验室保存。AH109酵母菌株、酵母互作验证载体pGADT7和pGBKT7、BiFC载体Psat1-nEYFP和Psat1-cEYFP由中国科学研究院华南植物园侯兴亮研究员赠送, DNA分子质量Marker购自天根生化公司, 其他化学试剂为国产分析纯。
前期实验室用30% PEG处理花生5 h后, 分别取处理前后的花生根茎叶部的组织, 提取RNA后, 用于制备cDNA文库。采用Clontech公司的Matchmaker GAL4 Two-Hybrid Systems试剂盒进行酵母双杂交试验。将诱饵载体pGBKT7-AhHDA1与花生文库cDNA质粒共转化酵母AH109感受态, 将转化产物涂于SD/-Trp/-Leu/-His选择性平板。挑取阳性的酵母单克隆进行菌落PCR, 选取阳性PCR产物送至立菲生物技术公司测序, 并对结果进行Blast比对分析, 拟定候选互作蛋白。
将互作蛋白AhGLK的ORF全长序列插入pGADT7载体, 构建pGADT7-AhGLK载体。与诱饵载体pGBKT7-AhHDA1共转化到酵母AH109感受态中, 取转化产物3 μ L点于SD/-Trp/-Leu和SD/-Trp/-Leu/-His、SD/-Trp/-Leu/-His/-Ade培养基上, 30℃培养3~5 d, 观察酵母生长情况。
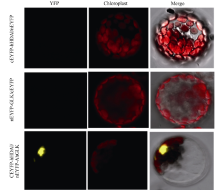
采用PEG-Ca2+介导法转化拟南芥原生质体, 配制5~10 mL酶解液[1.5% (w/v)纤维素酶, 0.75% (w/v)离析酶, 0.5 mol L-1甘露醇, 10 mmol L-1MES pH 5.7, 55℃水浴10 min, 10 mmol L-1CaCl2, 0.1% BSA]提取拟南芥原生质体, 加入MMG (4 mmol L-1 MES, 0.4 mol L-1甘露醇, 15 mmol L-1 MgCl2)悬浮, 使至原生质体的终浓度约为2× 105个 mL-1。从中吸出100 µ L原生质体, 向其加入互作质粒10 µ g Psat1-nEYFP- AhGLK和10 µ g Psat1-cEYFP-AhHDA1, 10 µ g Psat1-nEYFP-AhGLK和10 µ g Psat1-cEYFP及10 µ g Psat1-cEYFP- AhHDA1和10 µ g Psat1-nEYFP作为对照, 混匀后加入110 µ L PEG-CaCl2 [100 mmol L-1 CaCl2溶液, 0.2 mol L-1甘露醇, 40% (w/v) PEG-4000, 现用现配]进行转化, 将离心管横放于培养皿中, 放在相对湿度为70%、温度为20℃的培养箱中, 用W5 (154 mmol L-1 NaCl, 125 mmol L-1CaCl2, 5 mmol L-1 KCl, 5 mmol L-1葡萄糖, 0.03% (w/v) MES, 用KOH调pH至5.8)避光孵育16~18 h, 后在激光共聚焦显微镜(Zeiss LSM700)下观察。
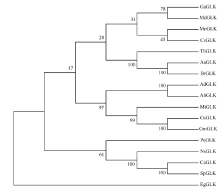
1.4.1 候选蛋白的生物信息学分析 根据候选蛋白AhGLK的氨基酸序列, 利用NCBI-proteinblast (http://blast.ncbi.nlm.nih.gov/)在线分析软件BlastP对AhGLK的氨基酸序列进行同源性搜索, 并进行蛋白家族预测; 利用DNAMAN分析AhGLK保守结构, 用ClustalX 2.1软件分析AhGLK氨基酸序列相似性, 利用MEGA4构建同源蛋白系统进化树。
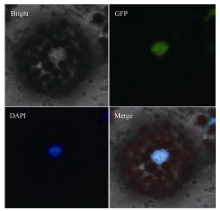
1.4.2 AhGLK亚细胞定位及转录活性分析 选取生长3~4周未抽薹的野生型拟南芥幼苗叶片, 按以上方法提取原生质体, 再分别提取含AhGLK- eGFP融合蛋白载体的质粒, 转化原生质体13~24 h后制成临时装片, 于激光共聚焦显微镜Leica LSM Image Browser 3.2 program (Leica Corporation, Germany)下, 滴加100 ng mL-1的细胞核染料DAPI后观察。
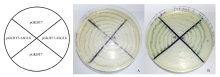
根据已克隆的AhGLK基因测序结果, 构建pGBKT7-AhGLK载体, 转化E. coliDH5α 感受态并筛选阳性重组质粒, PCR及酶切验证。挑取AH109酵母菌株单菌落, 加入YPDA培养液, 30℃过夜培养, 至OD600> 1.2。取菌液100 µ L分装到离心管中, 分别加入10 µ L的sperm DNA和1 µ g酵母融合表达载体pGBKT7-AhGLK, 转化并涂板(缺陷培养基SD/-Trp), 30℃培养2~3 d, 挑取阳性克隆, 转移到组氨酸缺陷培养基(SD/-His/3-AT/X-α -Galplus)上培养, 观察生长情况。
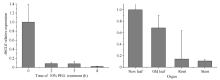
1.4.3 AhGLK表达特征分析 取正常四叶期幼苗, 用去离子水清洗根部, 吸水纸吸干残余水分, 室温下30% (w/v) PEG逆境胁迫处理, 分析AhGLK在逆境下的诱导表达趋势。按照不同的时间段(0、2、5、8 h)取样, 使用TRIzol法提取各种处理下幼苗叶片的总RNA, 利用RNA反转录合成试剂盒(天根, 北京)合成cDNA, 以合成的cDNA为模板。利用实时荧光定量PCR仪检测目的基因AhGLK表达模式。反应体系为10 µ L, 扩增程序为95℃ 30 s; 95℃ 34 s; 65℃ 5 s, 40个循环; 以花生Actin11作为内参, 每个反应3次重复。按照基因相对表达分析2-Δ Δ CT方法分析AhGLK的相对表达量及其标准差。
将pGBKT7-AhHDA1和pGADT7-AhGLK以及对照组pGBKT7-53+pGADT7-T、pGBKT7-lam+ pGADT7-T分别转化到AH109酵母感受态细胞后, 转化产物均可在二缺的对照平板(SD/-Trp/-Leu)上生长, 而在三缺平板上SD/-Trp/-Leu/-His和四缺平板上(SD/-Trp/-Leu/-His/-Ade)只有共转化pGBKT7-AhHDA1和pGADT7-AhGLK以及阳性对照可正常生长, 除pGBKT7-AhGLK与pGADT7组合外其余对照均不能生长, 初步证实AhHDA1和AhGLK蛋白在酵母中可以相互作用(图1)。其中, pGBKT7-AhGLK与pGADT7组合也能在氨基酸缺陷培养基上生长, 推测AhGLK可能存在自激活现象。进一步以Psat1-nEYFP-AhGLK和Psat1-cEYFP- AhHDA1为试验组; 以Psat1-nEYFP-AhGLK/cEYFP和Psat1-cEYFP-AhHDA1/nEYFP为空白对照组, 用PEG-CaCl2进行3组质粒的拟南芥原生质体的瞬时转化, 质粒转化到野生型拟南芥原生质体内18 h后, 通过激光共聚焦显微镜观察到Psat1-nEYFP-AhGLK和Psat1-cEYFP-AhHDA1试验组出现荧光(图2), 而阴性对照组Psat1-nEYFP-AhGLK/cEYFP和Psat1-cEYFP- AhHDA1/nEYFP则没有YFP荧光。结果表明, AhHDA1和AhGLK蛋白在细胞内表达并互作。
AhGLK编码404个氨基酸, 序列比对显示, AhGLK分别与野生大豆(GsGLK)、苜蓿(MtGLK)、棉花(GrGLK)、杨树(PeGLK)、烟草(NsGLK)、拟南芥(AtGLK)的氨基酸序列具有很高的相似性。利用NCBI在线软件预测发现, AhGLK在150~210氨基酸附近具有MYB结构域, 存在SH[AL]QKY[RF]保守序列(图3)。进化分析表明, AhGLK与野花生的GLK具有很高的同源性(图4), 仅存在个别碱基差异。并且与野生大豆和苜蓿GLK蛋白也存在较高同源性, 而与木本植物苹果、杨树等的同源性较远。
在激光扫描共聚焦荧光显微镜下观察, 发现转染了35S::AhGLK-eGFP的拟南芥原生质体产生绿色荧光。经细胞核酸染料DAPI染色后发现以上荧光的位置与DAPI 染色区域重合, 表明AhGLK蛋白定位于细胞核中(图5)。
含pGBKT7-AhGLK融合表达载体的酵母AH109能在色氨酸缺陷培养基(SD/-Trp)(图6-A)和组氨酸缺陷培养基(SD/-His/3-AT/X-α -Gal plus)(图6-B)上生长, 并且能使X-α -Gal显蓝色(图6-B)。说明AhGLK具有转录因子活性, 它表达的目的蛋白能促使载体下游的His和LacZ表达。
AhHDA1是影响花生响应干旱的组蛋白去乙酰化酶, 组蛋白去乙酰化修饰是表观遗传调控的重要方式之一[15], 通过筛选AhHDA1的互作蛋白以及研究2个蛋白的互作机制, 对认识AhHDA1蛋白的功能具有重要的意义。本研究筛选出AhHDA1互作候选蛋白AhGLK, 通过酵母双杂交(图1)和BiFC试验(图2)证明AhHDA1和AhGLK存在互作关系, 并进一步发现AhGLK是一种定位于细胞核的转录因子(图5和图6)。
本研究发现, AhHDA1互作候选蛋白与大豆、拟南芥等物种中的GLK蛋白存在同源关系(图3)。植物在干旱胁迫下, 体内ABA含量增加, 促进气孔关闭, 降低光合速率, 生长被抑制, 已知至少有469个基因参与干旱与光合作用的调控[15]。GLK(Golden2- like)基因家族是植物所特有的一个转录因子家族, 拟南芥具有39个成员[16], 目前几个蛋白功能被阐明, 涉及调节植物的不同代谢或发育过程。过表达GLK的拟南芥植物中, 根的伸长被抑制但是根部的光合作用却被加强[17]。Wang等[18]指出单子叶植物GLK多以单个基因的形式存在, 而双子叶植物多以成对基因的形式存在。GLK转录因子以成对基因的形式在叶绿体的正常发育过程中起作用。SlGLK1和SlGLK2调控西红柿中质体数量和叶绿素的合成, 其中, SlGLK1主要在叶片中发挥作用, SlGLK2主要在果实中发挥作用[19]。拟南芥中叶绿体发育受一对基因AtGLK1和AtGLK2的调控, GLK属于转录因子GARP超家族成员。插入突变体表明, 单突变体在大多数光合组织中显示正常的表型, 反映了GLK基因功能冗余。然而, 双突变体的光合组织是淡绿色的, 类囊体堆叠减少, 且在其叶绿体中几个捕光基因表达水平降低[20]。Murmu等[21]发现过表达GLK拟南芥植株能增强病原菌的耐受性。Rauf等[22]也指出在拟南芥中ORE1 (ANAC092)与GLK存在相互作用, ORE1拮抗GLK的转录活性, 从而加速叶片的衰老进程。植物在响应干旱过程中, 组蛋白乙酰化程度增加, 同时去酰化的基因表达也上调[23], 表明植物在响应干旱过程中既通过乙酰化修饰上调干旱应答基因抵抗干旱, 同时通过去乙酰化修饰抑制部分生长相关基因, 调控生长, 增强植物的抗逆性。AhGLK含MYB保守结构域(图3)。Sarah等[24]研究发现, 低温处理诱导AtMYB73、AtMYB44和AtMYB77表达, 且AtMYB73表达持续长时间上调, 因此推测AtMYB73在拟南芥抵抗低温胁迫过程中发挥作用。同时也有研究发现, AtMYB73在拟南芥脱水过程中的表达水平变化不明显, 复水后显著诱导表达[25], 说明AtMYB73参与调控拟南芥响应干旱胁迫过程。AhGLK属于MYB家族, 在PEG胁迫下, AhGLK表达持续下调(图7), 推测AhHDA1可能通过与AhGLK互作影响叶绿素的合成进而参与植物的抗逆反应。后续将进一步研究AhGLK蛋白的功能及AhGLK蛋白参与的抗旱调控的机制。
筛选获得AhHDA1的互作蛋白AhGLK, 其氨基酸序列与已知的拟南芥AtGLK氨基酸同源性很高, 含有保守MYB结构域; AhHDA1与AhGLK存在互作; AhGLK被定位于细胞核中, 具有转录活性, 其基因主要在叶片中表达, 在PEG胁迫条件下表达下调。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|