第一作者联系方式: E-mail: glcyhj@126.com, Tel: 13888243154
以马铃薯品种合作88为材料, 利用数字基因表达谱(DGE)技术, 对-2℃低温胁迫处理后的马铃薯叶片cDNA文库进行差异基因表达谱分析。结果表明, 有28 505个基因受低温胁迫诱导差异表达, 其中上调表达基因13 703个, 下调表达基因14 802个。GO功能显著性富集分析表明, DEGs主要涉及信号生物代谢过程、氧化还原过程、能量代谢、次生代谢过程以及催化活性。KEGG富集分析表明, 上调表达基因主要富集于苯丙烷、光合作用天线蛋白、类胡萝卜素的生物合成、苯丙氨酸代谢及淀粉与蔗糖代谢途径, 而下调表达基因主要富集于植物激素信号转导途径。利用实时荧光定量PCR (qRT-PCR)验证4个DEGs在低温胁迫条件下的差异表达, 其结果与DGE分析结果基本一致, 证实了DGE测序结果的可靠性。
A variety Cooperation 88 was used to construct cDNA library of potato leaf treated with -2℃ low temperature stress by digital gene expression profiling (DGE) technology, and detect the differentially expressed genes (DEGs). The results of solexa sequencing showed that a total of 28 505 DEGs were screened out, 13 703 DEGs of which were up-regulated and 14 802 DEGs were down-regulated. GO enrichment analysis showed that these DEGs were involved in single-organism metabolic process, oxidation-reduction process, metabolisms of carbohydrate, secondary metabolism and catalytic activity. The KEGG enrichment analysis showed that up-regulated genes were significantly associated with phenylpropanoid, photosynthesis-antenna proteins, carotenoid biosynthesis, phenylalanine metabolism, starch and sucrose metabolism pathways, while the down-regulated DEGs mainly enriched in plant hormone signal transduction pathway. The differential expressions of four genes were confirmed by Real-time quantitative PCR, showing that the expression changes of these four genes were generally consistent with the results of DGE.
低温是影响植物生长发育和地理分布的重要因素之一, 在一定程度上也会影响农作物的生长和产量[1]。马铃薯是世界性的粮食和蔬菜兼用作物, 马铃薯普通栽培种(Solanum tuberosum L.)虽喜冷凉, 但不耐低温霜冻, 马铃薯幼苗在-0.5~0.8℃时受冷害, -2℃时受冻害; 而成株在-4℃时会整株死亡[2]。低温胁迫会影响马铃薯生长和地理分布, 霜冻会对马铃薯植株的生长造成巨大危害, 严重时会导致减产或绝收, 给马铃薯生产造成重大损失[3, 4]。中国马铃薯主要种植区几乎都会受到低温危害, 苗期易遭受倒春寒, 成熟期会遭受寒潮或早霜。因此, 对低温迫下马铃薯转录组整体水平上的研究, 对于揭示其耐寒机理, 进而改良其抗逆性状, 以减少寒害带来的损失具有重要意义。
近年来, 马铃薯抗寒机制的研究主要集中在生理学和基因表达变化方面, 在响应低温胁迫的转录组学方面研究较少。Van等[5]研究发现, 低温胁迫下, 抗寒性越强的马铃薯品种, 植株内脯氨酸含量越高。Chen等[6]研究发现, 低温驯化后马铃薯叶片中可溶性蛋白水平较高, 且可溶性蛋白含量的增加与抗寒性正相关。James等[7]将合成的抗冻蛋白基因PHA-AFP转入马铃薯, 在-2℃条件下, 非转基因的马铃薯植株遭到严重冻害, 而转基因马铃薯植株耐冻性增强。Pino等[8, 9]以35S及rd29A为启动子, 将拟南芥CBF(AtCBF1-3)基因转入马铃薯栽培品种, 发现AtCBFI和AtCBF3的表达能够增强其抗寒性; 同时, AtCBF1基因的特异性表达能够增强马铃薯抗冻(COR)蛋白的表达。为提高马铃薯植株对环境胁迫的耐受性, Li等[10]将Cu/Zn超氧化歧化酶和抗坏血酸过氧化物酶基因, 通过根癌农杆菌转入马铃薯植株, 在氧化胁迫下这2个基因都表达, 转化植株耐受性得到提高。近年来, 随着新一代测序平台的快速发展, 转录组测序(RNA-Seq)技术逐渐被应用到植物抗逆性研究中。RNA-Seq利用大规模测序技术直接对cDNA序列测序, 产生数以千万计的reads数量, 使得一段特殊的基因组区域的转录水平可以直接通过比对到该基因组区域的reads数来衡量。而基于RNA-Seq的数字基因表达谱(DGE)是指通过构建处于某一特定状态下的细胞或组织的非偏性cDNA文库, 大规模cDNA测序, 通过定性和定量分析其mRNA群体组成, 从而描绘该特定细胞或组织在特定状态下的基因表达种类和丰度信息。相比而言, DGE无偏性, 更为敏感和准确, 且成本较低, 更适用于比较基因的表达研究[11]。目前, 对转录组水平在逆境胁迫的研究主要集中在拟南芥、玉米、水稻、大豆、甘蓝、花生等植物[12, 13, 14, 15], 而马铃薯抗寒性上的研究较少。
以DGE技术研究马铃薯在低温胁迫下的基因表达差异, 分析马铃薯在低温胁迫下的分子调控机制, 揭示马铃薯适应低温胁迫的分子机制的报道尚少。本研究利用基于RNA-Seq的DGE技术, 构建马铃薯苗期正常生长和人工模拟低温处理的叶片转录组文库, 拟通过高通量测序, 鉴定马铃薯叶片低温胁迫应答基因, 并分别对差异表达基因(DEGs)进行GO和KEGG注释和富集分析, 从转录组水平揭示马铃薯适应低温胁迫环境的分子机制, 为进一步筛选马铃薯抗寒相关基因, 提高马铃薯抗寒性状奠定基础。本研究初步建立了马铃薯幼苗叶片低温胁迫应答基因的动态表达谱; GO和KEGG代谢途径分析明确了差异表达基因富集的分子功能与代谢途径, 从而更完整地揭示了马铃薯低温胁迫应答基因的表达情况。
以马铃薯品种合作88为试验材料, 选取统一发芽, 大小一致的健康种薯, 播种于12 cm× 12 cm的营养钵内(栽培基质为1︰1的泥炭土和蛭石), 每钵1株, 种植于温室, 进行常规管理。将出苗后4周(苗期)的马铃薯材料分为A、B两组, A组材料保持正常生长(CK), 将B组材料
转移到人工植物气候箱中进行低温胁迫处理。处理温度为-2℃分别处理1、3和6 h后取A、B组各3株成熟一致的功能叶片(倒3~4叶), 于液氮中快速冷冻, 贮存于-80℃超低温冰箱中, 用于叶片总RNA的提取。每个处理重复3次。
采用植物总RNA提取试剂盒(天根生化科技有限公司, 北京)提取叶片总RNA, 再用DNase I (宝生物工程有限公司, 大连)去除总RNA中的基因组DNA, 然后将RNA样品送至北京诺禾致源生物信息科技有限公司用1%琼脂糖进行凝胶电泳, 分析RNA降解程度以及是否有污; 采用Nanodrop检测RNA的纯度(OD260/280值); 采用Qubit 和Agilent 2100对RNA浓度精确定量, 同时检测RNA的完整性。
样品检测合格后, 用带有Oligo(dT)的磁珠富集真核生物mRNA。随后加入fragmentation buffer将mRNA打断成短片段, 以mRNA为模板, 用六碱基随机引物(random hexamers)合成一链cDNA, 然后加入缓冲液、dNTPs和DNA聚合酶 I和RNA聚合酶H合成二链cDNA, 再用AMPure XP beads纯化双链cDNA。对纯化的双链cDNA先进行末端修复、加A尾并连接测序接头, 再用AMPure XP beads选择片段大小。最后进行PCR扩增, 并用AMPure XP beads纯化PCR产物, 得到最终的文库。文库构建完成后, 先使用Qubit 2.0初步定量, 稀释文库至1.5 ng μ L, 再使用Agilent 2100检测文库的insert size, 符合预期insert size后, 使用qPCR方法准确定量文库的有效浓度(文库有效浓度> 2 nmol L-1), 以保证文库质量。库检合格后, 把不同文库按照有效浓度及目标下机数据量的需求pooling后进行Illumina HiSeq测序。
测序得到的原始序列为Raw reads, 为了保证信息分析质量, 必须将含有带接头的、低质量的Raw reads过滤掉, 得到Clean reads, 后续分析都基于Clean reads。获得Clean reads后, 采用Trinity对Clean reads进行拼接以获取后续分析的参考序列。采用RSEM软件将每个样品的Clean reads往参考序列上做mapping进行比对。对比对结果进行统计, 进一步得到每个样品比对到每个基因上的readcount数目, 并对其进行FPKM (每百万fragments中来自某一基因每千碱基长度的fragments数目)转换, 进而分析基因的表达水平。采用DESeq对readcount数据进行基因差异表达分析, 筛选阐值为padj< 0.05。
GO (Gene Ontology)功能显著性富集分析是把所有差异表达基因向Gene Ontology数据库(http://www.geneontology. org/)的各个term映射, 计算每个term的基因数目, 然后找出与整个基因组背景相比, 在差异表达基因中显著富集。KEGG (Kyoto Encyclopedia of Genes and Genomes)是有关Pathway的主要公共数据库。Pathway显著性富集分析以KEGG Pathway为单位, 应用超几何检验, 找出差异基因相对于所有有注释的基因显著富集的Pathway。对于GO和KEGG统计检验均采用Benjamini Hochberg方法进行多重比对检验。
为验证RNA-Seq结果的可靠性, 以qRT-PCR检测DGE鉴定出的上调和下调表达基因各2个。根据DEGs序列设计引物(表1), 内参基因为EF1α [16]。采用PrimeScript RT Reagent Kit (宝生物工程有限公司, 大连), 以1 μ g总RNA反转录成cDNA第一链。利用SYBR Premix Ex Taq进行实时荧光定量PCR。PCR程序为95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 40个循环。用Rotor-Gene软件分析CT值, 采用2-Δ Δ CT计算差异表达水平。每个样品重复3次。
| 表1 用于qRT-PCR表达验证的基因及其引物 Table 1 qRT-PCR primers for the selected genes |
低温胁迫和对照组所有样本(12个)测序得到的原始测序序列(Raw Reads)介于25 165 952~30 630 448条之间(表2)。12个样本的Clean reads分别介于24 036 486~ 29 252 350条之间, Clean reads的比例介于94.63%~96.23% 之间。12份样品中Clean reads的比例均占Raw reads的94.0%以上。12个样本的Phred数值大于20(Q20)和30(Q30)的碱基占总体碱基的百分比分别介于96.97%~97.56%和92.98%~94.32%之间, 碱基G和C的数量总和占总碱基数量的百分比介于42.66%~44.67%之间。综合以上几个测序reads质量评价指标, 说明这12份样品的测序质量较高, 均能满足后续DEGs筛选及数据分析的要求。
| 表2 测序reads质量 Table 2 Quality assessment of reads |
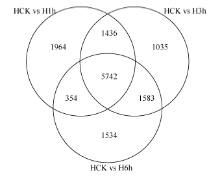
由图1可知, 不同胁迫时间下基因的表达水平不同, 低温胁迫1 h, 4463个基因上调表达, 5033个基因下调表达; 低温胁迫3 h, 4708个基因上调表达, 5088个基因下调表达; 低温胁迫6 h, 4532个基因上调表达, 4681个基因下调表达。在3个时间点中, 低温胁迫3 h时差异表达的基因数量最多; 低温胁迫1、3和6 h时, 下调表达基因的数量均显著多于上调表达基因的数量。不同胁迫时间下, 各基因表达的差异倍数高度不均一, 差异水平变化主要集中在2倍~5倍, 差异倍数大于5倍的基因数量较少。由图2可看出, 低温胁迫1 h和3 h相比较, 有1436个基因共同表达; 低温胁迫3 h和6 h相比, 有1583个基因共同表达; 有5742个基因在3个时间点表现为共同表达, 共同诱导或抑制表达的基因数较多, 表明马铃薯叶片响应低温胁迫是一个复杂的多基因调控过程。
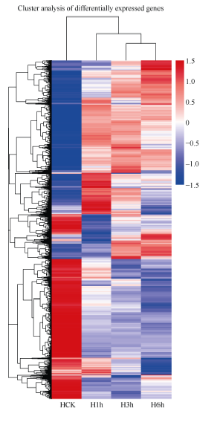
由图3可知, 同一基因在不同低温胁迫时间下的表达量存在很大的变化, 可将差异基因的表达趋势划分为3大类, 第1类在低温胁迫下总体趋势下调表达, 随着胁迫处理时间的延长, 其下调表达程度增大, 且胁迫处理1 h内其抑制效应明显; 第2类基因在低温胁迫下总体趋势上调表达, 随着胁迫处理时间的延长, 其上调表达程度增大, 胁迫6 h, 诱导效应明显; 第3类基因低温胁迫水平变化趋势基本一致, 表现单一的上调表达或下调表达。
通过表达模式聚类表达谱分析表明, 马铃薯叶片在低温胁迫6 h, 上调和下调表达基因类型均多于1 h和3 h, 且上调表达的基因类型增加趋势明显。随着低温胁迫时间的延长, 叶片中差异表达基因数目不断增加, 且诱导效应增加较显著, 说明胁迫程度增大, 马铃薯叶片主要通过诱导基因表达来响应低温。还有很多在1 h上调而在3 h和6 h下调的基因, 说明其在低温胁迫初期受到调控, 在初期起到一定作用。通过表达模式聚类可以明显看到3个低温处理时间点表达模式聚类种类繁多, 说明马铃薯抗寒机制是一个非常复杂的过程。
GO (gene ontology)是基因本体联合会(gene onotology consortium)所建立的数据库, 用于描述基因产物的功能。GO分类与富集分析, 首先是将所有差异表达基因(DEGs)向GO数据库的各个条目(term)映射, 计算每个term的基因数目, 然后找出与整个基因组背景相比, 在差异表达基因中的显著富集。本研究对所有DEGs进行了GO功能富集分析(图4)。低温胁迫马铃薯叶片3个时间点差异表达基因广泛涉及GO功能分类体系中参与的生物过程(biological process, BP)、细胞组分(cellular component, CC)以及分子功能(molecular function, MF) 3个大类别中的29个小类别。
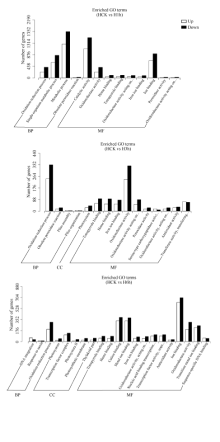 | 图4 低温胁迫后马铃薯叶片中差异表达基因GO分类Fig. 4 Gene ontology classification of the DEGs under low temperature stress |
由图4可以看出, 低温胁迫1 h, 马铃薯叶片中的DEGs主要涉及13个GO分类条目, 其中与生物过程相关的4个, 主要是氧化还原过程(上调基因222个, 下调基因403个)、信号生物代谢过程(上调基因584个, 下调基因854个)和代谢过程(上调基因1278个, 下调基因1748个); 与分子功能相关的9个, 主要包括催化活性(上调基因1096个, 下调基因1521个)、氧化还原酶活性(上调基因223个, 下调基因398个)和离子结合(上调基因656个, 下调基因914个)。
低温胁迫3 h, 马铃薯叶片中的DEGs主要涉及15个GO分类条目, 其中与生物过程相关的4个, 主要是氧化还原过程(上调基因245个, 下调基因352个); 与细胞组分相关的只有光合系统(上调基因26个, 下调基因41个); 与分子功能相关的10个, 主要包括氧化还原酶活性(上调基因242个, 下调基因344个)、铁离子结合(上调基因54个, 下调基因85个)、抗氧化活性(上调基因27个, 下调基因32个)和转移酶活性(上调基因72个, 下调基因68个)。
低温胁迫6 h, 马铃薯叶片中的DEGs主要涉及21个GO分类条目, 其中与生物过程相关的有3个, 包括最主要的氧化还原过程(上调基因199个, 下调基因311个); 与细胞组分相关的5个, 主要涉及转录因子复合物(上调基因108个, 下调基因136个)和类囊体部分(上调基因26个, 下调基因56个); 与分子功能相关的有13个, 主要包括离子结合(上调基因627个, 下调基因701个)、阳离子结合(上调基因333个, 下调基因387个)、金属离子结合(上调基因332个, 下调基因380个)、氧化还原酶活性(上调基因195个, 下调基因311个)和过渡金属离子结合(上调基因224个, 下调基因255个)。
从最显著富集的前6个GO分类词条可以看出, 低温胁迫后马铃薯叶片中差异表达基因主要与氧化还原过程、代谢过程、催化活性、氧化还原酶活性、抗氧化活性以及离子结合相关, 且下调表达的基因数目均多于上调表达。其中与与代谢过程、氧化还原过程和抗氧化活性相关的GO term富集的基因数量较多, 这些基因在蛋白激酶信号转导通路具有重要功能, 参与植物的生物与非生物胁迫应激防御反应, 它们的上调和下调表达对马铃薯适应低温胁迫环境均具有十分重要的作用。
通过KEGG (kyoto encyclopedia of genes and genomes)数据库中的Pathway富集分析来确定DEGs参与的主要生化代谢途径和信号转导途径(表3)。结果显示, 低温胁迫下马铃薯叶片中差异表达的基因分布在130条Pathway中, 表3所示为富集最显著的前10条Pathway, 其中最主要的途径是参与信号转导和生化代谢。
| 表3 差异表达基因富集的前10个KEGG Pathways Table 3 Ten most enriched KEGG pathways of DEGs |
低温胁迫1 h, 排在前5位的Pathway有光合作用天线蛋白、角质素, 软木脂和蜡质生物合成、植物激素信号转导、类胡萝卜素生物合成和苯丙烷生物合成, 其中植物激素信号转导途径上差异表达的基因数目最多, 为94个。低温胁迫3 h, 排在前5位的Pathway包括植物激素信号转导、光合作用天线蛋白、光合作用苯丙烷生物合成以及角质素, 软木脂和蜡质生物合成, 其中植物激素信号转导途径上差异表达的基因数目最多, 为109个。低温胁迫6 h, 排在前5位的Pathway为光合作用天线蛋白、光合作用、植物激素信号转导、苯丙烷生物合成和植物-病原菌互作, 其中植物激素信号转导途径上差异表达的基因数目最多, 为87个。由上述分析可得, 不同时间低温胁迫下, 差异表达基因变化数目最多的均为植物激素信号转导途径, 差异表达基因显著富集的Pathway是光合作用天线蛋白。
此外与苯丙氨酸代谢、光合作用、脂肪酸代谢、玉米素生物合成、不饱和脂肪酸生物合成以及淀粉和糖代谢相关的差异表达基因Pathway数量也较多, 这些代谢途径所得的次生代谢产物能减轻或消除因低温等逆境引起的活性氧伤害。由此也说明马铃薯响应低温胁迫是一个非常复杂的生理生化过程, 受多基因、多途径、多种代谢产物的影响。
与GO富集分析结果一致, 差异表达基因显著富集的KEGG代谢途径也主要为植物激素信号转导和次生代谢产物的合成。类胡萝卜素和苯丙烷等是植物体内重要的抗氧化物质, 同时类胡萝卜素代谢作为ABA合成的上游途径, 对提高植物的抗逆性具有重要作用, 证实了KEGG代谢通路与GO富集分析结果的一致性。
随机选取4个差异表达基因进行qRT-PCR验证。其中unigene c94382_g1和unigene c88575_g1为上调表达基因, unigene c100966_g3和unigene c88382_g3为下调表达基因。图5-A、B和C分别为低温胁迫1、3和6 h马铃薯叶片中差异表达基因的qRT-PCR验证结果。采用EF1α 作为内参基因, 计算4个目的基因的相对表达量, 并与DGE测序分析的结果比较。DGE测序结果分析中发现的低温胁迫样本中表达量上调的2个基因unigene c94382_g1和unigene c88575_g1, 在胁迫后叶片中相对表达量均较对照上升; 而在DGE测序的低温胁迫样本中表达量下调的2个基因unigene c100966_g3和unigene c88382_g3, 在胁迫后叶片中相对表达量均低于对照, 呈现显著的下调表达。4个DEGs在DGE测序中的诱导表达变化趋势和qRT-PCR中表达量变化结果相一致, 这表明DGE测序的结果的可靠性。虽然2种分析方法检测出的4个差异基因的表达量变化趋势相同, 但两者在具体的表达量上调或下调倍数上存在一定差异, 这可能与2种检测方法的检测范围和灵敏度有一定关系。
植物在长期进化过程中形成了一套复杂的低温应答机制, 从分子、细胞、生理和生化水平作出适应性调整, 以抵御和适应低温胁迫。通过信号传导, 在低温胁迫过程中植物体内会产生一系列应答基因表达产物, 以减少低温胁迫的伤害和增加耐寒性[17, 18]。转录组学(transcriptomics)是一门在整体水平上研究细胞中所有基因转录及转录调控规律的学科, 即从RNA水平上研究基因转录表达的情况, 能更好地反映细胞的动态过程[19]。数字基因表达谱(digital gene expression profiling, DGE)是一种以新一代高通量测序为基础, 对酶切产生的标签直接测序, 并以数字化的信号反映基因表达水平的测序技术, 能够对某一特定组织、在特定状态下所有表达的mRNA进行序列分析, 且不同处理条件下测序结果的可靠性和稳定性高, 能够满足表达谱分析的需要[19, 20]。尽管许多胁迫响应机制是广泛存在的, 但耐寒植物常常会有一些自身特异的响应方式, 在转录水平上研究植物耐寒性基因表达谱差异, 有助于理解植物抗寒的结构和功能基础[15]。
植物在低温胁迫下会产生一个调节系统, 有大量基因参与到胁迫下的信号传递和下游的胁迫反应过程中, 本研究共鉴定到28 505个基因参与马铃薯低温胁迫反应, 上调表达基因有13 703个, 下调表达基因有14 802个; 其中5742个基因在低温胁迫的3个时间点表现共同表达, 此外大量的基因都表现胁迫前后基因表达量的差异, 可见基因表达量的差异可能是马铃薯幼苗对低温胁迫应激反应的主要应对机制, 这与杨伟等[21]在低温胁迫枇杷幼果转录组中的研究结果一致。本研究中与植物激素信号转导以及抗氧化系统代谢相关的差异表达基因较多, 表明马铃薯对低温胁迫的保护性响应是多种代谢途径和信号通路共同作用的结果。Chen等[22]在野生马铃薯耐冻性研究中发现, 外源ABA能够提高其耐冻性, 且ABA主要起到信号转导的作用, 本研究中植物激素信号转导相关基因的显著富集, 也证明了植物激素在低温胁迫下的调控作用。Gene Ontology功能富集分析结果提示, 与低温相关的显著性富集有抗氧化应激反应、氧化还原过程、光合作用中的光反应过程、应激反应等, 说明马铃薯在低温胁迫下可能出现相关酶的催化活性减弱, 如蛋白合成、淀粉和糖类合成等相关的酶类, 这些都与植物的抗寒作用相关。
KEGG pathway富集分析显示, 与苯丙氨酸代谢、光合作用、类胡萝卜素合成、玉米素的合成以及淀粉和糖代谢相关的差异表达基因Pathway数量较多, 这些代谢途径所得的次生代谢产物能减轻或消除因低温等逆境引起的活性氧伤害。结合差异基因表达模式聚类分析, 可以看出初级代谢过程中大部分基因表达下调, 表明低温胁迫对马铃薯的代谢过程有影响并使其代谢过程降低。类胡萝卜素与光合作用有关, 光合作用中的大部分基因表达下调, 表明低温胁迫对光合作用系统的损害, 是通过光合作用强度下降体现的。植物激素与生长和调节有关, 本研究中可能与参与调节各生物过程在低温胁迫下的表达, 这些均与前人研究结果一致[22, 23]。
马铃薯在冷胁迫和盐胁迫下, 均有大量光合作用相关基因下调表达[24], 且在同等光合有效辐射下净光合速率随环境温度的下降而降低, 这与光合过程中的一系列酶促反应受温度影响有关[25]。本研究结果表明, 不同时间低温胁迫下, 光合作用及光合作用-天线蛋白富集的差异基因数目均较多, 表明逆境对马铃薯的光合作用过程产生了较大影响, 诱导了许多与光合作用相关基因的表达[26, 27]。本研究中不同时间低温胁迫下, 信号传导代谢途径中富集的差异基因较多, 其中植物激素信号传导所占比例最大, 低温应答途径可能产生许多ABA依赖性信号通路。有研究表明在不同逆境条件下, 都会诱导ABA积累, 以调节植物代谢平衡, 在植物抵御低温胁迫中起到重要作用[28]。此外, 高温和干旱胁迫也会引起许多植物激素信号转导相关基因的表达, 植物体会通过信号转导调控相关基因表达, 进而诱导代谢相关基因表达, 增强其抗逆性[29]。
本研究还发现苯丙烷类物质的合成和代谢途径, 在低温胁迫下均被显著富集。苯丙烷类物质合成会直接或间接生成类黄酮等含苯丙烷骨架的物质, 在植物组织器官中, 类黄酮作为非酶抗氧化系统的重要成员, 是最有效的自由基清除剂和脂质过氧化抑制剂, 类黄酮化合物的积累是植物应答逆境胁迫的一个重要特性[30], 在干旱、高温等胁迫下均发挥了重要作用[15, 31]。苯丙氨酸代谢途径是植物次生代谢最重要的途径之一, 主要包括苯丙烷代谢途径和类黄酮合成代谢途径, 而苯丙氨酸解氨酶是苯丙烷类代谢途径的关键酶, 催化苯丙氨酸转化为肉桂酸, 促进黄酮等次生代谢物的生成, 能够应答逆境、病原菌等多种胁迫[32, 33]。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|