第一作者联系方式: E-mai: huyibocaas@163.com, Tel: 010-62131376
藜麦( Chenopodium quinoa Willd.)是美洲大陆最古老的作物之一, 为全世界公认的全营养谷物。为了解国内不同藜麦种质资源营养性状的相关性和差异性, 本研究测定国内25份藜麦种质资源的13个品质性状指标, 并对其进行相关性分析、主成分分析和聚类分析。结果表明, 脂肪与总黄酮呈极显著正相关(0.55), 而与赖氨酸和组氨酸呈极显著负相关(-0.52和-0.54); 总多酚、总黄酮和总皂苷之间均具有极显著相关性。13个品质性状分别隶属于5个主成分, 累计贡献率为92.6%。25份种质材料可以聚类为4组, 在品质和遗传距离方面各组群之间差异较大。利用主成分分析和聚类分析对藜麦品质进行综合评价, 可避免单一指标的片面性和不稳定性, 为藜麦的利用和品质育种提供重要的科学依据。
Quinoa ( Chenopodium quinoa Willd.) is one of the oldest crops in the American continent. It has been recognized as a nutritious grain all over the world. In this experiment, thirteen indicators of quality in 25 quinoa germplasms were analyzed using principal component analysis (PCA) and cluster analysis. The fat had significantly positive correlation with total flavonoids (0.55), and remarkably negative correlation with lysine and histidine (-0.52 and -0.54); and the correlation among total flavonoids, polyphenols and saponins was positively significant. Thirteen traits belonged in five principal components, with a total contribution rate of 92.6%. Twenty-five quinoa germplasms were divided into four categories through cluster analysis, and there were larger different in genetic distance and quality between categories. It is an effective way to comprehensively evaluate the quinoa quality by PCA and cluster analysis, which could not only avoid the bias and the instability of single factor analysis, but also provide an important scientific basis for quinoa application and quality breeding.
藜麦(Chenopodium quinoa Willd.)是苋科藜属一年生双子叶植物, 原产于南美洲安第斯山脉, 至今已有5000多年的栽培历史, 为印加土著居民的传统食物。藜麦具有耐旱、耐盐和抗霜冻的特性, 能在贫瘠的土壤中种植[1]。其蛋白质含量为12%~23%, 远高于玉米、水稻、大麦等作物, 油脂含量为2%~10%, 并富含不饱和脂肪酸和大量矿质元素, 如铁、锌、锰和钙等, 其中钙和铁的含量明显高于大多数谷物[2, 3]。藜麦中氨基酸含量丰富而且组成均衡, 特别是8种人体必需氨基酸的比例比普通谷物高, 尤其是赖氨酸和组氨酸[4]。另外, 藜麦籽粒中对人体有益的次生代谢物质也非常丰富, 如酚类物质和皂苷。酚类物质作为非常好的抗氧化物质还具有抗炎、抗病毒、抗癌和心血管保护特性[5, 6]。藜麦皂苷具有抗真菌、增强免疫、抗炎症等多种生理活性[7, 8]。因此藜麦被联合国粮农组织推荐为适宜人类食用的“ 全营养食品” 。
藜麦营养成分除受环境控制之外, 还受遗传多样性的影响[9]。近年来, 关于藜麦营养性状多样性和相关性的研究表明, 产量、蛋白质和氨基酸组成具有很显著的相关性。Miranda等[10]发现智利不同气候类型地区种植的藜麦, 其产量和种子组成明显不同。
目前国内外关于藜麦品种间营养性状相关性和差异性的报道较少。因此, 本研究将收集的25份藜麦种质资源在相同环境下种植, 收获成熟籽粒并测定其营养组成, 旨在分析国内不同藜麦种质资源品质性状的相关性和差异性, 同时也为藜麦育种提供部分依据。
从河北张家口和山西大同收集到的25份藜麦种质资源(表1)全部按行距60 cm和株距25 cm种植在15 m2小区中, 重复3次。试验点位于吉林省长春市净月区(43.87° N, 125.35° E), 试验地土质为中层黑土, 耕作层25 cm, 含有机质26.15 g kg-1、全氮1.42 g kg-1、碱解氮135.2 mg kg-1、速效磷60.36 mg kg-1、速效钾129.12 mg kg-1, pH值为7.58。6月2日人工穴播, 播前浇水, 株高在15 cm左右时开始间苗和第1次中耕除草, 株高在30 cm左右时第2次中耕除草并培土, 防止倒伏。整个生育期间未施肥; 9月28日植株叶片变黄脱落时开始收割, 脱粒后及时晾晒并磨粉待用。
| 表1 25份藜麦种质来源及特征 Table 1 Origin and characteristic of 25 quinoa germplasms |
1.2.1 蛋白质含量 参考农业标准NY/T 3-1982, 使用FOSS2300型全自动定氮仪(丹麦福斯特卡托公司)测定, 氮转换成蛋白质的系数为6.25。
1.2.2 淀粉含量 参考农业标准NY/T 11-1985, 使用WZZ-1S数字式旋光分析仪(上海物理光学仪器厂)测定。
1.2.3 脂肪含量 参考国家标准GB/T 5512-2008中索氏抽提法测定。
1.2.4 灰分含量 参考国家标准GB/T 22510-2008, 使用智能纤维箱式电阻炉(天津市中环实验电炉有限公司)测定。
1.2.5 水分含量 参照国家标准GB/T 20264-2006测定。
1.2.6 脂肪酸含量 参考Tang等[11]的方法, 略有改动。称取0.5 g藜麦粉于5 mL离心管中, 加入2 mL正己烷充分振荡0.5 min, 室温放置过夜, 移出1 mL上清液于另一个离心管中, 加入1 mL甲醇-氢氧化钾试剂反应振荡2 min, 在室温下反应1 h, 取上清液1 μ L进行气相色谱分析。气相色谱条件为HP-innowax 19091N-213 (30.0 m × 320 μ m × 0.5 μ m, Agilent); 不分流进样, 高纯氮载气, 流速为1.4 mL min-1; 进样口温度250℃, 检测器温度250℃; 程序升温的初始温度200℃, 保持20 min, 40℃ min-1升温至240℃保持1 min, 最后以20℃ min-1降温至200℃; 检测器为FID (氢离子火焰检测器)。采用面积归一法计算各成分的相对含量。
1.2.7 氨基酸含量 参考GB/T 5009.124-2003, 使用L-8800型全氨基酸自动分析仪(株式会社日立制作所)测定氨基酸含量。
1.2.8 总多酚含量 参考刘浩等[12]的方法并稍作修改。准确吸取0.2 mL标准品溶液, 加0.2 mL Folin-Ciocalten (1 mol L-1)显色剂, 加5%碳酸钠溶液1.6 mL, 静置反应15 min, 在740 nm波长处测定吸光度值; 以吸光度为纵坐标, 浓度为横坐标, 绘制标准曲线, 计算没食子酸当量。供试样品测定方法如标准曲线的制备, 总多酚的结果以每克藜麦样品中含有的等效没食子酸的毫克数(mg g-1)表示。
1.2.9 总黄酮含量 参考Abderrahim等[13]方法。吸取0.2 mL提取液至5 mL离心管中, 加入0.125%二苯基硼酸-2-氨基乙酯(溶于甲醇) 2 mL, 混匀并在室温下静置10 min。以试剂作空白, 在405 nm波长下用酶标仪测定吸光度值, 以槲皮素标准溶液制定的标准曲线换算出样品中总黄酮的含量, 总黄酮含量以每克藜麦样品中含有的等效槲皮素的毫克数(mg g-1)表示。
1.2.10 总皂苷含量 参考张文杰等[14]的方法并略作改动。取1 mL提取液至10 mL离心管中, 加入5%香草醛冰醋酸溶液0.8 mL和3.2 mL高氯酸摇匀。在50℃水浴条件下加热10 min, 取出后立即用流水冷却10 min, 摇匀。以试剂作空白, 在560 nm波长下用酶标仪测定吸光度值, 以齐墩果酸标准溶液制定的标准曲线换算出样品中总皂苷的含量, 总皂苷的结果以每克藜麦样品中含有的等效齐墩果酸的毫克数(mg g-1)表示。
试验结果用 
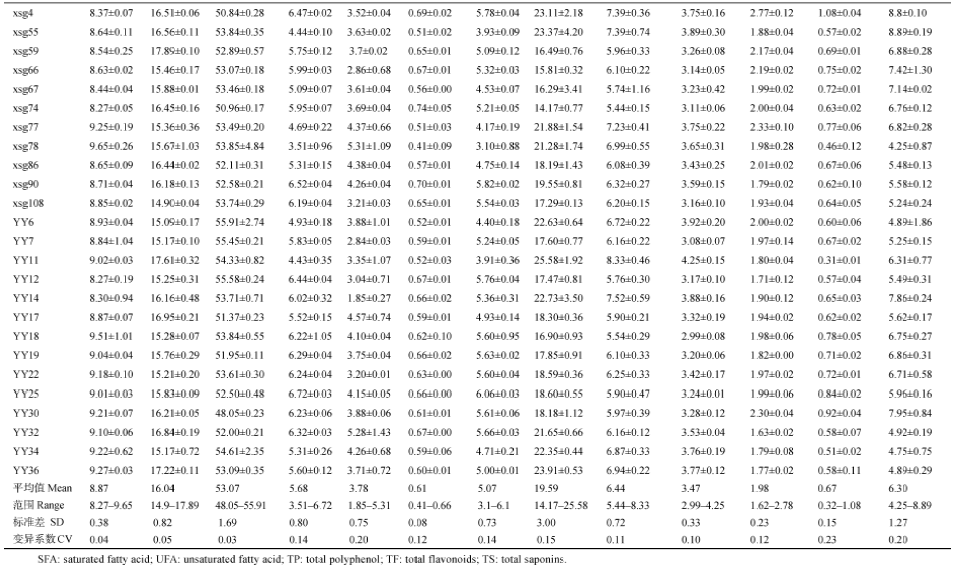
从表2中可以看出, 藜麦的主要营养成分是淀粉, 平均可达53.07% (48.05%~55.91%), 变异系数最小(3%)。其次为蛋白质, 平均在16.04% (14.90%~17.89%), 而藜麦籽粒中脂肪的含量较低(5.68%), 其中主要为不饱和脂肪酸(5.07%)。另外, 藜麦氨基酸中谷氨酸的含量最高, 为19.59 mg g-1(14.17~25.58 mg g-1), 与其他谷物相比, 藜麦籽粒中含有较高的赖氨酸和组氨酸, 分别为6.44 mg g-1和3.47 mg g-1。藜麦还含有丰富的酚类物质和皂苷, 总多酚的含量平均为1.98 mg g-1(1.62~2.78 mg g-1), 变异系数为12%, 总黄酮含量为0.32~1.08 mg g-1, 变异系数最大(23%), 另外, 藜麦籽粒中总皂苷的含量平均为6.3 mg g-1(4.25~8.89 mg g-1)。
| 表2 25份藜麦种质品质性状 Table 2 Quality traits of 25 quinoa germplasms |
表3表明, 在91个相关系数中, 12个表现出显著相关(P< 0.05), r≥ 0.34; 20个表现出极显著相关(P< 0.01), r≥ 0.47。其中, 脂肪与饱和脂肪酸、不饱和脂肪酸、总黄酮呈极显著正相关, 相关系数分别为0.91、0.99和0.55, 而与赖氨酸和组氨酸呈极显著负相关(-0.52和-0.54); 淀粉与脂肪和蛋白质呈负相关(-0.34和-0.41)。另外, 在功能性成分方面, 总多酚、总黄酮和总皂苷之间均具有极显著相关性。
| 表3 品质性状相关系数 Table 3 Correlation coefficients of quality traits |
利用SPSS19.0软件, 对25份藜麦种质的13种品质性状进行主成分分析, 计算各主成分的特征值、贡献率及累积贡献率。前5个主成分的贡献率分别为38.2%、21.2%、13.6%、11.1%和8.5%, 累计贡献率达到92.6%。原始变量和主成分的相关性分析表明, 第I主成分(PC1)中脂肪、饱和脂肪酸和不饱和脂肪酸的相关系数较大, 是对第I主成分影响最大的特征向量, 说明PC1可能是由它们几个组成的一个综合指标。而PC2主要代表总多酚和总皂苷; PC3主要代表灰分; PC4主要代表蛋白质; PC5主要代表谷氨酸。
从图1可以看出, YY30、xsg66、xsg74和YY25在PC1上的得分较高, 而YY11和xsg78得分较低; 在PC2的得分上, YY11、xsg55、YY14和xsg4较高, 而xsg78和YY12较低。
根据25份藜麦种质的品质性状, 使用平均联接(组间)的树状图, 重新调整距离进行聚类分析得到图2。结果表明, 当距离为16时, 25份藜麦种质被分为4组: A组所包含的种质最多, 共14份, 该组的主要特征为脂肪含量相对较高, 平均为6.0% (5.09%~6.72%); 而B组最少, 只有YY30一种; C组包括YY32、YY36、YY6等6种种质; D组包括xsg55、YY14、xsg4和YY11这4种, 该组的主要特征为多酚和皂苷含量较高(图1)。
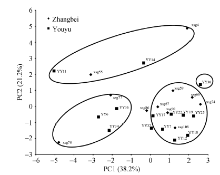 | 图1 25份藜麦种质主成分得分值Fig. 1 Biplot of the first and the second principal components (PC) for 25 quinoa germplasms |
藜麦种质的表型和基因型受其起源地环境的影响, 具有高度的多样性[15, 16]。本研究表明, 不同种质资源的品质性状之间有广泛的变化。在品质性状测定结果方面(表2), 本研究与国内外其他结果相近。25份藜麦种质资源的蛋白质、淀粉和脂肪含量分别为16.04%、53.07%和5.68%, 在Vega-Galvez等[17]的测定结果(12%~23%、32%~75%和1.8%~9.5%)范围之内。总多酚和总黄酮的含量分别为1.98 mg g-1(1.62~2.78 mg g-1)和0.67 mg g-1(0.32~1.08 mg g-1), 与Repo-Carrasco-Valencia等[18]报道的一致。另外, Mastebroek等[19]测定了藜麦叶片和籽粒中皂苷的含量, 其中籽粒皂苷的含量一般为4.7~11.3 mg g-1, 这与本研究的结果(6.3 mg g-1)具有一致性。
本研究将25份藜麦种质资源种植在相同的环境下, 排除环境以及环境与基因型互作带来的影响, 以便于分析不同种质资源的遗传差异性对品质性状的影响。从这个意义上讲, 不同藜麦种质资源品质性状相关性和差异性的分析结果在一定程度上可以为藜麦育种提供部分依据。结果显示脂肪与总黄酮呈极显著正相关, 杨雪峰等[20]发现150份不同类型大豆中脂肪含量与异黄酮含量呈极显著
正相关, 而黄明伟等[21]对中国北方地区50个大豆主栽品种研究发现其脂肪含量与总黄酮含量呈显著负相关, 因此作物中脂肪到底如何影响总黄酮含量尚待进一步研究。脂肪含量与赖氨酸和组氨酸含量呈负相关, 这与Qin等[22]对大豆报道相一致。另外, 总多酚、总黄酮和总皂苷之间均具有极显著相关性, 说明这3种次生代谢物质之间可能具有协同的关系[23]。
通过对25份藜麦种质的13种品质性状的主成分分析发现, 前5个主成分的累计贡献率达到92.6%, 表明各性状的贡献率分散, 累计贡献率增长不明显, 说明性状变异具有多向性。从原始变量和主成分的相关性分析发现, 脂肪、饱和脂肪酸和不饱和脂肪酸对第I主成分影响最大, 说明PC1代表的是脂肪因子。而PC2代表总多酚和总皂苷。从25份藜麦种质的第I和第II主成分得分图中发现, YY11、xsg55、YY14和xsg4在PC2上的得分较高, 说明它们的总多酚和总皂苷含量较高, 这与表2所描述的相一致。另外, xsg78第I和第II主成分的综合得分最低, 说明这份种质材料的脂肪性状和多酚皂苷含量的综合评价要低于其他种质材料。
亲本亲缘关系的远近决定后代材料的变异幅度, 亲缘关系差异越大, 后代变异幅度越大, 因此, 确定藜麦种质材料亲缘关系也能为以后杂交选择亲本提供依据[24]。本文使用系统聚类法按欧式遗传距离对25份藜麦种质材料进行聚类分析, 共分为4组, 各组间存在较大的品质性状差异。结合图1分析发现, A组所包含的种质最多, 共14份, 该组的主要特征为脂肪含量相对较高, 平均为6.0%, 但多酚和皂苷含量较低; 而B组最少, 只有YY30一种; C组包含6种种质, 其第I和第II主成分得分较低, 因此有待进一步改良; D组的4种材料主要特征为多酚和皂苷含量较高。可以看出, 来自相同区域的种质材料大多聚在一类, 表明遗传分歧的多向性与地理区域分布有一定的平行关系, 但也有一些种质材料类型间存在的遗传分歧和地理分布关系却不太大, 不同地区的材料可能聚在同一类中, 而同一地区的材料又聚到不同的类中, 这可能是自然选择的结果决定了品种遗传分歧的多向性[25]。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|