第一作者联系方式: 李自壮, E-mail: 15906682710@163.com; 徐乾坤, E-mail: xuqiankun1008@163.com
水稻叶色突变体是研究植物光合作用、叶绿素代谢和叶绿体发育的重要材料。本研究从籼稻品种蜀恢527经EMS (甲基磺酸乙酯)诱变处理后代中筛选出一个淡黄叶矮化突变体 Yellow leaf and dwarf( yld)。与野生型蜀恢527相比, 该突变体全生育期都表现出淡黄叶矮化性状, 其剑叶的淡黄色表型最为明显, 倒二叶次之, 倒三叶最弱, 其中剑叶的叶绿素及类胡萝卜素含量降低最为明显; 并且伴随着穗粒数、千粒重、结实率、株高等主要农艺性状的显著降低, 但有效穗显著增多。透射电镜观察结果显示, 与野生型相比, 该突变体多数叶绿体结构基本完整, 但基粒模糊, 基质片层大量减少且排列疏松。遗传分析表明, 该突变性状受一对隐性核基因控制。在 yld突变体与粳稻武运粳7号杂交的F2群体中分离出323个突变单株, 最终将 YLD基因定位在第11染色体的L5和L7两标记之间, 物理距离为115.7 kb。本研究为 YLD基因的克隆和功能分析奠定了基础。
Leaf color mutants of rice are ideal materials in studies on photosynthesis, chlorophyll metabolism and chloroplast development in plants. A yellow leaf and dwarf mutant, Yellow leaf and dwarf( yld), was obtained from ethyl methane sulfonate (EMS)-treated Shuhui 527 ( Oryza sativa L.). Compared with the wild type, the yld mutant showed yellow leaf and dwarfism, and the contents of chlorophyll and carotenoid were obviously decreased. Transmission electron microscope observation revealed that the structure of most chloroplasts seemed to be normal, however, with the fuzzy grana, and fewer and looser stroma lamella in the yld mutant. Meantime, plant height, branch number, grain number per panicle, 1000-grain weight and seed-setting rate were significantly decreased, while the number of effective panicle was obviously increased in the yld mutant compared with those in the wild type. Genetic analysis showed that the yld mutant traits were controlled by a single recessive gene. The 323 mutational individuals from the F2 generation of the cross of Wuyunjing 7 and yld mutant were used for gene mapping. Finally, the YLDlocus was mapped on chromosome 11 between two Indel markers L5 and L7, with an approximate 115 kb physical region. These results would facilitate cloning and functional analysis for the YLD gene.
叶片是植物光合作用的主要场所, 植物通过叶片的光合作用产生有机物并且储存能量[1], 实现了光能到化学能的转化, 是植物生命活动的基础。水稻叶色突变体是较常见的, 主要与叶绿体发育及叶绿素的合成或降解有关。对叶色突变相关基因的研究, 有助我们更好地了解叶绿素合成及代谢、植物光合作用、光化学反应等叶色调节机制[2, 3, 4, 5, 6]。水稻叶色突变类型丰富, 可细分为白化、黄化、浅绿、黄绿、绿白、白翠、绿黄、条纹8种类型[7]。目前, 国内外对水稻叶色突变体的大量研究, 定位并克隆了许多与叶色突变相关的基因, 如黄化基因OsCAO1[8]和CBL[9]编码叶绿素a加氧酶, 是催化叶绿素a合成叶绿素b的关键酶。OsCAO1基因突变导致叶片苍白、植株矮化, 严重时早衰早亡。cbl突变体表现出叶黄、植株半矮化、少分蘖。YGL1[10]编码叶绿素合酶, 催化叶绿素酸酯a转化为叶绿素a, 是叶绿素a生物合成最后一步反应的催化酶, 其突变型植株表现为黄绿叶表型。OsCHLH、OsCHLD和OsCHLI基因分别编码Mg-螯合酶的3个亚基, 该基因突变导致酶活性降低, 进而影响叶绿体发育, 致使类囊体膜发育不完全, 突变植株表现黄绿叶[11, 12]表型。NYC1和NOL[13, 14]编码叶绿素b还原酶, 控制叶绿素的降解, 突变体表现出持绿性。最近也报道了4个水稻叶色相关基因, 其中ALL1[15]基因编码多肽重复蛋白, 通过调节叶绿素合成相关基因来控制叶绿体发育, 突变体植株表现出白化叶。FdC2[16]基因编码类铁氧还原蛋白, 突变体植株表现出黄绿叶。PGL基因编码叶绿素a加氧酶, 其突变体表现出浅绿叶, 同时叶片提前衰老[17]。FGL[18]基因编码原叶绿素酸酯氧化还原酶B, 该酶在叶绿素合成中不可或缺, 突变体表现出黄叶。从水稻中还克隆出4个与类胡萝卜素代谢合成途径有关的基因[19], 其中OsPDS编码八氢番茄红素脱氢酶, 基因OsZDS编码ζ -胡萝卜素脱氢酶, OsCRTISO编码类胡萝卜素异构酶, β -OsLCY编码番茄红素β -羟化酶, 其任何一个基因的突变都会导致类胡萝卜素合成受阻, 导致叶片颜色改变, 影响光合作用。本研究从籼稻品种蜀恢527经EMS (甲基磺酸乙酯)诱变处理后代中筛选出一个淡黄叶矮化突变体yld, 该突变性状由一对隐形核基因控制。与野生型相比, 该突变体从表型到生理特征都有很大差异, 其多数叶绿体结构基本正常, 但基粒模糊, 基质片层大量减少且排列疏松, 叶绿素及类胡萝卜素含量降低, 花粉育性也降低。同时, 穗粒数、千粒重、结实率、株高等主要农艺性状都显著降低, 但有效穗显著增多。利用BSA法最终将YLD基因定位在标记L5和L7之间, 为该基因的克隆和基因功能研究奠定了基础。
突变体yld来源于EMS诱变处理籼稻品种蜀恢527的突变体库, 经过多代自交后, 该性状遗传稳定。yld突变体与粳稻品种武运粳7号杂交的F2代分离群体用于遗传分析和基因定位。
在分蘖期, 分别从突变体和野生型中随机选取长势一致的单株各5株, 分别取其剑叶、倒二叶及倒三叶, 去主脉, 剪成2~3 cm, 称取0.2 g浸泡于25 mL丙酮和乙醇的混合液(95%丙酮:无水乙醇 = 2:1)密封避光, 置26℃下暗培养24 h。用紫外分光光度计(DU640)测定提取液在470 nm、645 nm和663 nm 3个波长下的OD值, 重复3次。根据Livchtenthaler[20]改进的Arnon计算方法, 分别算出叶绿素a、叶绿素b和类胡萝卜素含量。
Chl a含量(mg g-1) = (12.7OD663 - 2.69OD645)V/ 1000W;
Chl b含量(mg g-1) = (22.9OD663 - 4.68OD645)V/ 1000W;
Car含量(mg g-1) = (1000OD470 - 3.27Chl a - 1.04Chl b)/[V/(1000W× 198)];
Total Chl含量(mg g-1) = Chl a + Chl b。
式中, V为叶绿体提取液体积(mL); W为叶片鲜重质量(g); OD为测定波长下的光密度值。
参照何瑞峰等[21]的方法用电镜观察突变体和野生型叶片的细胞结构。以戊二醛和锇酸双重固定后, 利用不同梯度的乙醇逐级脱水, 再置换和包埋, 制超薄切片, 以醋酸双氧铀和柠檬酸铅液双重染色, 用Hitachi公司的H-7650透射电镜观察和照相。
待植株成熟后, 分别随机选择野生型和突变体长势一致的单株各10株, 考察株高、有效穗数、穗粒数、结实率、千粒重等主要农艺性状, 然后对相关数据进行t测验统计分析。
随机选当天开花的野生型和突变体的小穗, 各取每穗4~5个颖花, 用卡诺固定液固定48 h, 然后将花药置载玻片上捣碎, 用1%的I2-KI溶液染色, 在显微镜下观察花粉染色情况, 并照相记录。每个材料重复3次。
利用BSA法筛选连锁标记[22], 首先使用公共引物进行多态性筛选。从F2群体中随机选出45株突变单株进行连锁实验, 初步确定该基因所在染色体的位置。再依据http://www.gramene.org/microsat设计SSR引物序列, 然后用所有突变单株进行精确定位。采用CTAB法[23]提取亲本及F2遗传群体植株的基因组DNA, 将提取的DNA用于PCR扩增实验。PCR总体积10 μ L, 含1.0 μ L 10× PCR buffer, 0.1 μ L 10 mmol L-1 dNTPs, 1.0 μ L前引物加1.0 μ L后引物, 1 μ L DNA, 0.1 μ L Taq DNA聚合酶, 5.8 μ L ddH2O。PCR程序为94℃预变性4 min; 94℃变性30 s、58℃退火30 s、72℃延伸30 s, 40个循环; 72℃延伸10 min。将PCR产物在4%琼脂糖凝胶上电泳分离。
选取杂交F2群体中淡黄叶矮化表型的分离单株为作图群体, 将具有武运粳7号带型的单株记为A, 具有突变体带型的单株记为B, 具有F1带型的单株记为H, 用MapMaker3.0进行遗传分子作图, 用Kosambi函数将重组率转化为遗传距离[24]。
在分蘖期, 提取野生型和突变体叶片总RNA, 所用试剂盒购于康宁生命科学有限公司。RNA经反转录合成cDNA, 利用实时荧光定量PCR分析叶色相关基因在野生型及突变体中的表达情况。qRT-PCR体系(10 μ L)含1 μ L cDNA、0.4 μ L引物、5 μ L SYBR Green PCR Master Mix、3.6 μ L ddH2O。PCR程序为95℃预变性 2 min; 95℃ 15 s, 60℃ 30 s, 40个循环。叶绿素合成、叶绿体发育及光合作用相关基因的表达引物见表1。
| 表1 qRT-PCR引物序列 Table 1 Primers for qRT-PCR |
突变体yld在整个生育期均表现出淡黄矮化表型, 剑叶淡黄色最为明显, 而野生型在整个生育期叶色均保持正常(图1)。此外, 相对于野生型, yld突变体除了有效穗数增加外, 其他农艺性状如株高、穗粒数、结实率、一次枝梗数、二次枝梗数都极显著降低, 千粒重显著降低(图1和表2), 其中, 每穗总粒数、千粒重、二次枝梗数分别为野生型的40.48%、78.47%和15.93%。
| 表2 野生型和yld突变体农艺性状 Table 2 Agronomic traits of the wild type (WT) and theyld mutant |
在分蘖期, 与野生型相比, yld突变体的剑叶和倒二叶的叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量显著降低(图2-A, B)。其中, 剑叶叶绿素a、叶绿素b、总叶绿素、类胡萝卜素含量降低最为明显, 倒三叶与野生型相比, 光合色素含量无明显差异(图2-A, C)。
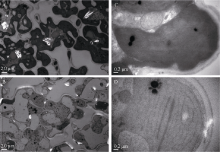
透射电镜观察显示, 野生型的叶绿体数目较多, 基质浓厚, 叶绿体内部的类囊体基粒片层结构明显且数量较多, 紧凑规律排列(图3-A, C); 而yld突变体多数叶绿体结构基本完整, 少数发生降解, 但基粒模糊, 基质片层大量减少且排列疏松(图3-B, D)。
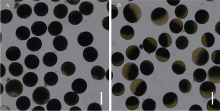
突变体yld结实率明显降低。观察表明, 野生型花粉几乎全部被染色(图4-A), 而yld突变体的花粉染色率较低, 多数花粉只有部分被染色(图4-B), 表明yld突变体花粉育性被影响, 其低结实率可能与花粉育性差有关。
武运粳7号与突变体yld杂交的F1植株表现正常, F2群体出现分离, 从1364株F2单株中获得323株突变体单株, 正常株(1041):突变株(323)符合3:1分离比(χ 2=1.19, χ 20.05=3.84), 表明yld突变性状受一对隐性核基因控制。
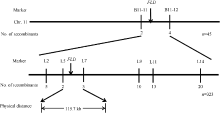
利用平均分布在12条染色体上的232对SSR引物扩增亲本和基因池DNA。其中, 位于第11染色体长臂上的B11-11和B11-12可能与YLD连锁。用F2定位群体中45株突变单株验证, 其中B11-11有2个交换株, B11-12有4个交换株, 且两边交换株不同, 初步将YLD基因定位在B11-11和B11-12之间(图5)。在标记B11-11和B11-12之间合成21对InDel引物, 其中7对在两亲本之间表现出多态性。利用所有的323株突变植株最终将YLD基因定位在标记L5 (F: 5° -AAATAATGGGCTTACGGAAAAA-3° , R: 5° -AGGCAGGTTATCCAAATTCA-3° )和L7 (F: 5° -C CATCTACATGAACTGGACATTGAC-3° , R: 5° -TTT ATAGGTATCTTCAGAACTCCCC-3° )之间, 其中L5有2个交换株, L7有3个交换株, 且两标记之间交换株不同, 遗传距离分别为0.3 cM和0.4 cM, 物理距离为115.7 kb (图5)。
突变体yld在全生育期都表现出淡黄叶性状, 叶绿体发育异常, 叶绿素含量降低。因此, 我们检测了yld突变体中叶绿素合成和降解以及衰老相关基因的表达情况, 其中叶绿素合成相关基因包括HEMA (谷氨酰-tRNA还原酶)、PORA (NADPH原叶绿素酸酯氧化还原酶)、CAO1 (叶绿素酸酯氧化酶)、PORB (原叶绿素酸酯氧化还原酶)、CHLH (镁离子螯合酶H亚基)、DVR (脱脂基叶绿素酸酯a乙烯基还原酶), 叶绿素降解相关基因包括NYC1 (叶绿素b还原酶)、NYC3 (α /β 水解酶家族蛋白)、NYC4 (叶绿素前体蛋白酶)、PAO (脱镁叶绿酸a氧化酶)和RCCR1 (红色素代谢产物还原酶), 衰老相关基因包括CatB (过氧化氢酶)、POD1和POD2 (过氧化物酶)、APX2 (抗坏血酸过氧化物酶)及H36 (转氨酶)。qRT-PCR结果表明, 与野生型相比, HEMA、CHLH、DVR、PORA、PORA、NYC3、NYC4、PAO、PCCR1表达量大幅度降低, APX2、H36表达量大幅度上升, NYC1、CAO1、POD1、POD2、CatB表达量没有明显变化(图6)。
叶色突变导致植物的光合作用受阻, 影响有机物质积累, 进而减产, 严重时甚至会导致植株死亡[25]。目前, 在第11染色体上已经被定位的叶色相关基因中, YGL138[26]基因编码54 kD信号识别颗粒蛋白, 作为叶绿体前体起作用, 突变体表现黄绿叶, 并伴随着穗粒数、结实率及叶绿素含量的降低。突变体etl1[27]类囊体分散导致光合作用受阻, 在发芽期呈现出淡黄色的芽和叶, 随着生长发育, 胚乳中的有机物逐渐消耗殆尽致使植株苗期死亡。ZEBRA2[28]基因编码类胡萝卜素异构酶, zebra2突变体中叶黄素含量降低导致斑马叶性状。本研究yld突变体也位于第11染色体, 但是其全生育期叶片均呈现淡黄且植株矮化, 与上述已报道的叶色突变不同, 推测yld可能是一个新的叶色突变体。
光合色素的含量直接影响叶片的颜色和光合作用[29], yld突变体叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均显著减少, 导致其整个生育期都表现出淡黄叶。超微结构表明, yld突变体叶肉细胞中虽多数叶绿体结构基本完整, 但基粒模糊, 基质片层大量减少且排列疏松, 可能影响了光合作用, 并进而导致植株矮化、穗粒数减少、结实率降低、千粒重下降等。光合和衰老相关基因的表达分析显示, 相比于野生型, 突变体yld叶绿素合成途径相关基因HEMA、CHLH、DVR、PORA、PORB大幅度下降, 表明突变体植株的叶绿素合成受阻, 导致叶绿素含量降低; 叶绿素降解途径相关基因NYC3、NYC4、PAO、PCCR1表达量大幅度降低, 可能是突变体植株的叶绿素合成不足的缘故。衰老相关基因APX2、h36表达量大幅度上升, 尤其h36是水稻衰老的标志基因, 其表达量的高低可直接反应叶片衰老程度, 暗示了yld突变体衰老进程可能较快, 类似于淡绿叶突变体pgl[17]。
遗传分析和基因定位表明, yld受单隐性核基因控制, 该基因位于第11染色体L5和L7标记之间, 物理距离115.7 kb。在该定位区间内共包含16个注释基因即1个唾液酸转移酶结构域蛋白基因, ZEBRA2基因, 1个OsFBO15-F-box结构域蛋白基因, 1个热击蛋白基因, 3个锌指结构蛋白基因, 3个未知基因, 6个假定蛋白基因。16个注释基因中只有ZEBRA2基因被克隆, 编码了一个类胡萝卜素异构酶, 该基因突变导致黄绿相间的条纹叶(即斑马叶), 光合速率下降, 叶绿素和叶黄素含量降低[28]。然而yld突变体在全生育期都表现淡黄叶矮化, 且穗粒数、千粒重、结实率显著降低, 但有效穗显著增多, 与突变体zebra2表型具有较大差异。同时, 测序结果表明未发现ZEBRA2基因的编码区在野生型和yld突变体中有碱基改变, 说明yld的突变性状可能不是由ZEBRA2基因突变所致。因此, YLD基因可能是一个新的叶色基因, 该基因的克隆将为水稻叶色机制研究奠定基础, 同时也可作为育种的优良种质资源。
yld突变体在全生育期均表现出淡黄叶矮化表型, 并伴随着有效穗数增加和株高、千粒重、结实率下降、穗粒数和枝梗数减少。与野生型相比, 该突变体叶肉细胞多数叶绿体结构基本完整, 但基粒模糊, 基质片层大量减少且排列疏松。突变体叶绿素和类胡萝卜素的含量降低、花粉育性降低、结实率下降。yld突变体性状受1对隐性核基因控制, 该基因被定位在第11染色体长臂端L5和L7标记之间, 物理距离为115.7 kb, 可能是一个新的叶色基因。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|