第一作者联系方式: E-mail: yutaosdnd@163.com **同等贡献(Contributed equally to this work)
玉米籽粒发育早期, 代谢活动旺盛, 细胞分裂与增大活跃, 为后续贮藏物质的合成形成充足库容。为阐明籽粒早期发育的蛋白合成、积累与调控过程, 本研究以夏玉米品种登海661为试验材料, 在开花期人工饱和授粉后第3、第5、第10天取果穗中部籽粒, 利用同位素标记相对定量(iTRAQ)技术分析其蛋白差异表达特性。玉米籽粒早期发育阶段总计鉴定及定量2639种蛋白, 这些蛋白涉及多种生物过程与分子功能, 其中代谢过程和分子过程是最主要的2个生物过程; 催化活性和绑定功能是最主要的2个分子功能, 这些生物过程与分子功能对籽粒早期发育具有重要作用。定量分析结果表明137种蛋白在籽粒发育早期显著差异表达, 其功能涉及蛋白代谢、胁迫响应、细胞生长与分裂、碳水化合物与能量代谢、转运、次生物质代谢、淀粉合成、转录、油脂代谢、信号转导、氨基酸代谢等。其中, 表达差异较大的是与蛋白代谢、胁迫响应、细胞生长与分裂以及碳水化合物与能量代谢相关的蛋白。表达模式聚类结果显示这些不同功能类别的蛋白协同表达, 共同调控玉米籽粒的早期发育。
During the early stage of maize grain development, the metabolic activity is strong and the cell division and enlargement processes are also active, leading to increase the grain sink size for subsequent accumulation of storage material. To explore the protein synthesis, accumulation and regulation during early maize grain development, grains of maize cultivar Denghai 661 in the middle of ear were harvested at 3, 5, and 10 days after flowering artificial saturation pollination, respectively, and analyzed by isobaric tags for relative and absolute quantitation (iTRAQ) proteomics. A total of 2639 proteins were identified and quantified in maize grain during early stages of development, showing that these proteins were involved in diverse biological processes and molecular functions, of which the metabolic process and molecular processes were the two most important biological processes, and the catalytic activity and binding were the two most important molecular functions, all of them played important roles in maize grain development. Quantitative analysis showed that 137 proteins significantly differentially expressed during early maize grain development, and these proteins were involved in protein metabolism, stress response, cell growth and division, carbohydrate and energy metabolism, transport, secondary metabolism, starch synthesis, transcription, lipid metabolism, signal transduction and amino acid metabolism. Among them, the proteins expressed more differentially were related to protein metabolism, stress response, cell growth and division, carbohydrate and energy metabolism. Expression patterns clustering analysis showed that these proteins in different functional categories expressed synergically to regulate the early development of maize grain.
玉米籽粒发育一般划分为3个阶段, 即早期发育、灌浆期与成熟期[1]。其早期发育阶段是一个关键时期, 一般从授粉到授粉后第12天。在此期间, 籽粒细胞经历核内复制、细胞化、细胞分化、分裂等过程, 其胚乳细胞数量与体积持续增大, 进而为后续营养物质的贮藏奠定基础[2]。玉米籽粒早期发育过程中的胚乳细胞增殖受内源激素和相关酶活性的直接或者间接调控, 胚乳细胞数目与粒重呈极显著正相关关系[3]。早期发育阶段也是籽粒极易败育的时期, 籽粒败育显著影响玉米穗粒数和产量的进一步提高[4, 5]。因此, 探明玉米籽粒早期发育复杂的生理生化过程及潜在的分子调控机理对提升籽粒产量具有重要意义。
近年来, 已有不少研究在转录水平上探讨玉米籽粒发育的分子调控过程。转录组学的相关结果表明, 涉及激素代谢、细胞壁代谢、细胞循环、氨基酸代谢、DNA及蛋白合成的基因在玉米籽粒早期大量表达, 显示出这些过程与籽粒早期发育密切相关[6, 7]。然而, 蛋白才是细胞活性和功能的最终执行者, 由于存在转录后修饰与翻译后修饰, mRNA表达水平与其对应蛋白之间并没有显著一致性[8]。因此, 有必要在蛋白质组学水平上探讨籽粒发育过程中的蛋白表达特性。研究发现小麦籽粒发育早期249种蛋白存在差异表达, 主要涉及碳代谢、细胞分化、细胞骨架、蛋白合成以及信号转导, 表明这些过程对小麦籽粒的早期发育具有重要作用[9]。Mé chin等[10]在玉米胚乳中鉴定到496种蛋白, 主要参与代谢、蛋白合成、细胞防御、死亡及老化等过程。Jin等[11]研究了玉米籽粒灌浆期的蛋白表达特性, 在胚乳中发现39种差异蛋白, 主要涉及糖酵解与氧化还原平衡反应; 胚中发现43种差异蛋白, 主要参与油脂代谢过程。Huang等[12]研究了玉米籽粒成熟期的耐脱水机制, 发现11种胁迫响应蛋白与籽粒的耐脱水能力显著相关。然而, 有关玉米籽粒早期发育阶段蛋白表达特性与功能分布的研究鲜见报道。
基于传统凝胶的双向电泳技术一直是植物蛋白质组学最主要的研究方法[13, 14, 15]。随着蛋白质组学的迅速发展, 同位素标记相对定量(iTRAQ)技术已经成为植物蛋白质组学研究的重要工具之一。该技术能够在复杂的样品中高通量地鉴定蛋白, 并且提供精确的定量信息[16, 17]。因此, 本文利用iTRAQ技术分析了玉米籽粒早期发育阶段蛋白的表达特性, 通过鉴定差异表达蛋白并分析其生物学功能, 进而阐明籽粒早期发育阶段相关分子调控机理, 为探索促进玉米籽粒早期发育, 进而提高籽粒产量提供理论支持。
以高产夏玉米品种登海661为试验材料, 在山东农业大学黄淮海玉米区域技术创新中心(36.09° N, 117.09° E)和作物生物学国家重点实验室进行相关试验。播种前精细整地, 造墒, 种植密度为67 500株 hm-2。田间管理按照常规高产栽培技术管理, 生育期内肥水供应充足, 及时预防病虫草害。吐丝期, 选择生长发育一致的玉米植株挂牌标记, 开花期人工饱和授粉。在授粉后的第3、第5、第10天分别取3个玉米果穗作为生物学重复。随后, 将每个果穗等分为上、中、下三部分, 迅速剥离中部籽粒后液氮速冻, 置-80℃冰箱保存。
采用三氯乙酸-丙酮法独立提取每个生物学重复玉米籽粒总蛋白。称取1 g籽粒样品于液氮中研磨并悬浮于10倍体积预冷的-20℃丙酮溶液中(含10%三氯乙酸)。充分混匀后, 于-20℃静置2 h, 4℃、20 000× g离心30 min, 弃上清液。重复用预冷的-20℃丙酮溶液悬浮沉淀并离心多次直至沉淀基本为白色, 后将沉淀真空干燥。称取0.2 g沉淀于3 mL裂解液(8 mol L-1 Urea, 30 mmol L-1 HEPES, 1 mmol L-1 PMSF, 2 mmol L-1 EDTA, 10 mmol L-1 DTT)中提取籽粒蛋白。4℃、20 000× g离心30 min, 取上清液, 加入DTT至终浓度10 mmol L-1, 56℃水浴1 h, 随后迅速加入IAM至终浓度55 mmol L-1, 暗室静置1 h。混合后的样品中加入4倍体积预冷的-20℃丙酮溶液, -20℃静止3 h, 4℃、20 000× g离心30 min。取沉淀溶解于400 μ L的复溶液(0.5 mol L-1 TEAB, 0.1% SDS)中, 4℃、20 000× g再次离心30 min, 取上清液。采用蛋白定量试剂盒测定蛋白浓度。
取100 μ g蛋白样品加入3.3 μ g胰蛋白酶, 37℃水浴24 h。再次补加胰蛋白酶1 μ g, 37℃水浴24 h。真空离心泵抽干肽段, 加入40 μ L 0.5 mol L-1 TEAB及60 μ L异丙醇重新溶解肽段。按照试剂盒说明, 每组生物学重复中的授粉后第3、第5、第10天的籽粒蛋白样品用iTRAQ试剂中的113、114、115分别标记(AB SCIEX, Framingham, MA, USA)。3个标记的蛋白样品经室温培养2 h, 混合后真空干燥。
将混合后的肽段样品溶于10倍体积的缓冲液A (10 mmol L-1 KH2PO4, 25%乙腈, pH 3.0)。采用岛津高效液相色谱系统并装配强阳离子交换色谱柱(250.0 mm × 4.6 mm, 5 μ m, 100 Å )洗脱肽段。洗脱液B (10 mmol L-1 KH2PO4, 2 mol L-1 KCl, 25%乙腈, pH 3.0)的流速为1 mL min-1并设置分级梯度(0, 45 min; 0~5%, 1 min; 5%~30%, 20 min; 30%~50%, 5 min并维持5 min; 50%~100%, 5 min并维持10 min)。在241 nm吸光度下检测, 筛选得到16个组分, 将每个组分用StrataX除盐, 低温离心抽干, -80℃保存。质谱分析使用纳升液相系统(Shimadzu, Kyoto, Japan)并连接Q-Exactive质谱分析仪(Thermo Fisher Scientific, MA, USA)。对3组生物学重复进行独立的质谱分析, 每组包括3个时期(3 d, 5 d, 10 d)的肽段样品, 并且采用Ma等[17]的试验方法进行质谱参数设置。
采用 MASCOT软件(版本2.3.01, Matrix Science, London, UK)以及Proteome Discoverer软件(版本1.3, Thermo Fisher Scientific, MA, USA)对蛋白进行定性及定量分析。将原始质谱数据自动匹配Uniprot玉米蛋白数据库。搜索参数设置, 以胰蛋白酶作为消化类型, 并且允许1个最大的酶漏切位点; 固定修饰采用半胱氨酸, 可变修饰采用iTRAQ 8-plex(K)、iTRAQ 8-plex(Y)、iTRAQ 8-plex(N-term)及Oxidation(M); 肽段质量误差为15 U; 串联质谱误差为0.1 Da。蛋白至少含有一个唯一肽段, 并且阳性结果错误率(FDR)≤ 1%才被认为鉴定有效。对于蛋白定量, 在每一个生物学重复中以授粉后第3天的籽粒样品为参考, 将后续2个时期的蛋白样品分别与之比对。只有蛋白的定量信息至少存在于2次的生物学重复中才作进一步分析。以3次生物学重复的平均值作为最终蛋白表达倍率。籽粒发育过程中, 定义平均相对表达水平上调或下调差异大于1.5倍, 并且在统计学ANOVA检验上P< 0.05的蛋白为显著差异表达的蛋白。
鉴定及量化的玉米籽粒蛋白按照生物过程(biological process)、分子功能(molecular function)、细胞组成(cellular component)的功能范畴进行基因本轮(GO)注释。进一步, 对这些蛋白根据KEGG (Kyoto Encyclopedia of Genes and Genomes)数据库进行功能注释及归类。采用Cluster 3.0软件对籽粒发育过程中差异蛋白进行表达模式聚类分析, 聚类参数为相似性及欧氏距离。对聚类结果采用Java TreeView软件进行可视化处理。
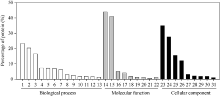
用iTRAQ技术分析玉米籽粒早期发育阶段3个时期的籽粒蛋白样品, 总计2639种蛋白被成功鉴定和定量。GO注释分析发现玉米籽粒蛋白参与多重生物过程, 具有多种分子功能。生物过程中, 代谢过程和分子过程所占的比例最高; 分子功能中, 催化活性和绑定功能所占的比例最高; 细胞组成中, 细胞和细胞器所占的比例最高(图1)。
进一步运用KEGG数据库对这些蛋白进行功能归类。如图2所示, 玉米籽粒中的蛋白涉及多样的代谢通路, 最主要的10个代谢通路分别是代谢途径(metabolic pathways, 1202种)、次生代谢物合成(biosynthesis of secondary metabolites, 683种)、碳代谢(carbon metabolism, 263种)、氨基酸合成(biosynthesis of amino acids, 246种)、核糖体(ribosome, 238种)、内质网蛋白加工(protein processing in endoplasmic reticulum, 171种)、RNA转运(RNA transport, 164种)、糖酵解/糖异生(glycolysis/gluconeogenesis, 149种)、剪接体(spliceosome, 143种)以及淀粉与蔗糖代谢(starch and sucrose metabolism, 117种)。
定量分析显示137个蛋白在3个时期出现显著差异表达(P< 0.05)(见附表1)。按照蛋白数据库预测的生物学功能将这些差异蛋白划分为12种功能类别(表2)。其中, 差异蛋白所占比例最大的4种功能类别分别是蛋白代谢(31%)、胁迫响应(17%)、细胞生长与分裂(13%)以及碳水化合物与能量代谢(12%), 表明这4种功能类别在籽粒早期发育过程中发挥重要作用。其他的功能类别包括转运(4%)、次生物质代谢(4%)、淀粉合成(4%)、转录(4%)、油脂代谢(3%)、信号转导(3%)、氨基酸代谢(1%)及未分类蛋白(4%)(表2)。
| 表2 玉米籽粒早期发育阶段差异蛋白在不同表达模式中的功能分布 Table 2 Distribution of functions of differentially expressed proteins in different expression patterns during early maize grain development |
| 附表1 鉴定玉米籽粒早期发育阶段显著差异表达的蛋白 Supplementary table 1 Identification of significantly different expressed proteins during early maize grain development |
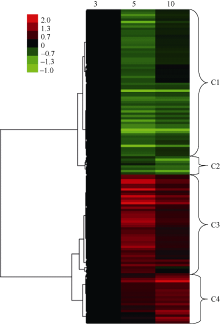
进一步聚类分析表明差异蛋白主要为四大类表达模式(图3)。表达模式c1包含64种蛋白, 其在授粉后第3、第10天均显著积累, 而在授粉后第5天表达水平最低, 这些蛋白主要涉及蛋白代谢(32种)、细胞生长与分裂(14种); 表达模式c2仅包含8种蛋白, 且在授粉后第3天具有表达高峰; 表达模式c3包含43种蛋白, 与表达模式c1正好相反, 在授粉后第5天显著积累, 这些蛋白主要参与胁迫响应(10种)、蛋白代谢(8种)、碳水化合物与能量代谢(8种); 表达模式c4包含22种蛋白, 其表达水平在授粉后第10 天最高, 这些蛋白主要涉及碳水化合物与能量代谢(7种)、胁迫响应(6种)(表2)。
玉米籽粒发育是一个复杂的生物学过程, 其中早期发育阶段是一个关键时期, 在此期间, 胚乳细胞数目与体积快速增大, 进而为后续营养物质的贮藏奠定基础[1, 2]。本研究为充分解析在这一阶段的蛋白表达特性及其调控过程, 利用iTRAQ技术对授粉后第3、第5、第10天的籽粒进行蛋白质组学分析。成功鉴定及定量总计2639种蛋白, 其数量显著高于过去以双向电泳技术为基础的蛋白质组学研究[10, 11, 12], 表明iTRAQ技术的高通量特性。定量分析显示137种蛋白在籽粒发育早期显著差异表达, 主要涉及蛋白代谢、胁迫响应、细胞生长与分裂以及碳水化合物与能量代谢(表2和附表1)。这些结果与玉米籽粒转录组[6, 7]以及小麦籽粒蛋白质组学研究结果[9]相一致, 表明多重代谢途径参与了籽粒的早期发育。
细胞快速增殖是籽粒发育早期的主要过程[2]。相对应的, 18种涉及细胞生长与分裂的蛋白(如DNA replication licensing factor MCM3 homolog 1、Histone、tubulin alpha-3 chain等)在籽粒发育早期差异表达, 并且主要在授粉后第3、第10天显著积累(c1, 表2)。其中, α -3链微管蛋白(tubulin alpha-3 chain)作为骨架蛋白可以通过调控细胞器以及染色体的分离, 参与细胞循环中的分裂与扩大过程[18]。该蛋白同样在小麦籽粒发育早期显著积累[9], 可见α -3链微管蛋白的差异表达与玉米籽粒早期发育阶段快速的细胞增殖密切相关。同时, 还发现4种差异蛋白(auxin-induced protein PCNT115、colorless 2、gibberellin receptor GID1L2和isopentenyl transferase IPT8)参与籽粒的信号转导过程, 其中生长素诱导蛋白PCNT115参与IAA的信号转导, 赤霉素受体GID1L2参与GA3信号转导(见附表1)。研究发现IAA对籽粒灌浆和粒重的形成起调节作用, 这种调节作用可能是通过调控胚乳细胞的分裂和增加库强来实现[19], 而GA3在玉米胚乳细胞增殖和籽粒灌浆早期含量最高[20]。因此, 推测这2种蛋白的显著差异表达提升了IAA与GA3的信号传导过程, 进而促进籽粒发育早期的胚乳细胞增殖。
蛋白几乎调控细胞内所有的生理生化反应, 同时还作为结构蛋白以及信号分子影响细胞进程。因此, 蛋白的合成包括起始、延长及终止过程都对籽粒发育具有重要作用[21]。本研究中, 蛋白代谢是包含差异蛋白数目最多的功能类别(表2), 主要包括参与蛋白合成途径的蛋白, 如翻译起始因子(如eukaryotic initiation factor 4A等)、延长因子(如elongation factor 1-alpha等)以及一系列的核糖体蛋白(如40S ribosomal protein、60S ribosomal protein等), 这些蛋白主要在授粉后第3、第10天显著积累(c1, 表2), 显示出活跃的蛋白合成过程, 以满足快速的细胞增殖对新生蛋白的需求。其中, 核糖体蛋白不但参与蛋白的合成途径, 还参与细胞的生长与死亡过程, 核糖体蛋白突变会引起植物细胞的生长缺陷[22]。在小麦[17]和水稻[23]中的研究发现籽粒发育早期存在活跃的蛋白周转与重排过程。本研究中, 4个差异蛋白(polyubiquitin-like protein isoform 1、putative ubiquitin-conjugating enzyme family和2个proteasome subunit alpha type)参与泛素26S蛋白酶体系统。该系统是真核细胞中主要的蛋白水解途径, 可通过调节蛋白合成与水解的比例在多重生理过程中, 如细胞循环、细胞形态及胁迫响应等发挥重要作用[24]。定量分析显示这些泛素26S蛋白酶体系统相关蛋白主要在授粉后第3、第10天显著表达(c1, 见附表1), 表明玉米籽粒发育早期同样存在活跃的蛋白周转与重排过程, 这对籽粒早期发育具有重要作用。
玉米籽粒早期发育阶段需要大量的能量以及代谢物[25], 而中心碳代谢能够为多种代谢途径提供必要的能量与中间产物, 并且中间产物的浓度梯度还可以作为信号分子调控生理过程[28]。本研究中, 17种碳水化合物与能量代谢相关的差异蛋白主要涉及糖酵解(如fructokinase-2、glyceraldehyde-3-phosphate dehydrogenase、pyruvate kinase、triosephosphate isomerase等)、磷酸戊糖途径(如6-phosphogluconolactonase、glucose-6-phosphate 1-dehydrogenase)以及氧化磷酸化(如ATP synthase epsilon chain、cytochrome c、NADH-ubiquinone oxidoreductase 13 kD-B subunit等)(见附表1)。Lee等[23]研究发现糖酵解相关酶在水稻籽粒发育早期显著积累, 活跃的糖酵解途径为籽粒发育提供了大量能量。本研究中, 玉米籽粒的糖酵解相关酶主要在授粉后第5、第10天显著表达(c3、c4, 见附表1), 氧化磷酸化相关酶主要在授粉后第5天显著积累(c3, 见附表1), 说明玉米籽粒早期同样存在活跃的糖酵解以及氧化磷酸化途径, 进而产生更多的能量以满足其生长发育的高能量需求。磷酸戊糖途径作为重要的植物代谢途径, 主要为其他代谢过程提供必要的还原力与磷酸戊糖[29]。2种差异蛋白涉及磷酸戊糖途径, 其中6-磷酸葡萄糖酸内酯酶(6-phosphogluconolactonase)在授粉后第10天显著积累, 而1, 6-磷酸葡萄糖脱氢酶(glucose-6-phosphate 1-dehydrogenase)在授粉后第3天显著积累(见附表1)。研究发现籽粒发育早期快速的细胞分裂需要大量脂肪酸与核酸的供应, 而活跃的磷酸戊糖途径能够为脂肪酸与核酸的合成提供必需的还原力与磷酸戊糖[27]。此外, 本研究还发现5种差异蛋白(glucose-1-phosphate adenylyltransferase、granule bound starch synthase IIa precursor、soluble starch synthase I, chloroplastic/amyloplastic、soluble starch synthase III、starch branching enzyme IIb)与淀粉合成相关, 并且在授粉后第5天显著积累(c3, 见附表1)。研究发现在玉米籽粒的发育早期就已经观察到少量淀粉粒的出现[28], 这些差异表达的淀粉合成相关酶可能参与了玉米籽粒的早期淀粉合成。
籽粒发育过程中不可避免地遭受多重胁迫环境, 因此, 快速、协调的胁迫响应机制对保护籽粒发育具有重要意义。籽粒发育早期, 种皮还未成熟, 氧气易通过渗透作用进入籽粒内部, 同时该阶段进行着活跃的代谢反应, 籽粒细胞内部会源源不断地产生活性氧类物质(ROS)[29]。过多积累的ROS会产生毒害作用, 进而损伤细胞组件及功能蛋白。已有研究报道积累过多的ROS会导致龙眼籽粒的败育[30], 而植物细胞可以启动多重的抗氧化途径来清除过多的ROS, 稳定细胞内ROS的平衡[31]。本研究中, 多重的胁迫响应相关蛋白在籽粒发育早期差异表达, 其中包含一系列的抗氧化酶(如APx1-cytosolic ascorbate peroxidase、glutathione S-transferase 6、peroxiredoxin-5、superoxide dismutase、thioredoxin等)(见附表1), 表明籽粒发育早期存在多样的抗氧化酶系统, 协同维护了ROS的体内平衡。同时, 同一蛋白的不同亚型表现出不同的表达模式, 如3种硫氧还原蛋白(thioredoxin), 一种在授粉后第3、第10天均显著积累(c1), 其余的2种分别在授粉后第5、第10天显著积累(c3、c4, 见附表1)。这表明籽粒不同发育时期不同的蛋白亚型发挥作用, 这也与小麦中的研究结果相一致[17]。同时, 一些差异蛋白(如cystatin、lipoxygenase、subtilisin-chymotrypsin inhibitor CI-1B等)还参与其他的胁迫响应过程。其中, 脂氧合酶(lipoxygenase)是植物体内一类重要同工酶, 在植物的生长发育、成熟衰老以及抵御机械伤害和病虫侵染等逆境过程起重要的调节作用[32]。生物胁迫或者非生物胁迫条件下, 脂氧合酶被诱导积累, 显著增强了植物的耐胁迫能力, 同时该蛋白还可以通过合成茉莉酸进而直接调控胁迫信号的转导[33]。本研究中, 3种脂氧合酶亚型分别在授粉后第3、第5、第10天显著积累(c2、c3、c4, 见附表1), 可见脂氧合酶在籽粒发育早期对抵御生物、非生物胁迫方面发挥着重要作用。
此外, 本研究中还发现一些差异蛋白涉及油脂代谢、转录、次生物质代谢、转运及氨基酸代谢, 表明这些过程同样参与籽粒的早期发育(表2和附表1)。其中, 参与氨基酸代谢的S-腺苷甲硫氨酸合酶(S-adenosylmethionine synthase)能够催化甲硫氨酸和ATP反应生成S-腺苷甲硫氨酸(SAM)。一方面, SAM可以作为甲基供体参与植物的转甲基、转氨丙基、转硫反应等重要的生理代谢过程; 另一方面, SAM也是乙烯及多胺生物合成的前体, 而乙烯与多胺作为植物生长调节剂调控了植物多重生理生化反应[34]。研究发现乙烯与多胺参与玉米籽粒的构建过程[35]。本研究中, 2种S-腺苷甲硫氨酸合酶在授粉后第3天显著积累(c1, 见附表1), 推测其可能通过调控乙烯与多胺的合成参与籽粒的早期发育。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|