第一作者联系方式: 马骊, E-mail: 348369277@qq.com, Tel: 18189560623; 袁金海, E-mail:954152476@qq.com
类甜蛋白是一种能在低温胁迫下诱导表达, 增强植物抗逆性的关键蛋白质。本研究运用双向电泳结合质谱技术, 筛选低温胁迫下陇油7号叶片差异蛋白点, 从中分离出与抗寒密切相关的类甜蛋白。根据已发表植物类甜蛋白基因 TLP的保守序列设计引物, 采用RT-PCR扩增陇油7号的DNA, 获得 TLP基因开放阅读框, 长度为732 bp, 编码243个氨基酸的蛋白质。生物信息学分析显示, 与甘蓝型油菜( Brassica napus)的蛋白质氨基酸序列同源性高达99.18%, 该基因在进化上高度保守, 其保守序列属于植物的GH69-TLP-SF超家族, TLP相对分子质量和理论等电点分别为26.02 kD和9.15。TLP含有一个信号肽, 为亲水性蛋白, 亚细胞定位预测其是在内质网中合成的蛋白。二级结构预测表明陇油7号的TLP是由不规则卷曲和延伸链组成的不稳定蛋白。实时荧光定量和半定量分析显示, 在适当阈值的低温胁迫下 TLP基因表达量上调, 表明该基因在白菜型冬油菜陇油7号适应低温胁迫过程中发挥重要作用。
Thaumatin-like protein (TLP) is an essential protein induced by low temperature stress and enhances plant resistance to adverse circumstances. In our study, we selected differential protein spots from Longyou 7 leaves under low temperature stress and separated TLP closely related to cold resistance by using two-dimensional electrophoresis and mass spectrometry. Using the primers of TLP cDNA sequences and reverse transcription PCR (RT-PCR), we cloned the complete open reading frame of TLP gene of winter Brassica rapa cultivar Longyou 7. The sequence length of TLP from B. rapa was 732 bp, encoding a protein of 243 amino acid residues with a predicted molecular weight of 26.02 kD and a theoretical pI of 9.02. Bioinformatics analysis showed a similarity of 99.18% in TLP amino acid sequence between B. rapa and Brassica napus, the predicted TLP contained a conserved amino acid sequence belonging to the plant GH69-TLP-SF superfamily. The TLP had one signal peptide which belongs to hydrophilic protein. Moreover, the detection of subcellular localization suggested the synthetic process of this protein is in the endoplasmic reticulum. The prediction of the second structures indicated that TLP is a labile protein consisting of random coils and extended strands. The expression analysis of TLP gene by utilizing real time and Semi-quantitative RT-PCR suggested that the TLP expression could be up-regulated in response to lower temperature. In conclusion, TLP gene of the winter B. rapa cultivar Longyou 7 might play a significant role in response to cold stress.
蛋白质是生理功能的执行者, 是生命现象的直接体现者, 要对生命的复杂活动有全面和深入的认识, 就必须进行蛋白质组学方面的研究[1]。双向凝胶电泳(two- dimensional gel electrophoresis, 2-DE)是蛋白质组学研究领域比较成熟的一项技术, 特别在抗逆性差异蛋白质的分析及鉴定方面, 利用2-DE技术能够比较分析生物样品在不同条件下蛋白质组学的动态变化, 从而发现和鉴定出特异功能的蛋白质, 根据蛋白质序列设计寡核苷酸引物, 为进一步进行基因克隆和蛋白质结构的测定奠定基础。研究表明, 类甜蛋白分布广泛, 具有广谱抗冻活性、抗真菌活性、β -1, 3葡聚糖酶活性、酶抑制活性及过敏原活性等[2, 3, 4]。非生物和生物胁迫下, 植物通过自身的遗传性和生理、生化等方面的反应, 导致一些代谢相关蛋白以及运输相关蛋白表达量变化, 从而诱导自身产生一些与抗逆相关的蛋白来抵御外界胁迫[5]。非生物胁迫(冷害、高盐, 干旱[6, 7]等), 生物胁迫(真菌、细菌、病毒和昆虫[8, 9, 10, 11], 激素(乙烯和水杨酸等)[12, 13]以及特定的生理发育过程中, 植物TLP基因都被快速诱导表达, 一些转TLP基因植物的抗逆性也显著提高。例如, 冬黑麦叶片质外体在低温诱导下分泌的类甜蛋白, 其抗冻活性与抗冻蛋白相同[14]。干旱和盐胁迫下, 转类甜蛋白基因的烟草植株表现出较强的耐旱耐盐胁迫能力[15]。
从水稻[16]、马铃薯[17]、烟草[18]、荔枝[19]等植物中已分离克隆了类甜蛋白基因。我国北方寒旱区冬寒春旱, 而白菜型冬油菜是该地区唯一能够安全越冬的冬油菜类型, 分离和克隆TLP基因对明确白菜型冬油菜在低温胁迫反应中的响应机制及抗寒机理具有重要意义。本研究应用2-DE技术, 得到低温诱导表达的蛋白-类甜蛋白, 进一步对TLP基因进行克隆和生物信息学分析, 以全面了解该基因在白菜型冬油菜陇油7号中的生物学功能, 为培育新的抗寒品种以及转基因抗寒冬油菜的探究提供理论依据。
以白菜型冬油菜品种陇油7号(超强抗寒)和天油2号(弱抗寒性)为供试材料, 选取籽粒饱满、大小一致的油菜种子, 用10%过氧化氢处理30 min, 无菌水冲洗2~3次, 置铺有两层滤纸的培养皿内催芽(光照14 h, 30° C, 黑暗10 h, 28° C), 待种子露白后, 播于装有育苗基质的花盆(14 cm × 13 cm), 每盆4株幼苗, 于人工培养箱中(光照14 h, 25° C, 黑暗10 h, 20° C)培养至六叶期。选取生长健壮的幼苗进行低温胁迫处理, 先将油菜幼苗于4° C培养4 d, 继而转入-4° C超低温培养箱培养4 d, 最后置-8° C继续培养4 d, 每一低温处理后, 取幼嫩叶片冷冻保存备用, 以未低温处理的植株为对照(CK), 取低温处理及对照叶片提取总蛋白和总RNA。
1.2.1 总蛋白提取与蛋白质浓度测定 采用TCA-丙酮沉淀法[20]提取冬油菜叶片总蛋白, 用Bradford[21]法测定蛋白质浓度。
1.2.2 蛋白质双向电泳 对低温胁迫处理组(4° C)和对照(CK), 使用17 cm的IPG胶条, 按照GE Healthcare双向电泳操作手册说明, 样品上样量为900 μ g, 将样品与水化液按体积比1:4混匀, 总体积不超过500 μ L, 按表1程序进行第一向导电聚焦电泳, 采用12%酰胺凝胶进行第2向SDS-PAGE, 经考马斯亮蓝染色、脱色后通过UMAX的Powerlook 2100XL扫描采集图像, 用PDQuest 8.0分析软件对凝胶图谱标准化处理, 蛋白质点匹配和生物统计, 确定差异表达蛋白点。
| 表1 等电聚焦电泳程序 Table 1 Procedures of isoelectric focusing electrophoresis |
1.2.3 差异蛋白点的质谱鉴定 对差异表达蛋白点回收、酶解[22], 送往上海中科新生命生物科技有限公司进行MALDI-TOF-TOF MS鉴定和数据库检索。
按照天根试剂说明书提取总RNA, 电泳检测后按PrimeScript RT reagent Kit with gDNA Eraser试剂盒(大连TaKaRa公司)说明书进行反转录, 得到单链cDNA, 测定其浓度后, 置-20° C冰箱保存备用。
根据GenBank数据库中已报道的白菜型油菜TLP基因的核苷酸序列, 利用Primer Premier5.0软件设计引物, TLP-F: 5′ -GCTCAAGTGGAGCTCGATCA-3′ , TLP-R: 5′ -A GGATTTTGCATTTCAAGAGTGT-3′ , 按照十字花科首位序列上设计, 可扩增出编码区全序列。以未经低温处理的陇油7号叶片反转录cDNA为模板, 利用引物进行RT-PCR扩增, 扩增程序为以94.0° C 5 min; 94.0° C 30 s, 57.0° C 30 s, 72.0° C 78 s, 循环35次; 72° C 10 min; 4° C保存。反应结束后1%琼脂糖凝胶电泳检测, 利用天根生化科技(北京)有限公司的普通琼脂糖凝DNA纯化回收试剂盒回收目的条带。将回收产物与pMD-19T载体连接, 转化大肠杆菌DH5α 感受态细胞, 过夜培养, 蓝白斑筛选, 挑白斑进行菌液培养。PCR检测菌落后, 随机挑选3个阳性克隆送华大基因股份公司(北京)股份有限公司测序。
利用Protparam工具(http://www.expasy.org/tools/ protparam.html) 分析蛋白质基本理化性质; 采用TMpred Server软件(http://www.ch.embnet.org/software/TMPRED_ form.html) 预测跨膜结构; 利用SignalP4.1 Server (http://www.cbs.dtu.dkrvices/ SignalP/)预测蛋白的信号肽; 利用SOPMA工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_ automat.pl?page=npsa_sopma.html)预测蛋白的二级结构; 采用NCBI中CD-Search工具(http://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi)分析保守结构域; 利用PSORT软件(http://psort.hgc.jp/form.html)预测基因编码蛋白的亚胞定位。
利用Blast从GenBank中挑选了6个来源于十字花科植物的TLP基因编码的蛋白质的氨基酸序列, 依次为甘蓝型油菜(XM_013786360)、甘蓝(XM_013728170)、亚麻荠(XM_010461134)、拟南芥(NM_101683)、荠菜(XM_006303251)、琴叶拟南芥(XM_002892944)、白菜(FJ605478); 利用DNAMAN软件进行多重序列比较和氨基酸同源性分析; 采用MEGA 4.0软件构建系统发生树。
根据白菜型油菜TLP的编码区序列设计定量表达引物TLP-S (5'-GCAACGGGAAACGGGTGTT-3')和TLP-A (5'-AGCGACCTTGAAGATTCTGGAGT-3')。以浓度一致的陇油7号和天油2号叶片cDNA (不同低温处理及对照)为模板, β -actin(Act-F: 5'-TGTGCCAATCTACGAGGGTTT- 3'; Act-R: 5'-TTTCCCGCTCTGCTGTTGT-3')为内参, 进行荧光定量和半定量PCR。半定量RT-PCR采用同机分管扩增内参基因和目的基因, 电泳检测TLP基因对低温胁迫的响应模式, PCR扩增程序同上, 退火温度为60° C。参考SYBR Premix Ex TaqII (TliRNaseH Plus)试剂盒(大连TaKaRa公司)的荧光定量PCR, 采用两步法, 扩增程序为95° C 30 s; 95° C 5 s, 60° C 34 s, 40个循环; 95° C 15 s, 60° C 1 min, 95° C 15 s。96孔上样板目的基因与内参基因对应各3次重复, 操作时避免强光照射。采用2-Δ Δ CT方法计算, 即Δ CT(目的基因)=CT(目的基因)-CT(内参基因); Δ Δ CT(目的基因)=处理组(Δ CT目的基因)-对照组(Δ CT目的基因), 相对表达量(Relative quantification)=2-Δ Δ CT(目的基因)。
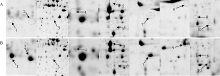
使用PDQuest 8.0软件分析2-DE考染图(图1-A, 图1-B), 进行自动匹配, 并结合肉眼观察及手动调整, 共检测到600多个可重复的蛋白点, 其中新诱导表达蛋白点10个, 植物由正常温度突然转到一个低温环境中, 随着胁迫时间的延长, 植物本身的逆境应答机制会有响应, 一些新的蛋白被诱导表达(图1-B中1-10, 图2), 这表明在正常条件下这些蛋白丰度较低或不表达, 而在低温胁迫下才表达发挥功能, 使植物体内发生一系列生理生化变化, 进而使植物耐受或抵御低温环境的胁迫。
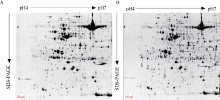 | 图1 陇油7号双向电泳图 A: 对照; B: 4° C处理。Fig. 1 Two-dimensional polyacrylamide gel electrophoresis (2-DE) reference map of Longyou 7 A: control; B: treatment of 4° C. |
切取低温胁迫后诱导表达的10个蛋白点(图1, 点1~点10), 用胰蛋白酶进行胶内酶解, 经MALDI-TOF-TOF MS质谱分析和数据库检索(表2), 最后鉴定出7个蛋白点(表2)。
| 表2 特异蛋白点基质辅助激光解吸电离飞行时间质谱鉴定结果 Table 2 Identification of special proteins by MALDI-TOF-TOF MS |
分别以陇油7号和天油2号cDNA为模板, TLP-F和TLP-R为引物进行RT-PCR扩增, 得到一条900 bp的扩增产物, 回收纯化片段, 连接到T载体后转化, 利用菌液PCR筛选阳性克隆, 得到一条900 bp左右的目的片段, 说明克隆的TLP已插入载体中。将阳性克隆送华大基因(北京)股份有限公司测序得到碱基序列, 全长为732 bp。
利用NCBI的ORF Finder程序寻找开放阅读框, 显示白菜型冬油菜TLP的cDNA序列含有一个长度为732 bp的完整开放ORF, 编码含243个氨基酸的蛋白质, 与其他十字花科基因组数据库TLP编码区序列一致, 起始密码子为 ATG, 终止为密码子为TAA。应用Protparam预测TLP基因编码蛋白质的理化性质, 表明白菜型冬油菜品种陇油7号TLP蛋白由20种氨基酸组成, 其中以Gly、Ser、Ala所占比例最高, 分别为10.7%、9.1%和9.1%; 含有酸性氨基酸(D、E)10个, 碱性氨基酸(K、R) 23个, 疏水氨基酸(A、I、L、F、W、V) 78个, 极性氨基酸(N、C、Q、S、T、Y) 82个, 带电荷的氨基酸(R、K、H、Y、C、D、E) 64个; 相对分子质量约26.022 kD, 理论等电点为9.15; 预测不稳定指数为52.78, 是一个不稳定蛋白(稳定系数> 40时不稳定); 总平均疏水指数(grand average ofhydropathicity, GRAVY)为-0.021, 表明该蛋白为亲水性蛋白(图3)。
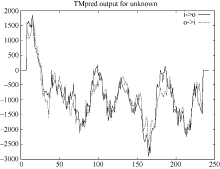
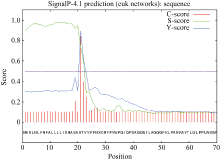
预测显示, 白菜型油菜TLP存在2个跨膜螺旋结构, 1~26位氨基酸为由内向外螺旋, 9~26位氨基酸为由外向内螺旋(图4)。用在线工具SignalP4软件分析陇油7号TLP蛋白的N-末端信号肽序列(图5), 说明该蛋白为一个信号多肽, 第20~第21个氨基酸为最可能的信号肽断裂点。
用在线工具S0PMA对白菜型冬油菜TLP酶蛋白的二级结构进行预测, 结果显示(图6), 该酶蛋白包含12.76% α 螺旋(alpha helix)、45.27%无规则卷曲(random coil)、27.57%延伸链(extended strand)和14.40% β 转角(beta turn)。
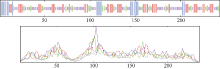
应用NCBI CCD数据库对TLP保守序列进行预测, 发现该酶蛋白属于糖苷水解酶家族64和类甜蛋白特有的保守结构域, 在酶蛋白第22~238位氨基酸之间存在保守结构域(图7), 它们是一种主要参与宿主防御和抵御真菌的酶。
进一步分析TLP蛋白亲缘关系表明(图8), 白菜型油菜与其他十字花科植物TLP酶蛋白的系统进化关系可以大致分为2类。白菜型油菜(Brassica rapa)、甘蓝型油菜(Brassica napus)、甘蓝(Brassica oleracea)和大白菜(Brassica rapasubsp. Pekinensis)为同一亚族, 属于芸薹 属; 拟南芥(Arabidopsis thaliana)和琴叶拟南芥(Arabidopsis lyrata)同属于鼠耳芥属, 亚麻荠(Camelina sativa)、荠菜(Capsella rubella)分别为亚麻荠属和荠属。可见不同植物的TLP系统进化关系具有明显的种属特征。
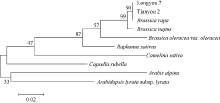 | 图8 陇油7号TLP蛋白与其他相关物种蛋白序列的系统进化树Fig. 8 Phylogenetic tree of TLP proteins in Longyou 7 with other related species |
白菜型冬油菜陇油7号与天油2号的TLP蛋白相似性为98.77%, 与其他十字花科植物蛋白相似性比较结果显示(图9), 该蛋白与甘蓝型油菜(Brassica napus)的TLP蛋白完全相似, 与甘蓝(Brassica oleracea)、亚麻荠(Camelina sativa)、拟南芥(Arabidopsis thaliana)、荠菜(Capsella rubella)、琴叶拟南芥(Arabidopsis lyrata)、白菜(Brassica rapasubsp. Chinensis)的同源蛋白也具有较高的相似性, 达到89%~98%。
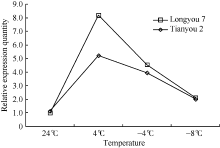
半定量RT-PCR技术分析表明, 温度为 4° C时, TLP基因表达最强, 随着温度继续降低, 该基因表达量逐渐下降(图10)。实时荧光定量PCR分析表明(图11), 低温胁迫下, 陇油7号和天油2号的TLP表达量在4° C明显上调并达峰值, 分别较CK增加了347.6%和92.7%, 随后在-4° C该基因表达量逐渐下降, 分别为CK的74.7%和37.8%, 在-8° C时, 两品种的TLP持续下调表达, 与CK处于同一转录水平。在同处理温度下, 抗寒性弱的天油2号TLP相对表达量低于抗寒性强的陇油7号, 说明TLP在低温胁迫下发挥着重要作用。
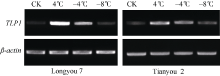 | 图10 低温胁迫下白菜型冬油菜TLP基因的半定量RT-PCR分析Fig. 10 Semi-quantitative RT-PCR analysis of TLP gene in winter Brassica rapaunder low temperature |
类甜蛋白TLP起源古老, 在漫长的进化历程中, 不断发生基因复制事件。因此, 类甜蛋白TLP具有多种生物学功能。本研究从白菜型冬油菜中克隆了TLP基因的cDNA序列, 该基因由732个核苷酸序列组成, 编码243个氨基酸, 属于亲水性蛋白, 拥有完整的阅读框(ORF), 具有GH69-TLP-SF超级家族特有的保守结构区域, 该基因与十字花科的甘蓝型油菜、白菜等氨基酸序列具有极高的相似性, 具有二硫键功能位点, 无规则卷曲和延伸链是该蛋白质二级结构的主要元件, 包丽媛等[23]的研究也得到类似结果。前人的研究发现, TLPs最为重要的结构特征在于其分子中由16个半胱氨酸残基配对形成的8个二硫键, 由于这些二硫键的存在, 使得TLPs具有相对稳定的化学结构, 具有抗酶解和抗酸碱的功能, TLPs分子的三级结构一般由3个结构域构成, 结构域Ⅰ 由1个β 片层(β -sheet)反向平行折叠形成, 再由α 螺旋区域构成, 该结构域具有抗真菌活性[28]。
TLP具有抗冻活性的特性最早发现于寒冷地带的苦茄中, 寒冷条件下可诱导植物体内TLP基因的表达与积累[24], 并可在组织细胞中出现增强的类甜蛋白, 从而增强植物整体抵御冻害的能力。Hiilovaara-Teijo等[25]研究发现, 冬黑麦叶片质外体在低温诱导下分泌的类甜蛋白, 其抗冻活性与抗冻蛋白相同。此外, TLP还具有多种渗调蛋白(Osmotin)和类渗调蛋白(OLP)的特性, 而这2种蛋白都与抗逆功能有关[26]。低温下, 植物的抗冻蛋白和冷诱导蛋白会直接或间接地调节酶或通过信号传导等一系列温度适应来调节植物的抗寒性[29]。
张计育等[4]研究表明, 200 mmol L-1的NaCl和4° C低温处理诱导了MhPR5基因的表达。本研究初期, 利用双向电泳技术筛选出了4° C低温胁迫下响应抗寒机制的关键蛋白-类甜蛋白, 说明TLP基因参与调控冬油菜对非生物胁迫的适应性响应。本研究中, 最初4° C低温处理可增强叶片TLP基因的表达量, 随着胁迫温度的继续降低, 叶片中该基因表达量下降, -8° C时, 表达量与CK处于同一水平。其原因可能是最初的降温导致冬油菜叶片对低温的应激反应, 诱导TLP基因的表达与积累, 而后由于继续零下低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降, TLP基因的表达量急剧下降并与CK处于同一水平。这与实际生产中冬油菜的生长习性相一致(-2° C低温下冬油菜地上部分抗寒能力开始下降, -8° C时进入枯叶期)。以上这些结果表明, TLP基因在冬油菜响应低温胁迫提高自身抗寒性中起着重要作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|