** 同等贡献(Contributed equality to this work)
高分子量谷蛋白亚基(HMW-GS)是小麦籽粒贮藏蛋白的重要成分, 其组成、表达和含量决定面团弹性和加工品质。本研究以 Glu-B1位点上1Bx20和1By20双亚基沉默的小麦无性系变异体AS208为材料, 以AS208的来源亲本轮选987作为对照, 对AS208中 Glu-B1位点的沉默机制和1Bx20、1By20亚基沉默对种子中蛋白体融合以及合成加工相关基因表达的影响进行了研究。Southern blot分析发现AS208比轮选987少2条特异带, 染色体原位杂交(FISH)结果显示轮选987中有6条染色体出现杂交信号, 而在AS208中有4条染色体出现杂交信号, 表明AS208基因组中缺失 Glu-B1位点。透射电镜观察发现, 与轮选987相比, AS208的籽粒蛋白体形成过程, 以及蛋白体大小和形状基本一致。qRT-PCR检测发现, 在12个与籽粒蛋白质合成与加工相关基因中, 有7个的表达模式两品种相似, 有8个的表达量在AS208中高于在轮选987中, 特别是 Bip、 PDI-1和 PDI-5基因(高1.5~2.0倍)。本研究结果表明, 小麦 Glu-B1位点的基因对种子中蛋白体的形成没有明显影响, 但一定程度上刺激了多数蛋白质合成和加工相关基因的表达, 保证了种子内蛋白含量、蛋白体外形和大小基本不变, 表现负反馈调节效应。
High-molecular-weight-glutenin subunits (HMW-GSs) are important components of seed storage proteins in grains of wheat ( Triticum aestivum L.), which determine wheat dough elasticity and processing quality. Using AS208, a wheat somatic variation line with silenced 1Bx20 and 1By20 at Glu-B1 locus, and its originating cultivar Lunxuan 987, we studied the present status of Glu-B1, protein body (PB) formation progress, and expression trends of four kinds of genes ( BiP, Dof, PDI, and SPA) related to glutenin synthesis and accumulation at different stages of grain development. Southern blotting analysis revealed that AS208 had two specific bands less than its control parent Lunxuan 987. The fluorescence in situ hybridization (FISH) assay showed six and four chromosomes with signals in Lunxuan 987 and AS208, respectively. These results indicate that the Glu-B1 locus has been deleted from the genome of AS208. Compared to Lunxuan 987, AS208 showed similar size and shape of seed PB during PB formation under a transmission electron microscope (TEM). A total of 12 transcription-factor or molecular-chaperone genes were subjected to qRT-PCR assay. These genes were related to glutenin coding genes expression, storage proteins accumulation and processing, PB assembling and transportation. Seven out of 12 genes had simialr expression patterns in AS208 and Lunxuan 987, and eight genes were expressed more in AS208 than in Lunxuan 987, especially the expression levels of Bip, PDI-1, and PDI-5 were 1.5-2.0 folds higher in AS208 than in Lunxuan 987. These results suggested that Glu-B1 silencing had no significant effect on the formation of PB during wheat grain development, but partially spurred the expression of some genes regulating the synthesis and processing of seed-storage proteins. As a result, via a negative feedback regulation pathway, the protein content in seed and the shape and size of PB remain in similar levels between AS208 and its originating cultivar.
小麦(Triticum aestivum L.)是全球约35%人口的主食, 其产量关系到粮食安全供给, 品质关系到人类健康营养, 产量和加工品质主要取决于籽粒中蛋白质的组成和含量。小麦籽粒贮藏蛋白的种类和特性对面粉加工品质起决定作用[1], 如麦醇溶蛋白主要影响面团的延展性[2], 麦谷蛋白主要决定面团的弹性[3]。麦谷蛋白分为高分子量麦谷蛋白亚基(high molecular weight glutenin subunit, HMW-GS)和低分子量麦谷蛋白亚基(low molecular weight glutenin subunit, LMW-GS), 分别占胚乳总蛋白含量的10%和40%左右[4]。研究表明, HMW-GS可以解释约三分之二的面包烘烤参数变异[5], 所以HMW-GS一直是小麦加工品质性状研究的热点。
HMW-GS由A1、B1和D1染色体长臂上的Glu-1位点编码, 每个位点包括2个紧密连锁的基因, 分别编码x型和y型HMW-GS [6]。面包小麦理论上应该包含6个HMW-GS, 但由于等位基因沉默, 通常只有3’ 5个HMW-GS基因表达[6]。在大多数小麦品种中, 1BL和1DL上的4个HMW-GS基因都能表达, 而1AL上的2个HMW-GS基因经常沉默。为了在相同遗传背景下准确研究每个HMW-GS亚基对面包加工特性的影响, 利用离子束方法诱导了3个分别缺失Glu-A1、Glu-B1和Glu-D1的品系, 发现缺失系中LMW-GS亚基含量降低, 醇溶蛋白的含量增加, 面筋功能的遗传效应为Glu-D1> Glu-B1> Glu-A1, 证实Glu-1位点的HMW-GS通过促进谷蛋白大聚合体(glutenin macropolymer, GMP)的形成, 保持HMW-GS、LMW-GS和醇溶蛋白之间的平衡, 进而对面筋功能产生影响[7]。Li等[8]用甲基磺酸乙酯(ethyl methane sulfonate, EMS)处理小偃54, 获得了1Ax1、1Bx14、1By15、1Dx2和1Dy12敲除或错义突变的突变体, 发现1Ax1和1Bx14亚基对面团功能和面粉品质的作用有很大差异。利用组织培养也可以诱导小麦贮藏蛋白等位基因的变异[9], 如Glu-B1位点1Bx7和1By9亚基的缺失[10]。
面包加工品质主要由HMW-GS组成和含量决定, 但还受LMW-GS和醇溶蛋白的组成以及与HMW-GS的联合影响。小麦开花授粉后随着储藏蛋白的合成和积累, 寡含半胱氨酸的HMW-GS与富含半胱氨酸的LMW-GS、醇溶蛋白通过分子间和分子内二硫键形成网状大聚合物, 逐步形成更大聚合物并聚集在蛋白体上(protein body, PB) [11]。蛋白体形成涉及到两条不同的途径, 一是醇溶蛋白从高尔基氏复合体沉积到液泡中, 二是谷蛋白通过吞噬作用从内质网沉积到液泡中[12]。蛋白体具有保护储藏蛋白在成熟前被降解的作用。在HMW-GS编码基因表达调控、蛋白质合成、聚合物和PB形成及转运等过程中, 有很多转录因子和分子伴侣发挥重要作用, 主要包括Dof (DNA binding with one finger)、SPA (storage protein activator)、BiP (binding protein)和PDI (protein disulfide isomerase) [13, 14]。Dof是一类植物特有的转录因子, 参与蛋白合成等植物生长发育过程, 调控植物醇溶蛋白基因的转录激活[15]。储藏蛋白激活子SPA属于bZIP类转录因子, 对贮藏蛋白基因转录的启动具有重要作用, 不同SPA等位基因与面团黏弹性和籽粒硬度显著相关[11]; BiP和PDI属于内质网分子伴侣, BiP具有在内质网内腔参与种子贮藏蛋白等分泌蛋白的折叠等功能, PDI参与二硫键的形成、蛋白折叠以及蛋白体在内质网腔的装配等功能[13, 14]。小麦中3个TaBiP基因在籽粒灌浆期的表达模式与HMW-GS基因的表达模式基本一致[16]。PDI基因在花后6~14 d的籽粒中表达量很高, 之后表达水平逐步降低[13]。其中PDIL1-1、PDIL2-1、PDIL4-1和PDIL5-1在籽粒发育早期表达量较高, 可能与储藏蛋白合成有关; 而PDIL7-1和PDIL7-2在后期表达水平较高, 可能与GMP折叠、蛋白体和淀粉颗粒发育有关[17]。
AS208是本课题组从轮选987幼胚培养的后代中选择的无性系变异体, 其Glu-B1位点上的1Bx20和1By20亚基发生了沉默[18]。qRT-PCR分析发现, 在突变体中1Bx20基因没有表达, 因此可以排除转录后基因沉默[19]。AS208的主要农艺性状和籽粒性状, 以及清蛋白、球蛋白、醇溶蛋白和LMW-GS的含量与轮选987没有差别, 但1Bx20和1By20亚基沉默显著影响了AS208的粉质性状和面包品质[18]。AS208中Glu-B1位点基因沉默的机制对小麦籽粒中蛋白体形成和加工相关基因表达等的影响还不清楚。本研究利用基因组Southern blot、染色体原位杂交(FISH)、透射电镜和qRT-PCR技术, 试图解释AS208中Glu-B1沉默的机制, 以及Glu-B1沉默对蛋白体融合过程和蛋白体加工相关基因表达的影响, 为更好解析小麦谷蛋白品质性状形成的分子机制提供有价值的资料。
普通小麦(Triticum aestivum L., AABBDD)轮选987由中国农业科学院作物科学研究所周阳研究员提供; 小麦无性系变异体AS208由本课题组从轮选987的幼胚培养后代中选育, 其Glu-B1位点上的1Bx20和1By20亚基发生了沉默[18]。2013年9月28日将两品种种植于中国农业科学院作物科学研究所中圃场(北京海淀), 开花后连续对两品种未成熟籽粒取样, 花后第5至第23天, 每2 d取样一次, 其中在花后第22、25、26、27和29天分别再取样。样品经液氮速冻后在-80℃冰箱中保存。
用CTAB法[20]从AS208和轮选987叶片中提取基因组DNA, 选择HMW-GS编码基因内部没有的4个限制性内切酶(BamH I、Hind III、Bgl II和Sca I)对基因组DNA进行消化, 然后进行电泳、变性、转膜和预杂交。以PCR扩增的HMW-GS基因1.8 kb的保守序列 (F: 5′ -ACCAGGACAATGGCAACAAT CA-3′ ; R: 5′ -TGTTGCCCTCGTCCTGGTTGTT-3′ )为探针, 利用地高辛标记Southern blotting试剂盒(Roche)检测AS208中HMW-GS基因的存在状态。
室温下在无菌水浸润的滤纸上萌发种子3’ 4 d, 取1.5 cm左右生长旺盛的根尖, 用N2O处理2 h, 加入90%冰醋酸固定10 min。切取根尖生长点加入1%果胶酶和2%纤维素酶的酶解混合液(溶于1× 柠檬酸缓冲液中), 在37℃下酶解54 min。生长点组织用70%酒精清洗后用解剖针捣碎, 离心后弃去酒精, 再加入30’ 50 µ L冰醋酸, 取7 µ L滴在载玻片上制备染色体分裂相。用PCR扩增的HMW-GS基因1.8 kb的保守序列作为探针, 采用切口平移法标记探针, 向载玻片上标记细胞的区域滴加8 µ L探针, 经变性、杂交和染色后显微观察[21], 分析AS208中携带Glu-1位点的染色体。
在小麦籽粒发育过程中涉及到很多转录因子和分子伴侣的表达, 这些基因的表达影响着小麦籽粒储藏蛋白的合成和加工, 进而影响小麦品质。为了明确AS208中1Bx20和1By20基因沉默对小麦种子蛋白合成和加工相关基因表达的影响, 选取了4类转录因子和分子伴侣Dof、SPA、BiP和PDI的12个基因(Dof2、Dof3、Dof6、SPA-A、SPA-B、SPA-D、BiP1、BiP2、BiP3、PDI-1、PDI-4和PDI-5), 分析它们在AS208和轮选987籽粒发育不同时期的转录表达模式。
取-80℃超低温冰箱中保存的小麦未成熟籽粒, 称取每个时间点的样品60 mg。利用TRIzol Reagent试剂盒(Invitrogen, USA), 根据说明书提取总RNA, 利用反转录试剂盒(TaKaRa)合成cDNA。对每品种每样品进行3次qRT-PCR分析, 以ADP作为内参基因(NCBI登录号为AB050957), 13个基因的引物信息见表1。采用SYBR PrimeScript RT-PCR Kit (TaKaRa)进行qRT-PCR分析, 20 μ L反应体系中包括10 μ L 2× SYBR Premix Ex Taq、2 μ L cDNA、0.3 μ L混合引物 (10 μ mol L-1)、0.4 μ L ROX Reference DyeII 和7.3 μ L ddH2O。用ABI PRISM 7500 (ABI, Los Angeles, CA, USA)进行扩增, 扩增程序为95 ° C预变性5 min, 然后95 ° C 5 s, 58~63 ° C 20 s, 72 ° C 20 s, 共40个循环。用Bio-Rad CFX Manager软件分析qRT-PCR结果。
| 表1 小麦籽粒蛋白体加工相关基因表达分析所用引物 Table 1 qRT-PCR primers for expression analysis of the related genes on protein body processing in wheat immature grains |
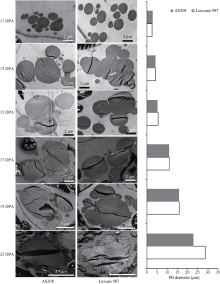
为了明确无性系变异体AS208中1Bx20和1By20缺失对种子蛋白体融合的影响, 利用透射电镜观察AS208开花后不同时间胚乳中蛋白体的融合过程, 并测量蛋白体的直径, 以轮选987未成熟籽粒作为对照。即将小麦胚乳的中间部分切成2 mm厚的薄片, 置2 mL离心管中, 加入多聚甲醛溶液固定液(含4%多聚甲醛和0.5%戊二醛固定液), 超声波处理后放于4℃冰箱过夜固定; 用0.2 mol L-1磷酸缓冲液PBS清洗3次, 每次15 min; 然后依次用30%、50%、70%、80%、85%、90%、95%和100%乙醇梯度脱水各2次, 再用1/3、1/2、2/3树脂溶液4℃过夜渗透, 纯树脂梯度4℃渗透过夜2次; 最后将样品置模具中, 在密闭真空条件下紫外交联聚合2 d, 用LKB-800III型超薄切片机(Sweden)切片, 然后用醋酸铀-柠檬酸铅进行双染色, 于H-7500型透射电镜(Hitachi, Japan)下观察蛋白体形成过程, 测量蛋白体直径。该实验在中国农业科学院农产品加工研究所完成。
分别以AS208和轮选987基因组DNA为模板, 用4种限制性内切酶酶切, 并利用HMW-GS基因作为探针进行Southern blot分析, 结果两品种的Southern blot杂交条带有明显差异。AS208经BamH I、Hind III和BglII酶切后分别比轮选987少2、1和1条带(图1); 而ScaI酶切后, 虽然在两品种中都显示特异带的存在, 但轮选987中的第2条带明显比AS208深(图1), 可能出现了2条杂交带的重叠现象。Southern blot证据表明, AS208中1Bx20和1By20亚基沉默由Glu位点丢失导致。
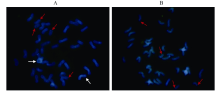
FISH结果显示, 轮选987中有3对染色体出现了杂交信号, 分别在1A、1B和1D染色体上(图2-A); 而AS208中只有1A和1D染色体上出现了杂交信号, 1B染色体上没有检测到杂交信号(图2-B)。
FISH和Southern blot分析一致表明, AS208的1B染色体上丢失了Glu-B1位点。这一结果直接印证了AS208丢失Glu-B1位点的推测[18]。
利用透射电镜观察两个品种胚乳中蛋白体在花后籽粒不同发育阶段的融合过程, 发现AS208和轮选987的蛋白体融合过程基本一致, 花后第11天蛋白体开始聚合, 花后13~15 d观察到明显的融合现象, AS208和轮选987蛋白体直径分别从2.8 μ m和2.6 μ m增加到5.2 μ m和5.6 μ m, 呈圆球形状; 花后第17天, 两品种的蛋白体直径都增大到10 μ m以上, 呈椭圆球状, 花后第19天时分别达15.8 μ m和15.9 μ m; 花后第23天时整个胚乳细胞内的蛋白体融合过程基本完成, 几乎看不到圆球和椭圆球状的蛋白单体, 细胞内蛋白体呈现片状或块状(图3)。由此可见, AS208缺失2个HMW-GS没有显著影响胚乳内蛋白体的融合。
3个Dof基因在AS208和轮选987中的表达模式近似倒U形。具体而言, AS208中Dof2的表达模式呈典型的倒U形, 籽粒发育第15天时表达水平最高, 而轮选987中该基因一直处于较高的表达水平, 直到花后第19天才出现明显的下降趋势; 两品种Dof3基因的表达模式基本一致, 即前期较低, 花后第22天达到高峰, 之后呈下降趋势, 但AS208下降较轮选987缓慢; Dof6基因在两品种中表达趋势相近, 其中在AS208中的表达量呈典型的Λ 字型, 在花后第15天时的表达量是轮选987中的2倍(图4)。
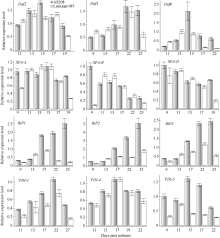 | 图4 Dof、SPA、BiP和PDI基因在AS208和轮选987籽粒不同发育时期的表达模式Fig. 4 Expression patterns of Dof, SPA, BiP, and PDI in AS208 and Lunxuan 987 during seed development |
3个SPA基因在两品种中的表达模式基本呈递降趋势, SPA-B和SPA-D尤为明显, 它们在AS208中的表达在开花后第9天就达到较高水平, 而此时在轮选987中的表达水平还比较低, 直到花后第11天时才达到较高水平, 随后逐渐下降; SPA-A在籽粒发育不同时期的表达水平一直较高, 表达量变化不大, 花后17~19 d表达量没有显著下降, 而轮选987中SPA-A在花后第19天的表达水平已经明显下降。此外, SPA-D在AS208中的表达水平较在轮选987中下降慢, 花后第19天时在AS208中还维持较高水平, 而在轮选987中已经显著下降(图4)。
3个BiP基因的表达模式在AS208中都呈阶梯上升模式, 开花后的前13 d均处于较低的表达水平, 17 d后开始上升, 25 d时达到最高表达水平; 在轮选987中这3个基因的表达水平比AS208中低1.5~2.0倍, 开花后17 d后尤为明显。3个PDI基因的表达模式在AS208和轮选987中大体呈现倒U形。在表达水平方面, PDI-4基因在AS208和轮选987中基本相近, 而AS208中PDI-1和PDI-5基因总体明显高于轮选987, 特别是开花 15 d和17 d时PDI-5基因的表达量在2个材料中相差约1.0~1.5倍(图4)。
小麦中存在3个编码HMW-GS的位点, 即Glu-A1、Glu-B1和Glu-D1, 分别位于1A、1B和1D染色体长臂上。小麦无性系变异体AS208是本课题组从轮选987的幼胚培养后代中鉴定的, 发现其Glu-B1位点紧密连锁的1Bx20和1By20基因没有表达。通过设计特异PCR引物, 没有从AS208中扩增到1Bx20和1By20基因的编码序列和调控序列, 而轮选987中能扩增出这2个基因的编码序列和调控序列, 推测Glu-B1位点在AS208中发生了丢失[18]。一般认为, 分子杂交可检测到与探针序列相似度高于70%的信号, HMW-GS基因高度保守、序列相似度很高, 符合分子杂交检测的范围, 因此利用HMW-GS基因的随机扩增产物就可以与基因组中所有的HMW-GS基因杂交, 从而检测到杂交信号。本研究进一步利用HMW-GS基因的保守序列作为探针, 对AS208进行了Southern blot分析和染色体FISH鉴定, 证明AS208中确实丢失了1Bx20和1By20基因的Glu-B1位点。Glu-B1位点的缺失在一定程度影响了小麦籽粒中贮藏蛋白的合成和加工。
小麦贮藏蛋白主要在内质网(ER)中合成、折叠, 然后贮存在PB中[22]。ER的一个重要功能是通过分子伴侣PDI和BiP的作用保证新合成蛋白质的质量。BiP作为ER的一个重要分子伴侣在蛋白合成、折叠和组装中起重要作用[23]。玉米、水稻、拟南芥、南瓜和其他植物中的BiP基因具有高度保守性, 尤其是在一些亲缘关系比较相近的物种中[24]。研究证明, BiP参与高分子量贮藏蛋白合成和应激反应[25], 它在多聚核糖体中参与形成醇溶蛋白初期链的配合物, 使醇溶蛋白保留在内腔中, 并促进他们折叠和组装到PB上[26]。各种环境因素能够引起ER的应激反应, 包括温度、光强、干旱、盐胁迫等, BiP的表达与ER的应激反应密切相关。例如, 光强度的改变能够引起拟南芥特殊组织中BiP表达水平发生改变, 进而调节分泌蛋白的积累水平[27]。利用等位特异PCR (allele-specific PCR, AS-PCR), Johnson和Bhave[28]将小麦中的BiP基因定位在6AS、6BS和6DS染色体上。Zhu等[16]从小麦中克隆了BiP的3个同源基因, 发现它们的表达水平与HMW-GS合成和耐旱性密切相关, 其表达产物TaBiP主要分布在蛋白体上; 3个TaBiP基因随着HMW-GS亚基表达的终止表现为明显的下调表达模式, 但干旱胁迫诱导该基因上调表达; TaBiP基因在小麦根、茎、叶和籽粒中都有表达, 但在籽粒中表达量最高。
PDI基因家族编码许多蛋白二硫键异构酶和类似蛋白二硫键异构酶的蛋白, 它们包含硫氧还蛋白结构域, 使其可以参与二硫键的形成、蛋白折叠和蛋白体的装配[13, 14]。发现大部分PDI家族主要定位在ER上, 也在其他亚细胞中检测到PDI, 但PDI在这些位置的功能还不清楚[29]。小麦中PDI基因存在3个拷贝, 分别位于4AL、4BS和4DS染色体上[13]。D’ Aloisio等[14]获得了9个PDI和PDI类似序列, 将PDI家族分为8个类群, 即PDIL1-1、PDIL2-1、PDIL3-1、PDIL4-1、PDIL5-1、PDIL6-1、PDIL7-1、PDIL7-2和PDIL8-1。其中, PDIL1-1是小麦中典型的PDI, 与PDIL2-1一起参与调节贮藏蛋白、蛋白体的形成和淀粉合成。高粱中的PDI家族I、II、IV和V与贮藏蛋白折叠有关[30], 这4类家族与小麦中PDIL1-1、PDIL2-1、PDIL4-1和PDIL5-1同源, 推测这4类PDI家族也参与了贮藏蛋白折叠。另外, PDIL2-1也和叶片组织中的淀粉合成有关, PDIL4-1参与种子的建成和胚珠发育。小麦开花授粉6~14 d, PDI基因在发育的籽粒中组成型高表达, 18~34 d表达量逐步降低, 并滞留在内质网中介导二硫键的形成[13]。Wang等[17]发现, 在小麦籽粒发育早期高表达的PDIL1-1、PDIL2-1、PDIL4-1和PDIL5-1, 以及后期高表达的PDIL7-1和PDIL7-2可促进GMP的正确折叠, 同时也参与调节蛋白体和淀粉颗粒发育。在短柄草中, PDI基因在不同器官中都表达, 但不同PDI基因在不同器官中的表达量不同, BdPDIL1-1和BdPDIL5-1在发育籽粒中的表达尤其丰富, 说明这2个基因对种子储藏蛋白的合成和积累非常重要[31]。
Dof是植物所特有的一类转录因子, 在植物生长发育过程中起着重要作用。它含有一个独特的Cys残基的单锌指保守结构域, 命名为Dof结构域[32]。与其他锌指蛋白一样, Dof蛋白也是一个双功能结构域。它不仅可以与植物基因启动子DNA结合, 而且还具有蛋白与蛋白相互作用的功能。Dof蛋白首次被提出只是作为一个与DNA结合的蛋白, 但后来发现它可以与其他蛋白相互作用[32]。目前, 在多种植物中发现了Dof蛋白, 它们在高等植物基因表达调控中参与醇溶蛋白基因的转录激活[15]。水稻的Dof转录因子家族包括30个Dof基因, 定名为OsDof-1至OsDof-30, 分为4个亚家族(a、b、c和d亚家族)。拟南芥Dof转录因子家族包括37个基因; 体内和体外试验结果表明, Dof蛋白中的Dof结构域与不同植物基因启动子的DNA结合具有特异性[33]。到目前为止, 除在南瓜中发现Dof蛋白AOBP (ascorbate oxidase binding protein)特异识别AGTA序列外, 其他的Dof蛋白都只识别AAAG或它的互补序列CTTT基序作为核心序列元件[34]。
贮藏蛋白激活因子SPA属于bZIP类转录因子, 对贮藏蛋白基因的转录启动具有重要调控作用。Guillaumie 等[35]发现在Glu-B1x位点有2个位于1BL染色体上的候选基因, 分别是SPA和Glu-B1-1, 并证明SPA参与HMW-GS的合成, 同时也参与激活LMW-GS基因的转录。对六倍体小麦中的3个具有部分同源性的SPA基因进行序列多态性分析, 发现启动区域多态性较高, 拷贝数分别为9个、7个和6个, 导致了基因内的连锁不平衡; 但小麦SPA的氨基酸序列高度保守, SPA等位基因与面团黏弹性和籽粒硬度显著相关[11]。研究还发现, SPA-A等位变异对小麦籽粒中醇溶蛋白的分配有重要影响, 并且影响醇溶蛋白和麦谷蛋白的比率[36]。
本研究通过透射电镜观察, 发现在缺失了1Bx20和1By20的AS208籽粒中, 蛋白体直径及其变化过程与对照品种轮选987非常一致(图3)。这一现象的原因可能是, AS208中2个HMW-GS亚基1Bx20和1By20的沉默可能刺激了其他贮藏蛋白基因的表达与分泌, 即通过其他贮藏蛋白的替代/互补作用, 保证了胚乳中蛋白体的融合。AS208中籽粒蛋白总量略高于轮选987是这一假设的有力佐证[18]。同时我们发现, Dof2、Dof3、Dof6、SPA-A、Bip2、PDI-1和PDI-4的表达模式在两品种中基本一致, 但是除Dof2、SPA-A、SPA-D和PDI-4外, 其他基因在AS208中的表达量都比在轮选987中高(图4)。结合透射电镜观察结果, 我们认为AS208中2个HMW-GS基因沉默没有影响种子内蛋白体的形成与融合(图3), 可能是因为其中2个HMW-GS基因沉默刺激了上述4类转录因子和分子伴侣在籽粒灌浆期的表达, 即通过其他贮藏蛋白的替代/互补作用, 保证了种子内蛋白含量、蛋白体外形和大小基本不变, 表现为负反馈调节效应。
AS208中1Bx20、1By20亚基的沉默由于组织培养过程中Glu-B1位点的丢失导致, Southern blot和FISH技术可用于鉴定小麦基因组中拷贝数较少的内源基因。与籽粒蛋白质合成与加工相关的12个基因在小麦籽粒灌浆过程中, 7个表达模式在AS208和轮选987中一致, 8个表达水平在AS208中比轮选987高, 表明小麦Glu-B1位点的基因缺失对种子中蛋白体的形成没有明显影响, 但促进了储藏蛋白合成与加工相关基因的表达。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|