变化及对萌芽的影响
变化及对萌芽的影响
为探明油菜素内酯BR在块茎萌芽中的作用, 建立更有效的种薯催芽调控体系, 选择了休眠期不同的3个品种, 利用qRT-PCR分析与BR合成、信号转导、调控有关的9个基因在贮藏期间及抑芽处理下的表达模式; 同时检测BR类似物24-表油菜素内酯(24-eBL)及其与赤霉素GA3对块茎萌芽的影响。结果表明, 涉及BR合成的4个基因表达量均随贮藏时间延长升高, 短休眠品种升高的时间点早于中、长休眠品种; 信号转导及调控基因中 BRI1和 CYCD3的变化与合成基因相似, BSK和 TCH4的表达量则在中、长休眠期品种中保持恒定。抑芽处理在贮藏前期能刺激这些基因的表达升高, 但之后都迅速下降并保持低水平。转录因子 BZR1在各品种中以及抑芽处理下均没有明显变化。24-eBL利于块茎解除休眠, 但不促进芽的伸长生长, 与GA3互配效果更佳, 单株块茎增重37.92%~98.41%。结论表明, BR合成和信号转导是块茎从休眠向萌芽转变的必经生理过程, 它与GA3互配用于催芽更利于种薯萌芽的整齐、健壮并促进块茎形成。
To explore the role of brassinosteroid (BR) in tuber sprouting and establish effective sprouting regulation system for seed potato, three varieties and sprouting-inhibitor treatments were used to analyze expression characteristics of nine genes related to BR synthesis, signal transduction and regulation during storage. Effects of BR analogue 24-epibrassinolide (24-eBL) and gibberellin (GA3) on tuber sprouting were also studied. The transcript levels of four genes involved in BR synthesis increased with prolonging storage time, and the time points at which the expression levels began to increase in variety with short dormancy period were earlier than those in varieties with middle or long dormancy period. The expression patterns of BRI1 and CYCD3 were similar to those of synthetic genes while BSK and TCH4 remained constant in varieties with middle or long dormancy period. Sprouting-inhibitors stimulated transcripts of those genes to elevate in the earlier stage of storage, then rapidly decline and stay low levels. There was no significant expression change of transcription factor BZR1 in varieties and sprouting-inhibitor treatments during storage. BR analogue 24-eBL was favorable to tuber dormancy release but shoot growth. The tuber weight per plant treated with 24-eBL and GA3 mixture increased by 37.92% to 98.41% compared with CK. The conclusion, BR synthesis and its signal transduction are essential physiological processes from dormancy to sprouting in potato tuber. Mixture of 24-eBL and GA3 can facilitate uniformity of seed potato sprouting, stronger growth and better tuberization.
马铃薯(Solanum tuberosum L.)具有稳产高产、生育期短、适应性强等特点, 是我国第四大粮食作物之一。马铃薯通常以块茎无性繁殖, 块茎具休眠期, 且不同基因型间的休眠期存在较大差异, 同时受种植季节等环境因素影响[1, 2]。处于休眠期的种薯播种后出苗不齐或烂薯, 发芽过久的老化种薯则导致减产10%~30%[3], 所以种薯在播种前能整齐萌芽, 达到最佳生理状态, 是保证产量的关键, 特别是在春、秋、冬三季能够种植马铃薯的西南地区, 其对种薯萌芽时间的要求更为灵活。
内源激素是调控块茎从休眠向萌芽状态转变的重要物质, 各激素间存在复杂互作。Aksenova等[4]认为脱落酸(ABA)、乙烯(Eth)、油菜素内酯(BR)促进块茎休眠, 生长素、细胞分裂素(CTK)和赤霉素(GA)解除休眠促进萌芽, CTK和GA促进芽生长, 其中GA3是生产上常用的马铃薯种薯催芽剂。Hartmann等[5]通过转基因技术降低马铃薯的CTK含量能延长块茎休眠并且对外源施加GA3无反应, 证实两者对解除块茎休眠同等重要并相互影响。Korableva等[6]用人工合成的BR类似物24-表油菜素内酯(24-epibrassinolide, 24-eBL)约21 nmol L-1处理块茎可延迟萌芽36~38 d, 增加乙烯形成及ABA的含量, 使分生组织各细胞体积缩小, 并增加液泡数目, 认为BR促进休眠。
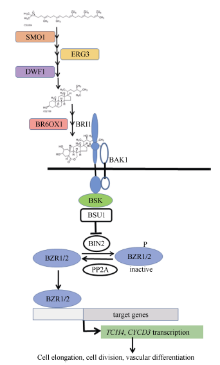
BR是一类甾醇类植物激素, 参与调控多种生理过程, 如气孔形成、植株形态建成、开花、维管束发育、种子萌发, 外源BR能提高胁迫抗性[7, 8, 9]。对拟南芥和水稻BR的合成和信号转导过程已有较为深入的研究。BR合成酶基因的缺失突变体大多矮化、生长缓慢, 如Δ (7)-甾醇-5-脱氢酶(delta (7)- sterol-c5(6)-desaturase, SC5DL或STE1或ERG3)、Δ 24-甾醇还原酶1 (delta24-sterol reductase, DWF1)、BR-6-氧化酶1/2 (brassinosteroid-6-oxidase1/2, BR6OX1/2或cytochrome, P45085A1/2 CYP85A1/2)的突变体[10, 11, 12]。如图1所示, BR受体为BRI1 (protein brassinosteroid insensitive 1), 此外还有共受体BAK1及其同源蛋白SERKs家族, 在这些共受体的配合下, BRI1感知BR信号, 并激活激酶BSK (BR-signaling kinase)来启动信号转导过程, 通过一系列磷酸化和去磷酸化激活细胞核内的转录因子, 活化的转录因子BZR1/2可促进与细胞分裂及生长相关的基因表达, 而在调节叶片角度方面, 活化的转录因子LIC则对BZR1/2起拮抗作用[13, 14, 15]。CYCD3编码细胞周期蛋白(D-type cyclin family 3)参与细胞分裂调控, 基因TCH4编码木葡聚糖糖基转移酶(xyloglucan endotransglycosylase, XTH)能松弛细胞壁使细胞得以伸长, 已知这2个基因都受BR信号激活表达[16, 17]。
前期分析休眠和萌芽块茎的基因表达谱, 发现BR合成及信号转导途径中的大多数基因表达量在萌芽块茎中显著升高, 这与Korableva认为BR促进块茎休眠的结论不同[6]。同时, 生产上常用的催芽剂GA3存在对中、长休眠期品种的催芽效果弱且处理浓度和时间不易掌控, 造成芽细弱等问题。为进一步确认BR在块茎休眠、萌芽中的作用, 评价其调节种薯萌芽的潜力, 寻找更为有效的催芽方法。本研究选择休眠期不同的3个品种为材料, 以qRT-PCR检测与BR合成和信号转导相关的9个基因的表达量在块茎贮藏期间以及抑芽物质处理下的变化特点。这9个基因分别是与BR合成相关的SMO1、ERG3、DWF1、BR6OX1, BR信号转导成员BRI1、BSK、BZR1, 信号激活的基因TCH4、CYCD3(图1中的实心框)。同时, 比较24-eBL及其与GA3配合处理对块茎萌芽和后期生长的影响。
短休眠期品种费乌瑞它(Favorita, FR)、中等休眠期品种米拉(Mira, MR)、长休眠期品种坝薯10号(Bashu 10, BS)的脱毒薯, 由四川农业大学农学院马铃薯研究开发中心提供。
TRIzol、焦碳酸二乙酯(DEPC)购自Invitrogen, 反转录试剂盒RevertAid First Strand cDNA Synthesis购自Thermo, 引物及荧光染料SGExcel FastSYBR Mixture购自上海生工。24-eBL、油菜素内酯专一性抑制剂芸苔吡咯(Brassinazole, BRZ)购自Sigma- Aldrich。其他常规试剂如氯仿、乙醇、赤霉素(GA3)等购自成都科龙化工试剂厂。
分别挑选3个品种的新收原原种(约7~10 g 粒-1), 常温下愈伤化14 d后装入密封硬纸盒贮藏, 每盒约80~100粒, 各5盒。另选费乌瑞它, 装盒后加入前期项目组筛选的挥发性抑芽物质A和B处理。在(23± 2)℃室内贮藏以上样品。另选费乌瑞它放于4℃冷库贮藏。取样时间如表1所示, 在萌芽(芽长2~3 mm, 块茎解除休眠)时间点取样后即结束该品种的贮藏, 3个品种约在49、70和98 d结束贮藏。以顶部芽眼为中心, 用直径3 mm, 高5 mm圆管打孔取圆柱体, 用液氮速冻后保存于-80℃用于RNA提取。
| 表1 各处理在贮藏期间的取样时间 Table 1 Sampling time for different treatments during storage |
用TRIzol法提取RNA并用低浓度乙醇、高盐、冻融等方式去除多糖。将RNA反转录成cDNA, 在20 μ L体系中依次加入Oligo dT 1 μ L、RNA 3 μ L、DEPC处理水8 μ L, 65℃ 5 min, 冰上急冷2 min; 再按序加入5× 反应缓冲液4 μ L、RNase抑制剂 (20 U μ L-1) 1 μ L、10 mmol L-1 dNTPs混合物2 μ L、Reverse Transcriptase ( 200 U μ L-1) 1 μ L。42℃ 60 min, 72℃ 10 min终止反应。参考http://solanaceae.plantbiology. msu.edu/cgi-bin/annotation_report.cgi基因序列, 利用Oligo 6.0软件设计各基因的特异性引物(表2)。根据基因表达谱, 选择表达量在休眠、萌芽和抑芽3种状态下都稳定的基因EF1α L作内参。
荧光定量PCR体系25 µ L, 含RNase-Free ddH2O 10.5 µ L、2× SGExcel FastSYBR混合物12.5 µ L、上下游引物各0.5 µ L、cDNA 1.0 µ L。反应程序为95℃ 20 s; 40循环, 95℃ 3 s, 退火/延伸58~60℃ 30 s。熔解曲线分析为95℃ 10 s, 65℃ 5 s, 95℃ 5 s。Bio-Rad CFX Connect荧光定量PCR仪检测, 采用2-Δ Δ Ct法计算相对表达量[18], 以贮藏0 d时费乌瑞它的Δ Ct值为对照。将3次试验重复所提的3管RNA混合后反转录所得cDNA作3次荧光定量技术重复。由于一些基因的相对表达量在品种间的变化幅度大(如0.10~229.11), 为同时反映低数值间的高幅度变化, 在品种间比较时将相对表达量换算成以10为底的对数值, 以体现贮藏初、中期表达量数值低时的变化趋势。
| 表2 用于qRT-PCR检测的基因引物序列 Table 2 Primer sequences of genes for qRT-PCR test |
以费乌瑞它原原种的芽眼为中心, 取直径4 mm, 高5 mm的圆柱体, 分别用500 nmol L-1 24-eBL、60 μ mol L-1 GA3、24-eBL+GA3、100 μ mol L-1 BRZ+GA3浸泡20 min, 以蒸馏水为对照, 放入培养皿中于黑暗(22± 2)℃下离体保湿培养3 d后在体视镜下观察萌动情况。
取费乌瑞它、米拉的原原种和费乌瑞它的原种, 用GA3、24-eBL和24-eBL+GA3浸泡种薯, 浓度同1.4, 每处理3盒, 在(23± 2)℃下放置, 统计发芽率、芽长、芽直径。待对照芽长约2~5 mm时将薯块露天盆栽, 生育期为9月初至12月初, 测定单株结薯重量。另取费乌瑞它原原种用相同溶液浸泡后于(10± 2)℃黑暗贮藏60 d, 散射光下放置约10 d, 比较芽的萌发情况。
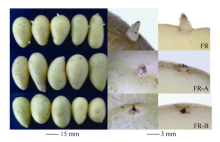
3个品种的休眠期明显不同, 费乌瑞它在50 d时有70%左右薯块萌芽, 多数芽长为1~3 mm, 而此时另2个品种没有萌动迹象。70 d时费乌瑞它芽长已有7~8 mm, 米拉可见明显的芽萌发, 坝薯10号部分薯块的芽眼开始露白(图2)。
如图3所示, 4个基因的表达量在品种间的变化趋势一致, 均随时间升高, 只是升高的时间点和幅度不同。短休眠品种费乌瑞它在7 d时就开始升高, 21 d时非常明显, 为0 d的3~7倍。中、长休眠品种米拉和坝薯10号的这4个基因表达量直到49 d 时才开始有2~5倍的小幅上升。费乌瑞它的这4个基因表达量在萌芽时(49 d)均达到最高, 米拉和坝薯10号则在63 d后才大幅上升。推测BR合成与块茎由休眠状态向萌芽转变密切相关, 中、长休眠品种的BR合成明显晚于短休眠品种。
 | 图3 在3个品种中基因表达量随贮藏时间的变化模式Fig. 3 Gene expression patterns in three varieties during storage FR: 费乌瑞它; MR: 米拉; BS: 坝薯10号。FR: Favorita; MR: Mira; BS: Bashu 10. |
同时可以看出参与BR前体物质菜油甾醇(Campesterol)合成的基因SMO1、ERG3和DWF1变化模式相似。费乌瑞它和坝薯10号萌芽前, 3个基因的表达均存在平台期或小幅下滑, 到萌芽时又迅速升高; 而米拉则是在萌芽前达到最高, 到萌芽时反而略有下降。参与BR合成最后几步反应的BR6OX1在米拉中的相对表达水平明显低于另2个品种, 由此推测米拉萌芽所需的BR水平可能低于另2个品种, 所以即使坝薯10号的基因转录升高的时间点略早于米拉, 但萌芽时间仍晚于米拉。
信号转导及调控的5个基因中, BRI1和CYCD3在品种间均呈升高的趋势, 而BSK和TCH4在费乌瑞它中变幅大, 在另2个品种中变化小(图4)。BRI1在费乌瑞它和坝薯10号萌芽前有小幅下滑, 短休眠品种的转录本积累早于中、长休眠品种, 这同BR合成基因的变化相似; 并且BRI1从初始到萌芽升高倍数在品种间相似。BSK变化具有很强的品种特异性, 在费乌瑞它中呈线性升高, 萌芽时为初始的70倍; 而另2个品种的转录本在整个贮藏期间均保持较恒定水平。贮藏期间BZR1在3个品种中的变化均较小, 费乌瑞它萌芽与初始相比也仅提高2倍(图未列出)。可能该转录因子已存在于分生组织中, 只是处于非活性状态, 合成BR后通过信号转导让其活化进而调控下游基因表达。
 | 图4 BR信号转导和调控基因在贮藏期间的表达变化Fig. 4 Expression characteristics of genes involved in BR signal transduction and regulation during storage |
TCH4表达变化的规律性差, 在费乌瑞它中呈N字型, 在米拉和坝薯10号中表达量低, 除萌芽前有明显下降, 其余时间保持恒定水平。贮藏21 d前, 费乌瑞它的CYCD3低于米拉和坝薯10号, 但之后三者的表达量呈近乎一致的升高, 在费乌瑞它萌芽后, 米拉和坝薯10号的表达量继续上升, 但费乌瑞它的升幅最大, 为59倍。
如图5所示, 贮藏50 d时CK有1~3 mm完整小芽, 处理A使芽畸形, 且顶端有坏死, 处理B的芽组织此时已完全坏死, 即抑芽物质B的抑芽能力明显强于A。图6列出了4种典型的基因表达变化模式, SMO1在早期便受物质A刺激, 到7 d时达到最高值并高于同期CK值, 之后一直处于低水平; 抑芽能力更强的物质B处理则使该基因的转录本在整个贮藏期间都保持极低水平(0.16~1.70)。其他3个涉及BR合成的基因表达模式与之相似。
 | 图6 抑芽物质对基因表达的影响Fig. 6 Effects of sprouting-inhibitors on gene expression during storage FR: 马铃薯品种费乌瑞它; A和B为不同的抑芽物质。 FR: potato variety Favorita; A and B represent different sprouting-inhibitor. |
BRI1和BSK变化相似, 在贮藏早期均受2种抑芽物质的诱导, 在7 d或21 d达到最高值, 并高于同期CK, 之后下降并一直处于低水平, 远低于同期CK。物质A处理极大地刺激TCH4表达, 在整个贮藏期间都高于CK, 甚至70 d时仍高于CK萌芽时的表达量; B处理则在7 d时达到最高, 为同期CK的7倍, 之后一直处于低水平。物质A处理似乎对CYCD3的转录影响较小, 它的表达量在各时间点与CK的几乎一致, 只是在70 d时显著下降到49 d的27.66%, 这与该处理能观察到畸形芽形成, 但后期死亡的情况相符; 物质B刺激该基因表达升高, 在21 d最大, 是同期CK的3倍, 之后迅速下降并维持在低水平。与BR合成基因的表达一直受到物质B较强的抑制作用不同, 信号转导和响应基因的表达被刺激升高, 且升高的时间点早于物质A处理; 同时, 下游响应基因受2种物质刺激升高的倍数远大于合成和信号转导基因。除BZR1外, 其余基因的表达在4℃低温下明显受抑, 49 d时表达量只有同期CK的0.64%~13.73%。BZR1的表达量在各抑芽处理下仍然没有明显变化。
上述结果表明BR合成、信号转导及调控活动在块茎从休眠到萌芽过程中呈增强趋势, 抑芽处理在贮藏中、后期显著抑制这些生理过程, 那么外源BR对块茎萌芽是否有促进作用?试验用24-eBL处理不同品种、不同级别的种薯, 以探明BR在块茎萌芽中的作用及其对植株后续生长的影响。
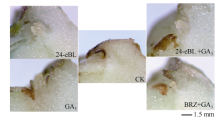
2.4.1 对块茎离体芽眼部位萌芽的影响 在预试验中用5、50、500、5000 nmol L-1 24-eBL处理薯块, 发现5 nmol L-1对块茎休眠影响不大, 而50 nmol L-1和500 nmol L-1均有促进块茎解除休眠的作用, 并且后者的效果和整齐度更好, 而5000 nmol L-1可能因浓度过高造成内源BR的代谢紊乱而表现出抑制作用, 所以本试验选择500 nmol L-1。离体培养费乌瑞它的芽眼部位, 3 d后如图7, 24-eBL和GA3都能解除芽眼部位的休眠状态, 促进萌芽。在GA3中添加BRZ则减弱了前者促芽生长的作用。24-eBL和GA3配合处理在此时看不到与单独使用时的差异。
2.4.2 对块茎萌芽和芽生长的影响 表3列出在(23± 2)℃贮藏, 费乌瑞它原原种的发芽率、芽长和直径在各自差异最明显时期的对比。各处理都能促进块茎解除休眠, 在35 d时的发芽率均极显著高于CK, 24-eBL+GA3配合处理的效率最高。GA3不仅利于解除休眠还促进芽生长, 55 d时长度约为CK的5倍, 但CK和GA3均有芽长不整齐的问题。24-eBL处理的长度与CK相似, 但表现更整齐, 对比发芽率和芽长可以看出24-eBL虽促进休眠解除但不支持芽的伸长生长。24-eBL+GA3的芽长介于单独处理之间, 芽最为健壮, 整齐性较好。
| 表3 各处理的原原种发芽情况对比 Table 3 Sprouting comparison of pre-basic seed potato in different treatments |
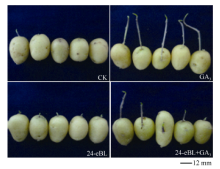
在(10± 2)℃贮藏60 d后于散射光下放置10 d, 也得到了与上述相似的结果, 且芽长和整齐度对比更为明显(图8)。CK有72.97%的薯块发芽, 但芽长不整齐。24-eBL使所有薯块解除休眠, 84.61%的芽长在5 mm左右, 生长整齐。GA3处理芽细长, 超过40 mm。24-eBL+GA3的芽长仍然介于单独处理之间。
2.4.3 对植株生长和产量的影响 无论是费乌瑞它不同级别的种薯, 还是同一级别费乌瑞它和米拉2个品种, 各处理均使结薯提前。图9所示为米拉原原种植株的生长情况, 可看到各处理均有匍匐茎和其顶端膨大形成的薯块, 而CK还未形成匍匐茎或匍匐茎还未膨大结薯。各处理的结薯情况与其芽健壮程度密切相关, 24-eBL+GA3处理的芽最为健壮, 其植株长势和结薯也最佳; GA3处理的植株地上部虽然比24-eBL的茂盛, 但结薯整齐性不如后者; CK萌芽时间和芽长不整齐, 植株间的差异也非常明显。各处理单株薯块重量均高于CK, 在不同级别和不同品种中24-eBL+GA3的薯块重量均最高, 相对于CK分别高75.20%、37.92%和98.41% (表4)。结薯增幅如此明显除有激素处理影响块茎形成外, 可能也与CK出苗晚结薯迟, 而秋季生长季节偏短有关。24-eBL的产量与GA3的差异不显著, 但各单株产量的整齐度高于GA3。
 | 图9 盆栽60 d的植株形态比较Fig. 9 Comparison of plant morphology after planting 60 days 箭头示匍匐茎顶端形成的膨大块茎。 Arrows show enlarging tuber on the top of stolon. |
| 表4 不同品种和级别的种薯收获的单株薯块重量比较 Table 4 Comparison of tuber weight per plant in different varieties and levels of potato seeds (g) |
研究表明BR参与多种生理过程特别是生长发育, 拟南芥ERG3缺失突变体矮化, 转入酵母的ERG3基因能使其恢复生长[19]。Δ 24-甾醇还原酶(DWF1)催化合成BR前体油菜甾醇, 是BR合成中的关键酶, 拟南芥中其编码基因突变体dwarf1的BR含量降低且植株矮化[11]。BR6OX (亦写作CYP85A)催化合成BR, 拟南芥的CYP85A1和CYP85A2双突变体表现出矮化表型[12]。本试验中参与BR合成的4个基因StSMO1、StERG3、StDWF1和StBR6OX1表达量均随贮藏时间延长而升高, 抑制它们表达造成块茎萌芽受阻, 说明BR是块茎解除休眠和萌芽所必需的信号物质。信号转导及调控基因中BRI1和CYCD3的表达模式在3个品种中相似, BSK和TCH4则在品种间有明显差异。在块茎由休眠向萌芽转变中, 品种间以及抑芽处理下BZR1表达量均无明显变化, 推测它编码的蛋白可能已随块茎膨大而积累, 只是处于磷酸化失活状态, BR信号激活蛋白而不是刺激转录, 来调控块茎生理状态的转变。对比这9个基因变化的幅度、品种间的规律性, 认为在调控块茎生理状态上, 改变BR合成可能比调节信号因子和下游基因更直接有效。
抑芽物质在贮藏期间极大地刺激了受BR调控的下游基因TCH4和CYCD3的表达, 它们的变幅远高于BR合成和信号转导基因, 这反映出下游基因受到除BR外的其他响应胁迫因子的调控。已知TCH4编码木葡聚糖糖基转移酶, 能松弛细胞壁, 这不仅关乎生长发育所涉及的细胞分裂, 同时也与防御胁迫相关。通过TCH4的启动子驱动GUS表达, 发现该基因不仅受BR调控, 冷、热、黑暗等均可刺激它表达, 并且在BR合成或信号转导突变体中也能表达[20]。本试验中两种抑芽物均可刺激TCH4升高, 并且它本身的变化在品种间的规律性不强, 说明该基因可能参与多个生理过程, 导致转录变化复杂。
种子萌发、植株生长都离不开内源激素的调控, BR与ABA、GA互作共同调控上述生理过程。转入BR合成关键酶基因DWF4的拟南芥克服了ABA对种子萌发的抑制作用[21], 同时外源BR处理还能提高番茄种子在胁迫下的萌发能力[22], 进一步研究揭示BRASSINOSTEROID INSENSITIVE2 和 ABSCISIC ACID INSENSITIVE5的互作, 使得BR在ABA抑制种子萌芽中起重要的拮抗作用[23]。除此以外, BR和GA在代谢和信号转导等过程中存在多方面的互作, GA信号中的DELLAs 能直接结合BR信号的转录因子BZR1并抑制其DNA结合活性, GA信号能降解DELLAs, 解除其对BZR1的抑制作用使BR信号通路运行[24, 25]; 水稻中的BZR1能结合合成GA的重要基因的启动子, 促进或抑制GA合成从而调节细胞伸长; 同时GA能够反馈抑制BR的生物合成和响应[26]。已知ABA促进马铃薯块茎休眠, GA3则促进萌芽, 块茎从休眠向萌芽的转变中ABA含量下降、GA3含量升高。本试验发现BR在块茎生理状态转变中扮演重要角色, 不仅其合成基因的表达量随时间升高, 外源BR处理能促进休眠解除和萌芽; 同时BR与GA3互配处理的发芽率高于单独处理。BR促进块茎休眠解除是否是它对ABA有拮抗作用, 与GA在促进萌芽方面有怎样的特殊互作机制, 这些问题都还需进一步研究。Korableva等[6]用21 nmol L-1 24-eBL处理完整块茎可延迟萌芽36~38 d, 与本试验BR处理所表现出的解除休眠作用相反, 两者的差异可能是不同品种对外源24-eBL浓度响应不同造成。
在水稻中的研究表明0.1 nmol L-124-eBL促进单个悬浮细胞伸长, 而1000 nmol L-1抑制细胞伸长, 但明显促进细胞和微丝骨架分裂[27], 这与本试验500 nmol L-1 24-eBL促进块茎解除休眠而萌芽, 但抑制芽的伸长生长相似。此外, 24-eBL还能抑制GA3处理造成的芽徒长现象, 两者互配作用使芽长介于单独处理之间。Zullo和Adam发现24-eBL喷施植株可使单株水稻种子鲜重增加22.0%, 干重增加31.5%[28]。在小麦花期外施24-eBL能提高籽粒的腺苷二磷酸葡萄糖焦磷酸化酶、可溶性淀粉合成酶、淀粉分支酶活性, 提高淀粉含量和品质[29]。改变内源BR含量或信号转导活性可以获得更高的产量并且植株表现更为整齐[30]。通过转入DWF4基因提高BR含量, 可使水稻单株粒重增加15%~44%, 进一步研究表明增加BR促进了葡萄糖向淀粉的同化作用[31]。Schrö der等[32]通过分析BRZ处理和BR缺乏突变体, 认为BR促进生长是靠增加碳源、能量的供应和利用。上述研究结果与本试验24-eBL处理明显促进结薯提前, 增加单株薯块重量相似, 推测BR可能促进叶片中合成的蔗糖向块茎转运以及向淀粉的同化、积累。
BR是块茎解除休眠和萌芽所必需的信号物质, 抑制它的合成基因表达会造成块茎萌芽受阻, 而它的信号转导和调控则是块茎生理状态转变所必经的过程。外源24-eBL具有解除块茎休眠作用, 但不促进芽的伸长生长。24-eBL与GA3存在互作效应, 两者配合处理可改变常规GA3单独处理造成的种薯特别是原原种萌芽不整齐、芽徒长问题, 使块茎达到更佳生理状态, 获得更高产量。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|