第一作者联系方式: E-mail:ymy960571691@163.com
以普通花生品种花育22为母本、高油酸花生品种开农176为父本杂交得到F1杂种, 筛选油酸含量高于60%且同时含有FAD2a和FAD2b位点的F1为杂交父本, 以花育22为轮回亲本(母本)连续回交得到BC1F1~BC4F1代回交种。利用近红外光谱仪测定F1及BC1F1~BC4F1籽粒的油酸、亚油酸含量, 选择油酸含量大于60%的种子, 用刀片切取种子小部分子叶提取DNA, 以F0.7/R3为引物进行PCR扩增及测序, 根据测序峰图差异表现筛选出同时含有FAD2a和FAD2b位点的种子作为下一代回交的父本。切去部分子叶的种子切口用石蜡封闭, 播种前浸泡于40℃温水中催芽, 对12 h后未露白的种子用100 mg L-1乙烯利浸泡4 h后再转入40℃温水浸泡至24 h, 发芽率可达到98%。2013年春季开始杂交, 2016年春在青岛播种BC4F2代种子, 取幼苗期幼叶鉴定基因型, 筛选出基因型为aabb的单株, 收获时选留农艺性状类似于花育22的优良单株, 再利用近红外光谱仪测定所选单株油酸含量, 获得油酸含量在70%以上、油酸亚油酸比值大于7.0的单株24个。这些单株与花育22相比, 农艺性状基本相同, 称为改良花育22高油酸花生新品系。
F1hybrids and BC1F1-BC4F1 backcross generation were obtained by cross and backcross with peanut variety HY22 as female parent (recurrent parent) and Kainong 176 with high oleic acid content as the donor parent. The contents of oleic acid and linoleic acid of F1 and BC1F1 to BC4F1were determined by Near infrared spectrometer. The seeds with oleic acid content higher than 60% were selected and their partial cotyledon was cut off for DNA extraction. The loci FAD2a and FAD2b in these seeds were detected by sequencing absorption peaks of PCR products with F0.7/R3 as primers, and those seeds with both FAD2a and FAD2b were used as the male parent in following backcross. The incision in these seeds whose cotyledon was cut off was sealed by paraffin oil, and these seeds were soaked in water for sprouting at 40°C. Those seeds that did not germinate within 12 hours were soaked in 100 mg L-1 ethephon solution for four hours, then immersed into water till 24 hours at 40°C by which 98% seeds could germinate. Four to five times of backcross every two years were finished in spring in Qingdao, 1-2 times in autumn and winter in Sanya, by which the breeding process might be accelerated. The backcrossing work began in the spring of 2013 and BC4F2 seeds were sowed in Qingdao in the spring of 2016. The young leaves were used for genotyping and these plants with aabb genotype and similar agronomic characters with Huayu 22 were selected and harvested, whose oleic content was then confirmed by NIR. Twenty single plants with similar characters of Huayu 22 whose oleic content was higher than 70% and oleic/linoleic ratio was higher than 7.0 were regarded as a new improved HY22 strain with high oleic acid content.
花生中的主要脂肪酸是油酸和亚油酸, 两者总量一般稳定在80%左右, 并且二者呈明显负相关[1, 2]。普通花生品种的油酸含量一般为40%~50%, 亚油酸含量40%~30%, 油酸/亚油酸(O/L)比值大约1.2左右。高油酸花生的油酸含量可以达到75%~80%, 亚油酸含量5%~2%, 油酸/亚油酸(O/L)比值可以达到15~40[2, 3]。油酸是影响花生油理化稳定性和营养价值的重要品质指标之一, 花生油的油酸含量越高, 稳定性就越好, 不易变质而利于储存, 可延长货架寿命; 同时, 高油酸能有选择性地降低人体血液中有害胆固醇, 保持有益胆固醇, 从而减缓动脉粥样硬化, 有效预防冠心病等心脑血管疾病的发生, 具有非常重要的保健功能与价值[4, 5]。高油酸花生品种已成为许多花生生产国如美国、澳大利亚、印度等国家的育种目标。目前, 美国的花生品种45%左右为高油酸品种, 澳大利亚已完全转向高油酸花生生产[6, 7]。我国的高油酸花生育种起步较晚, 2014年以前仅育成14个高油酸品种, 而且大部分为直立、小果型, 大粒品种仅有4个, 而且产量潜力和综合抗性水平有待进一步提升[3]。因此尽快选育高油酸花生新种质和新品种已经成为目前我国花生品质改良育种的重要目标。
目前已选育出的高油酸花生品种大多数来源于F435型自然突变[8], 该突变体中AhFAD2A在448 bp处发生G-A碱基替换突变为AhFAD2a, AhFAD2B在442 bp处发生碱基A的插入突变为AhFAD2b[9]。栽培花生是异源四倍体, 染色体组成为AABB, AhFAD2A/2a等位基因位于A染色体组, 分别用A/a表示; 而AhFAD2B/2b等位基因位于B染色体组, 分别用B/b表示; 这2个位点的遗传组成包含9种基因型, 其中aabb基因型个体能达到最高的油酸含量[9, 10]。F435型自然突变体油酸含量达到80%, 目前国内外选育的高油酸花生品种多采用此高油酸材料为直接或间接亲本[10]。花育22为山东省主要栽培的早熟出口大花生品种, 油酸含量51.62%, 亚油酸含量28.2%, 油酸亚油酸O/L比值为1.82[11], 遗传组成为AaBB。开农176为河南省开封市农林科学研究院选育的F435型高油酸花生品种, 油酸含量76.80%, 油酸亚油酸O/L比值为11.13, 遗传组成为aabb, 同时含有AhFAD2a、AhFAD2b基因位点[3]。为了将花育22改良为高油酸花生品种, 我们拟选用开农176作为父本, 利用连续回交法将开农176中所含有的AhFAD2a和AhFAD2b基因导入花育22而对其油酸含量进行改良。本研究拟在花生中探索一种快速、高效的回交选育方法和体系, 包括杂种油酸含量检测以及杂种基因型检测、杂种打破休眠处理、冬季南繁杂交等, 综合利用这些技术, 可以实现每两年4~5次杂交, 利用3年时间即可将一个普通油酸含量品种转育成为高油酸品种。
1.1.1 植物材料 普通花生品种花育22, 遗传组成AaBB, 由花生研究所陈静提供。高油酸花生品种开农176, 遗传组成aabb, 由河南省农业科学院经济作物研究所黄冰艳提供。
1.1.2 SDS提取液 1 mol L-1 Tris-HCl (高压灭菌pH 7.6) 1 mL、0.5 mol L-1 EDTA (高压灭菌pH 8.0) 1 mL、10% SDS 5 mL、NP-40 0.5 mL、Tween-20 0.5 mL、蛋白酶K 0.008 g、PVP40 0.5 g加入ddH2O混匀并定容至100 mL。4℃保存备用[12]。
1.1.3 PCR扩增引物 能同时对FAD2a和FAD2b扩增的通用上游引物F0.7序列为5'-CACTAA GATTGAAGCTC-3', 下游引物R3序列为5'-CCCTG GTGGATTGTTCA-3' [13]。
1.2.1 杂交及回交 2013年春于青岛播种, 以花育22为母本、开农176为父本杂交得到F1杂种。2013年秋季收获后选择油酸含量在60%以上、基因型为AaBb的F1种子, 于2013年冬季播种于海南三亚, F1作父本与花育22回交。2014年春收获回交一代BC1F1种子, 经同种方法检测筛选后继续与花育22回交, 每年2~3代, 2015年春夏季于青岛回交得到BC4F1, 经检测筛选后于2015年冬季在海南自交得到BC4F2, 再于2016年春季播种于青岛。回交过程中, 每次选择10~15个单株做父本与轮回亲本进行回交。
1.2.2 杂种油酸、亚油酸含量测定 利用BRUKER Matrlx-1近红外光谱仪扫描(Near Infrared Ray, NIR)测定收获的F1及BC1F1~BC4F1杂种籽粒品质性状。以单粒模型检测每粒种子油酸、亚油酸含量及油酸亚油酸比值(O/L值), 测量3次, 取平均值。
1.2.3 杂种种子子叶的切取 用刀片切取F1及BC1F1~BC4F1种子远胚端某一片子叶约0.4 mm厚的薄片, 放入2.0 mL EP管中备用。用石蜡涂抹封闭切口后备用。
1.2.4 花生子叶DNA的提取 在装有花生子叶的2.0 mL EP管中加入液氮, 用筷子尖端将子叶磨碎, 加入600 μ L 55℃预热的SDS提取液, 充分混匀后放入55℃恒温水浴锅30 min, 期间每5 min颠倒混匀一次。加入600 μ L酚∶ 氯仿∶ 异戊醇(25∶ 24∶ 1), 充分混匀后静置10 min, 8048 × g离心10 min。取500 μ L上清液到新的1.5 mL EP管中, 加入等体积预冷的的异戊醇, 轻轻混匀, -20℃静置30 min后, 8048 × g离心5 min。弃上清液, 将沉淀吹干, 加入50 μ L双蒸水溶解, -20℃保存备用[12]。
1.2.5 FAD2a、FAD2b位点的快速检测 以F1及BC1F1~BC4F1种子子叶DNA为模板, 用能同时对FAD2A/FAD2a和FAD2B/FAD2b位点扩增的引物F0.7/R3进行PCR扩增[14]。PCR体系为25 μ L, 包括DNA模板20 ng、10× PCR缓冲液(含MgCl2) 2.5 μ L、dNTPs混合物(10 mmol L-1) 2 μ L、正反向引物(10 μ mol L-1)各1 μ L、Taq DNA聚合酶 (5 U L-1) 0.5 μ L。PCR扩增程序为94℃预变性5 min; 94℃ 30 s, 61℃ 40 s, 72℃ 50 s, 33个循环; 72℃延伸10 min, 4℃保温。将每个样品扩增3管, 其中1管用于琼脂糖凝胶电泳检测, 另2管混合后送北京华大基因公司进行测序。
1.2.6 切伤种子的催芽播种 将测序检测FAD2a和FAD2b位点均呈阳性的种子, 于40℃温水中浸泡催芽(水浸没种子体积的一半即可, 不要完全浸没), 将12 h后未露白的种子用100 mg L-1乙烯利浸泡4 h, 再转入40℃温水浸泡至24 h统计发芽率, 随后播种于田间[15]。
1.2.7 BC4F2基因型鉴定、田间选择及油酸含量测定 从田间取BC4F2每一单株幼叶, 送北京中玉金公司, 利用针对花生FAD2a和FAD2b新开发的KASP (Kompetitive Allele-Specific PCR)标记(受专利保护)鉴定基因型。进一步调查基因型为aabb的单株田间农艺性状, 筛选重要农艺性状类似于HY22的单株, 用NIR法测定其油酸及亚油酸含量, 计算油酸亚油酸比值。
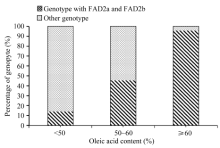
油酸含量大于60%以上的46粒种子中, 有44粒(95.65%)均检测到FAD2a和FAD2b位点; 油酸含量在50%~60%之间的22粒种子中, 有10粒(45.45%)均检测到FAD2a和FAD2b位点; 油酸含量小于50%的36粒种子中, 有5粒(13.89%)均检测到FAD2a和FAD2b位点(图1)。而在所有检测到FAD2a和FAD2b的59粒种子中, 油酸含量大于60%, 介于50%~60%之间和小于50%的分别占到总数的74.58%、16.95%和8.47%。
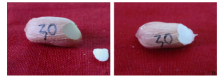
如图2-A所示, 切下的小块子叶用于DNA的提取, 用石蜡封闭待播种种子切口(图2-B)。
图3-A显示, 从子叶中提取的DNA条带清晰, 能够满足PCR扩增的要求。以该DNA为模板, 用F0.7/R3引物对进行PCR扩增, 得到约500 bp的扩增产物(图3-B)。
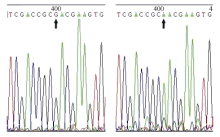
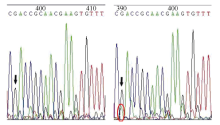
FAD2A位点在约400 bp处碱基序列为CCGCGA, FAD2a在该处碱基序列为CCGCAA, 第5个碱基G突变为A (图4)。FAD2B在约400 bp处碱基序列为CGACCGC, FAD2b在该处碱基序列为CAGACCGC, 在第1个碱基C与第2个碱基G之间插入A, 因此在该位置同时出现G和A的吸收峰以及随后的重叠峰(图5)。根据测序结果碱基吸收峰来对测序样品进行FAD2a和FAD2b位点的基因型鉴定[14]。
切伤并经石蜡封口, 经检测FAD2a和FAD2b位点均成阳性的花生种子, 在40℃温水中浸泡12 h后大部分均已露白, 未露白的种子用100 mg L-1乙烯利浸泡4 h后再转入40℃温水浸泡至24 h, 发芽率可达到98% (图6-A)。
图7表明, 在所检测的219个BC4F2单株中, 所有单株在FAD2A/2a位点均含有碱基A, 表现为纯合的aa基因型; 在FAD2B/2b位点上, 分别表现bb、Bb和BB基因型的单株数目及百分比分别为48株(21.92%)、93株(42.27%)和61株(27.85%), 基本符合经典的一对基因在F2所表现的1∶ 2∶ 1分离比, 有17份(7.76%)样品检测失败, 表明利用KASP法对FAD2A/2B位点进行基因分型成功率约为92%。
对基因型为aabb的单株进行田间农艺性状的调查观察, 选留综合性状类似于HY22的优良单株; 基因型为aaBb的单株也作为备用单株被选留。选留单株在株型、叶型、荚果大小及形状、内种皮金黄色等重要农艺性状上基本与HY22表型类似(图8)。
 | 图8 杂交亲本HY22、KN176以及选留BC4F2单株荚果、籽粒及内种皮颜色Fig. 8 Pod and kernel shape, color of episperm and endopleura in HY22, KN176, and selected BC4F2 single plants |
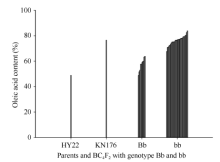
图8表明基因型为aabb的30个单株中, 除1株油酸含量为67.652%外, 其余单株油酸含量均在70%以上, 在70.81%~83.83%之间都有分布; 而基因型为aaBb的10个单株中, 油酸含量均在70%以下, 最高的为63.75%; HY22和KN176油酸含量测定值分别为48.86%和76.52%。初步证明利用分子标记辅助选择的方法是行之有效的。
回交育种是一种常用的育种方法, 旨在通过回交对某一优良品种的个别不良性状进行改良。花育22为山东省主要栽培的花生品种, 符合普通型出口大花生标准, 品质优。为了将花育22改良为高油酸出口型大花生, 本研究利用花育22作母本, 与高油酸花生品种开农176父本杂交, 杂交种作父本与花育22连续回交来对花育22的油酸含量这一性状进行改良。在回交过程中选择杂交种作父本, 首先是为了最大程度地保留花育22的细胞质遗传物质; 其次杂交种数量比较少且具有一定休眠性, 在南繁过程中表现为生长较弱, 不适合作母本, 作父本则可以为轮回亲本提供足够量的花粉量。杂交取父本花粉时尽量取位置较高的花, 位置较低的花下针结果即可收获F2以及BC1F2~BCnF2种子, 进一步自交也有可能选育出其他类型的高油酸新材料。比如在F5材料中还筛选到了小果型的高油酸材料, BC1F2~ BCnF2自交后代也在选育过程中, 有望选育出不同类型的高油酸新材料和新品系。
为了加快品种选育及改良过程, 需要在海南三亚进行冬季加代杂交, 如果在播种前能够鉴定出上一代杂交种的表型和基因型, 筛选出高油酸含量及基因型为AaBb的杂交种及回交种进行播种及杂交, 则可以大大减少工作量并提高杂交效率。因此对于收获后的杂种, 首先利用近红外法测定其油酸、亚油酸含量以及O/L比值, 通过切取种子远胚端部分子叶提取DNA并检测基因型。利用已报道的AS-PCR法、CAPS以及荧光定量PCR均需要对FAD2a和FAD2b位点分别检测, 由于FAD2A/ FAD2a与FAD2B/FAD2b之间仅含一个碱基的差别, PCR扩增稳定性较差而使得检测结果不准确[17]; 利用CAPS的检测试验涉及酶切, 对DNA纯度要求较高[18]; 利用荧光定量PCR法引物需要用荧光素标记, 成本较高[19, 20]。Wang等[21]报道的测序检测法同样需要使用两对引物进行扩增测序, 对FAD2a和FAD2b位点分别进行检测。该测序法利用F0.7/R3引物对可以通过一次PCR扩增和一个测序反应对FAD2a和FAD2b位点同时检测, 比以往报道的方法更快捷高效, 大大减小了检测成本, 适于在育种中大范围推广使用。由中玉金公司针对花生FAD2A/2B位点开发的KASP标记则可以进行大批量样品的快速检测, 大大降低了检测成本。检测结果表明油酸含量大于60%的花生种子中, 有95.65%均可用测序法检测到FAD2a和FAD2b位点; 其中, 油酸含量大于60%的种子占到总数的74.58%。利用近红外光谱仪测定单粒花生种子的籽粒品质性状, 由于受单个籽粒大小及形状的影响而表现一定的误差。利用测序法检测FAD2a和FAD2b位点, 由于A组染色体上FAD2B以及B组染色体上FAD2A位点的存在而使得PCR扩增产物是一个同时包含FAD2A/FAD2a及FAD2B/FAD2b的混合产物, 因此FAD2a和FAD2b位点的确认需要通过测序所产生的吸收峰来识别, PCR扩增中不同产物的扩增量的差别必然会在一定程度上干扰读取结果, 因此利用测序法检测FAD2a和FAD2b位点也存在一定的误差, 虽然这种误差很小。这也正是本研究中出现的两种检测结果不能完全吻合的原因, 因此综合两种鉴定结果确定FAD2a和FAD2b基因位点是否导入必然会使得结果更加准确可靠。在实际工作中, 可根据实际情况将两种方法配合使用。由于近红外法检测快速高效且对种子没有损伤, 所以可以作为初筛使用, 经筛选后油酸含量高于60%的, 再利用测序法筛选掉约5%的不同时含有FAD2a和FAD2b位点的种子。如果这样筛选到的种子仍然不能满足试验要求, 可以继续选择油酸含量在50%~60%的继续进行测序检测, 因为这部分种子中仍有45%含有FAD2a和FAD2b位点, 如果仍不能满足要求, 可以继续对油酸含量在50%以下的种子继续进行测序检测。对所有种子进行测序检测虽然准确性高, 但与近红外法相比, 利用种子提取DNA进行检测会对种子造成损伤, 利用叶片提取DNA进行检测需要播种后检测, 增加了工作量, 而且测序法耗时耗力且成本较高。所以在实际选育过程中要联合两种方法, 可以收到理想效果。为避免种子切伤可能对种子萌发所造成的影响, 使用石蜡对切伤部位封口, 结果表明该种子可以正常萌发。种子从收获到播种时间较短, 为了避免休眠可能对萌发所造成的影响, 对于发芽不好的种子用乙烯利处理以解除休眠, 最终发芽率可达到98%。综合利用这一系列技术, 可以实现每两年4~5次的回交试验, 大大加快了育种进程。2013年秋季收获F1, 冬季海南三亚回交于2014年春获得BC1F1, 2014年秋季获得BC2F1, 2015年春获得BC3F1, 2015年秋获
得BC4F1, 2016年春获得BC4F2, 2016年秋收获筛选出农艺性状类似于花育22, 基因型为aabb且油酸含量在70%以上的BC4F3单株为备选单株, 后期将通过常规育种方法进行优良株系的鉴定评比以及区域试验, 最终将获得改良花育22高油酸花生新品种。
如果花育22在FAD2A及FAD2B位点的基因型为AABB, 开农176的基因型为aabb, 杂种F1基因型为AaBb, 通过分子检测可以筛选到基因型为AaBb的真杂种, 淘汰基因型为AABB的假杂种。而在回交各代BC1F1 ~ BCnF1中, 会出现4种基因型AABB、AaBB、AABb和AaBb, 分子检测可以筛选到基因型为AaBb的种子, 淘汰其他3种基因型的种子以及未能成功杂交的假杂种。从回交各代BC1F1~ BCnF1筛选出的基因型为AaBb的种子, 经自交所得到的BCnF2代中应表现为9种基因型, 4种表现型(9A_B_∶ 3aaB_∶ 3A_bb_∶ 1aabb)。但在本研究中, 在所检测的219个BC4F2单株中, 所有单株在FAD2A/2a位点表现为纯合的aa基因型, 没有出现AA及Aa基因型; 在FAD2B/2b位点上, 表现BB、Bb和bb 3种基因型的单株比例符合经典的一对基因在F2所表现的分离比(1∶ 2∶ 1)。随机挑选花育22不同籽粒进行基因型检测表明, 在该品种群体中同时存在AA、Aa和aa三种基因型, 表明花育22在FAD2A位点上是以杂合状态存在的, 可能在某一次杂交的过程中随机选取到基因型为aa的种子, 所以在其杂交后代中FAD2A位点就成为纯合的基因型。据报道FAD2A位点在中国花生的大多数品种中是普遍存在的[14], 花育22就是其中之一, 但在长期的栽培种植过程中并未对该位点选择纯化, 所以一直以杂合状态存在, 因此做遗传分析首先需要纯化亲本。
以普通花生品种花育22为母本及轮回亲本、高油酸花生品种开农176为父本进行杂交及连续回交, 得到BC4F1回交种。筛选油酸含量大于60%, 同时含有FAD2a和FAD2b位点的BC4F1种子播种自交得到BC4F2, 以分子检测筛选基因型为aabb的单株, 收获时选留农艺性状类似于花育22的优良单株。目前已获得油酸含量在70%以上, 株型、果型等综合性状类似于花育22的单株24个, 称为改良花育22高油酸花生新品系。
致谢: 该研究工作受“ 玛氏-中国花生高油酸育种计划” 项目资助, 感谢玛氏北京温若愚博士, 玛氏北美Victor Nwosu博士在项目执行过程中所提供的帮助。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|