第一作者联系方式: 曹红利, E-mail: lili9885@126.com; 王璐, E-mail: wanglu317@tricaas.com
bZIP转录因子是真核生物中一类多功能蛋白家族, 参与种子成熟、光信号调节、胁迫响应等多种生物学过程, 拟南芥中根据序列相似性和保守域主要分为10个亚家族(A-I和S)。本文以茶树的C亚家族转录因子 CsbZIP4为研究对象, 调查非生物胁迫下的表达模式, 及转化拟南芥后 CsbZIP4过表达对耐盐性的影响。结果显示, 在4℃低温、外源ABA、盐和干旱胁迫处理后, CsbZIP4的表达在茶树叶片中呈上调模式, 特别是在盐和干旱胁迫下其表达分别上调2.9倍和2.2倍; 而在根中, 低温、盐和干旱胁迫均能显著抑制 CsbZIP4的表达, 其中盐胁迫能将其表达抑制2倍; 荧光显微镜下观察CsbZIP4-GFP融合蛋白, 将CsbZIP4定位于细胞核中; CsbZIP4的过表达能够降低转基因株系种子萌发时对外源ABA、盐胁迫的敏感性, 在300 mmol L-1NaCl盐胁迫下, 转化拟南芥植株过表达 CsbZIP4增强抗性, 其叶片的SPAD值较高, 同时过表达株系中盐胁迫响应基因 AtSOS1的表达显著增强。根据 CsbZIP4正调控拟南芥的盐胁迫响应, 推断 CsbZIP4与茶树抵御盐胁迫密切相关。
Basic region / leucine zipper (bZIP) transcription factors is a multi-functional protein family in eukaryotes, which is involved in various biological processes including seed maturation, light signaling regulation and stress response. According to sequence similarity and conserved motifs, the AtbZIPs are classified into 10 groups (A, B, C, D, E, F, G, H, I, and S). In this study, CsbZIP4 of C-group bZIP transcription factors was using as an objective, the expression patterns of CsbZIP4 in response to abiotic stress in tea plants were investigated, and the salinity tolerance caused by CsbZIP4overexpression in Arabidopsis was analyzed. The CsbZIP4from tea plant leaves was up-regulated under 4°C, exogenous ABA, salinity and dehydration stresses, especially the induction of salinity and dehydration stresses led to up-regulation of 2.9-fold and 2.2-fold, respectively. In roots, CsbZIP4 was down-regulated in response to cold, salinity and dehydration stresses, especially down-regulated by 2-fold under salinity stress. Under fluorescence microscope, it was indicated that CsbZIP4 was located in nucleus. Constitutive overexpression of CsbZIP4in transgenic Arabidopsis lowered the plants’ sensitivity to exogenous ABA and salinity at germination stage. Moreover, CsbZIP4overexpression lines exhibited higher salinity tolerance under 300 mmol L-1 NaCl conditions and higher SPAD values. AtSOS1, which is a salinity responsive gene, was strongly induced in overexpression lines. In conclusion, CsbZIP4 positively regulates salt stress response in Arabidopsis, and might be closely related to the tolerance to salinity stress in tea plant.
碱性亮氨酸拉链蛋白(basic leucine zipper protein, bZIP)是真核生物中分布广泛且保守的一类转录因子, 在人、动、植物、微生物和昆虫中均有这类蛋白[1]。bZIP转录因子含有大约18个氨基酸残基组成的碱性结构域, 通过固定的N-x7-R/K结构与特异DNA序列相结合, 该结构中每6个氨基酸是一个亮氨酸, 亮氨酸拉链形成两亲的α -螺旋结构, 主要参与二聚化作用[2]。植物bZIP转录因子的基因家族庞大, Jakoby等[2]根据bZIP碱性结构域以及其他保守结构域特点, 将拟南芥的75个bZIP转录因子家族成员分为10个亚家族A、B、C、D、E、F、G、H、I和S, Corrê a等[3]结合水稻、杨树和拟南芥中bZIP家族基因的保守结构域分析, 将被子植物中的bZIP转录因子家族分为A、B、C、D、E、F、G、H、I、J、K、L、S等13个亚家族。
近年研究显示, bZIP是一个多功能蛋白家族, 参与多种生物学进程, 包括非生物胁迫响应信号途径。其中A亚家族主要在ABA和逆境胁迫信号调控网络中发挥功能; C亚族多参与种子发育、非生物胁迫和病菌防御过程; G亚族成员在光信号、病菌防御和非生物胁迫中都有作用[2]。据报道, 植物中有一些bZIP家族转录因子能够结合ABRE元件(ABA-responsive element, ACGTGGC)并参与ABA调控的非生物胁迫响应途径[2, 4, 5, 6]。通过基因功能鉴定, 发现在多种植物中过表达bZIP基因能够明显改变转基因植株对低温、高盐、干旱、热激和ABA等胁迫的抗性。如拟南芥A亚家族基因AtABF1/2/3/4(AtbZIP35/36/37/38)受SRK2D/E/I的调控, 在ABA介导的非生物胁迫响应中起重要作用[7]。AtABF1/2/ 3/4受低温、高盐、干旱和ABA中的一种或几种处理的诱导, 对AtABF2研究表明, 它除了正调控植株耐非生物胁迫(干旱、盐、高温和氧化胁迫)外, 还在植物响应葡萄糖的信号途径中发挥重要作用[4, 8]。过表达AtABF3的拟南芥耐低温、高温、干旱, 但对盐胁迫敏感[9, 10]。过表达AtABF4的拟南芥耐干旱, 对盐胁迫敏感[9]。大豆中分离出的131个GmbZIP基因中有1/3以上对非生物胁迫中的至少一种胁迫具有响应[11]。在拟南芥中过表达大豆A亚家族基因GmbZIP1能够提高转基因植株的耐盐性、抗寒性和抗旱性[12]; 过表达C亚家族基因GmbZIP62能够增强转基因拟南芥的抗寒性和耐盐性[11]。在水稻中, 过表达C亚家族基因OsbZIP23能显著提高抗旱性、耐盐性和ABA敏感性, 敲除该基因后, 植株的抗旱性、耐盐性和ABA敏感性显著下降[13]。Hsieh等[14]在拟南芥和番茄中过表达番茄基因SlAREB发现, 2种转基因植株都提高了对水分胁迫和盐胁迫的抗性。Ying等[15]将玉米ZmbZIP72转化拟南芥, 发现转基因植株的抗旱性和耐盐性加强。Zhang等[16]从小麦中分离到TabZIP60基因, 拟南芥中过表达该基因后增强转基因植株的耐盐性、抗旱性和抗冻性, 同时也提高了种子萌发阶段对ABA的敏感性。
中国是茶树(Camellia sinensis [L.] O. Kuntze)的起源地, 具有丰富的茶树种质资源, 造就了大量的茶树基因资源, 特别是那些在茶树进化中保留下来的参与抗逆响应的相关基因, 它们是构成植物抗逆基因资源库中的重要一部分。研究利用这些基因的功能, 不仅能够揭示茶树的抗逆响应机理, 同时也为其他植物的抗逆研究提供基因资源。本课题组前期克隆到18个茶树CsbZIP转录因子, 命名为CsbZIP1~ CsbZIP18, 对其进行相关生物信息学分析, 并研究了它们的组织表达模式, 以及在低温、干旱、盐和ABA处理下的表达模式[17]。目前, 茶树中总共获得2个C亚家族bZIP转录因子成员, CsbZIP4和CsbZIP6, 它们的功能尚不明确。本论文以CsbZIP4基因为研究目标, 分析了其在ABA、4℃低温、干旱和盐胁迫等非生物胁迫处理5 d后的表达变化、亚细胞定位情况, 以及通过在拟南芥中过表达该基因, 研究其在调控植物耐盐性中的作用, 揭示其抗逆功能。
所用的茶树品种为国家级茶树品种— — 龙井43。拟南芥材料为野生型拟南芥(Arabidopsis thaliana)品种Col-0 (Columbia-0)。TRIzol、Gateway系列的pENTR/D-TOPO载体和LR酶购自Invitrogen公司; 限制性快速内切酶购自ThermoFisher公司; T4连接酶、Taq酶、PCR高保真酶、pMD18-T载体、SYBR Premix Ex Taq II (Perfect Real-time)等购自TaKaRa公司。pH7FWG2植物过表达载体由中国科学院遗传与发育生物学研究所李云海研究员惠赠; 农杆菌GV3101菌株和大肠杆菌(Escherichia coli)菌株DH5α 为实验室保存菌株。
选取生长健壮, 大小一致的一年生扦插苗, 用自来水将根上的泥土洗掉。参照Ruan等[18]的配方配制茶树全营养液。配好后的营养液用1 mol L-1 HCl调pH值至5。将洗净的茶树分组放入水培槽中, 水培槽中24 h不间断通氧(增氧泵的通氧量为40 L min-1), 在人工气候室中于恒温(23 ± 0.5)℃, 湿度70%, 光照(16 h)/黑暗(8 h)条件下水培至少一个月, 期间每周更换营养液2次。培养一段时间, 待茶苗生长良好, 并长出新根后, 进行逆境胁迫处理, 每处理3个生物学重复。
1.2.1 低温(4℃)处理 取3组茶苗, 每组6株, 预先调节人工气候室的温度稳定在4℃, 将茶苗转移到低温人工气候室中培养, 光照条件不变, 在处理5 d后取样。从每组茶苗中取3~4株, 用剪刀剪下茶苗顶端第2~3片成熟叶片作为叶片材料, 剪下生长正常的侧根作为根的分析材料, 样品采集后迅速放入液氮中速冻, 于-80℃冰箱中保存备用。
1.2.2 ABA、盐和干旱胁迫处理 分别配制含100 μ mol L-1ABA, 150 mmol L-1NaCl和10% (w/v) PEG-6000的营养液, 每种处理进行3组试验, 每组处理6株茶苗。参照上述低温处理采样的方法在处理5 d后分别取成熟叶片和根。
参照Yue等[19]方法提取茶树叶片RNA, 采用TRIzol方法依照说明书提取拟南芥RNA。参照PrimeScript RT Reagent Kit with gDNA Eraser (Perfect Real-time)试剂盒说明书反转录合成cDNA, 将cDNA稀释10倍后用于Real-time PCR反应, 在ABI 7500型实时荧光定量PCR仪(Applied Biosystems Co., Ltd., USA)上进行荧光定量PCR, 反应程序为: 95℃预变性30 s, 95℃变性5 s, 60℃退火延伸34 s, 40个循环, 熔解曲线程序为95℃ 15 s, 60℃ 1 min, 95℃ 15 s。CsPTB基因为茶树内参基因, AtTublin和AtEF为拟南芥内参基因。采用2-Δ Ct或2-Δ Δ Ct算法分析数据。
从植物基因组数据库中下载水稻(http://rice. plantbiology.msu.edu/)、拟南芥(http://www.arabidopsis. org/index.jsp)、大豆(http://www.phytozome.net/soybean)等植物中已报道的与逆境响应相关的bZIP全长氨基酸序列, 在MEGA 6.0中用Clustal W对氨基酸序列进行序列比对分析后, 采用邻接法(Neighbor-joining)构建系统发育树。
通过Invitrogen公司的Gateway克隆技术, 利用pENTR Directional TOPO Cloning和Gateway LR Clonase Enzyme Mix试剂盒将目的基因序列构建到植物表达载体pH7FWG2上。首先设计基因特异引物, 在上游引物的5° 端加入4个碱基“ CACC ” (表1, CsbZIP4-OE), 进行TOPO克隆, 从测序验证正确后的菌落提取质粒, 检测质粒浓度, 取适量体积的质粒与pH7FWG2植物过表达载体进行LR反应, 最终得到含完整ORF的CsbZIP4-pH7FWG2过表达载体。通过液氮冻融法将过表达载体转入农杆菌菌株GV3101感受态细胞中, 转化涂板, 挑取阳性农杆菌克隆鉴定, 用于拟南芥转化, 通过潮霉素筛选T1代阳性株系, 并将阳性株系繁种至T3代纯合体。
| 表1 试验所用引物 Table 1 Primers used in this study |
CsbZIP4转基因拟南芥纯合体幼苗在1/2 MS (Murashige and Skoog)培养基里生长2周, 剪取一小段根部放于载玻片上, 在荧光显微镜(Eclipse 80i, Nikon, Japan)下观察CsbZIP4-GFP融合蛋白的定位情况, 并照相。拟南芥生长于LED冷光源植物气候箱(上海谷宁仪器有限公司), 22℃光照14 h, 18℃黑暗10 h, 湿度70%, 光强为100 μ E m-2 s-1。
将3个纯合体转基因株系4-OE-1、4-OE-2和4-OE-3的种子和野生型Col-0种子用10% NaClO消毒灭菌, 4℃春化2 d, 分别播种到含有0.5 μ mol L-1ABA、150 mmol L-1 NaCl的1/2 MS培养基和对照培养基上, 每个株系50颗种子, 设置3个重复, 放到植物光照培养箱中正常生长待萌发, 统计种子萌发率或子叶绿苗率(%)。
将土培正常生长4周的2个株系(4-OE-2和4-OE-3)和野生型幼苗用300 mmol L-1 NaCl水溶液处理, 每2 d浇一次, 对照浇纯水。处理3 d后一部分采样(整株地上部分)用于生理指标测定和基因表达检测, 另一部分继续盐胁迫处理7 d, 然后浇纯水回复2 d, 观察表型。
拟南芥叶片的叶绿素含量以SPAD测定值来衡量[20, 21], 用SPAD-502 (Konica Minolta Sensing, Japan)叶绿素含量测定仪, 在650 nm和940 nm波长范围内确定叶片中叶绿素相对含量。测量经过300 mmol L-1 NaCl处理3 d和对照的拟南芥相同部位叶片, 每个重复9片叶, 取平均值作为测定结果。
采用DPS v7.05数据处理软件进行单因素分析和LSD多重比较分析, 确定显著性。
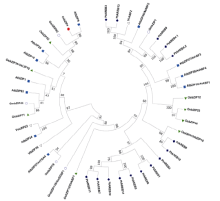
CsbZIP4与bZIP转录因子的C亚家族基因聚在一起, 包括拟南芥中的AtbZIP9/10/25/63, 大豆GmbZIP62和水稻OsbZIP52。其中CsbZIP4与已有功能报道的GmbZIP62[11]和OsbZIP52[22]在进化上较为同源(图1)。因此, 我们推测茶树CsbZIP4可能也在这些非生物胁迫中起着重要的作用。
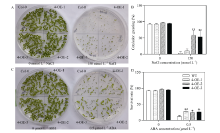
CsbZIP4在4℃低温、ABA、盐和PEG胁迫处理5 d的茶树叶片和根中的表达结果显示(图2), CsbZIP4虽然对4℃处理有响应, 但在叶片中, 其表达在4℃处理后的变化并不显著, 在根中其表达下调的差异倍数在1.5倍以内。在ABA、NaCl和PEG胁迫处理5 d后, CsbZIP4在叶片中被这些胁迫显著诱导, 且上调倍数在2倍以上, 其中5 d的盐胁迫处理能诱导CsbZIP4的表达至2.9倍。而在根中, CsbZIP4的表达被ABA、NaCl和PEG胁迫处理抑制, 且下调倍数在2倍以内。综上, CsbZIP4在茶树叶片中可能主要对ABA、高盐和脱水渗透胁迫有响应。
通过潮霉素筛选T1代转基因种子, 获得多个过表达(CsbZIP4-OE)阳性株系, 按单株编号提取RNA, 反转录成cDNA后进行qRT-PCR鉴定过表达效果, 选取其中3个株系分别标记为4-OE-1、4-OE-2和4-OE-3。从T1代qRT-PCR筛选结果看, 3个株系均有明显的过表达CsbZIP4的效果, 株系2和株系3的过表达效果明显高于株系1 (图3)。将这3个株系繁种鉴定, 获得T3代纯合体株系, 用于后续生理试验。
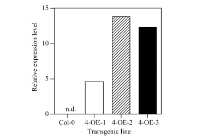 | 图3 定量RT-PCR鉴定CsbZIP4在野生型和转基因拟南芥叶中的表达情况Fig. 3 Expression of CsbZIP4 in leaves of wild type and CsbZIP4-OE plants |
CsbZIP4-pH7FWG2过表达载体中CsbZIP4蛋白的C端融合了绿色荧光蛋白GFP。待CsbZIP4-OE拟南芥幼苗长到2周左右, 剪取小段根部放于载玻片上, 以荧光显微镜下观察基因亚细胞定位情况并照相。图4中绿色荧光蛋白显示CsbZIP4定位于拟南芥根的细胞核内。
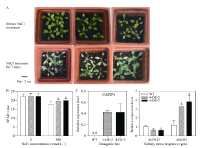
在正常培养条件下, CsbZIP4-OE株系和野生型种子的萌发及长势正常, 没有明显差异。在150 mmol L-1 NaCl胁迫条件下, 植物发芽迟缓, 不能正常长出真叶, 以长出2片子叶为标准统计, 发现3个转基因株系的萌发率比野生型高, 其中4-OE-2和4-OE-3极显著高于野生型(图5-A, B)。说明转基因株系在种子萌发阶段的耐盐性显著高于野生型。与此相似, 在0.5 μ mol L-1ABA培养条件下, 3个转基因株系的存活率显著高于野生型(图5-C, D), 表明转基因株系在种子萌发阶段对ABA的敏感性降低。
选择4-OE-2和4-OE-3这2个株系来进一步研究CsbZIP4在盐胁迫响应中的功能。将生长4周的转基因株系和野生型幼苗用300 mmol L-1 NaCl水溶液处理7 d, 发现过表达株系的成活率比野生型高, 尤其是4-OE-3株系(图6-A)。以300 mmol L-1 NaCl处理3 d后, 过表达株系的SPAD值显著高于野生型(图6-B), 说明在盐胁迫下转基因植株比野生型含有更高的叶绿素, 反映过表达CsbZIP4株系具有较强的耐盐性。
以AtEF为内参基因, 检测转基因和野生型植株中盐胁迫响应途径关键基因的表达变化。图6-C所示, 在300 mmol L-1NaCl处理3 d后, 过表达植株中AtSOS1的表达显著上调, 而AtNHX1的表达显著下调, 这些表明CsbZIP4能够通过调控拟南芥中盐胁迫响应相关基因的表达来提高植物对盐胁迫的耐力。
CsbZIP4在系统进化树中与大豆GmbZIP62的进化关系最近, GmbZIP62正调控拟南芥的盐胁迫响应, 过表达GmbZIP62的拟南芥株系具有更高的耐盐能力(图1)[11]。CsbZIP4受ABA和盐胁迫诱导(图2), 因此, 我们推测CsbZIP4很可能在茶树盐胁迫响应中有重要功能。
通过模式植物拟南芥过表达CsbZIP4的功能鉴定表明, 在外源ABA和盐胁迫条件下, CsbZIP4-OE拟南芥种子的萌发率高于野生型, 过表达株系的耐盐性明显比野生型强, 说明在拟南芥中过表达CsbZIP4会提高其抗逆性(图5)。从生理指标上看, CsbZIP4-OE株系的SPAD值显著比野生型高(图6-B)。虽然在苗期盐胁迫处理7 d后4-OE-2的表型并不明显, 但2个株系在经盐处理3 d时, SPAD值都显著提高, 说明在300 mmol L-1NaCl处理过程中, 2个株系都存在耐盐的表型(图6-A, B)。以上结果证实了在种子萌发阶段和幼苗生长阶段, 过表达CsbZIP4的拟南芥株系的耐盐能力提高, CsbZIP4可能正调控拟南芥对盐胁迫的响应。
水稻OsbZIP23的表达受ABA、干旱和盐的强烈诱导, 在水稻中过表达该基因可以提高转基因株系的抗盐和抗旱能力[13]。大豆GmbZIP132在拟南芥中过表达以后, 在100 mmol L-1和150 mmol L-1盐胁迫条件下, 转基因植株种子的萌发率显著高于野生型, 同时转基因植株幼苗的耐盐性提高[23]。同样, GmbZIP110在拟南芥中过表达后, 转基因植株的耐盐性也明显高于野生型[24]。这些结果与本研究结果比较类似。另外, 水稻OsbZIP71在ABA和干旱胁迫下上调表达, 盐胁迫下下调表达, 过表达OsbZIP71能提高水稻的抗旱和抗盐能力, 而OsbZIP71干涉后, 水稻对ABA、干旱和盐胁迫更为敏感; 同时, 酵母双杂实验发现, OsbZIP71和bZIP家族的C亚家族成员互作形成同型二聚体或者异型二聚体, 且与G盒顺式元件结合[25], 这也暗示着作为C亚家族的CsbZIP4, 可能也需要与其他bZIP蛋白结合来行使功能。
在拟南芥中, 离子平衡主要是受SOS (salt overly sensitive)信号途径调控[26, 27]。本试验分析盐胁迫条件下2个盐胁迫响应基因在CsbZIP4-OE和野生型中的表达模式发现(图6-C), AtSOS1在CsbZIP4- OE植株中的表达量显著高于野生型, 说明CsbZIP4可能通过调控AtSOS1的表达, 提高植株的耐盐性。AtSOS1是质膜Na+/H+反向转运体, 能够将胞质内多余的Na+排出胞质, atsos1突变体的根和叶能够超积累Na+, 而过表达AtSOS1能够降低地上部分和木质部中的Na+ [28, 29, 30]。盐胁迫处理后, AtSOS1在CsbZIP4-OE株系中的表达显著上调(图6-C), 说明CsbZIP4可能通过调控AtSOS1的表达, 将更多的Na+排出细胞质, 从而提高植株的耐盐性。AtNHX1是一个液泡转运体, 能够将钠离子转运进入液泡[31]。AtNHX1在CsbZIP4-OE株系中的表达量显著低于野生型(图6-C), 推测可能由于过表达株系中Na+积累少于野生型, 使胞质和液泡间的Na+分布情况没有显著改变, 相比之下, 野生型中的Na+积累较多, 使得AtNHX1在野生型中的表达相对较高。Zhou等[32]在大豆中过表达GmPIP1; 6后增强了转基因植株的耐盐性, 100 mmol L-1 NaCl处理3 d后, 过表达植株中GmNHX1的表达量比野生型低, GmSOS1的表达量则受强烈诱导, 这与我们的研究结果一致。综上所述, CsbZIP4可能参与调控ABA介导的盐胁迫响应途径, 其通过调控SOS信号途径正调控拟南芥的盐胁迫响应。
CsbZIP4基因对ABA、盐和干旱等非生物胁迫均有响应; CsbZIP4蛋白被定位于细胞核; 在拟南芥中过表达CsbZIP4能够降低转基因株系萌发时期对ABA、盐胁迫的敏感性, 增强转基因株系的耐盐性; 盐胁迫响应基因AtSOS1在过表达植株中被诱导。说明CsbZIP4可能通过调控SOS信号途径正调控拟南芥的盐胁迫响应, CsbZIP4在茶树盐胁迫响应中可能具有重要功能。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|