第一作者联系方式: E-mail: imauwzg@163.com, Tel: 0471-4392047
玉米籽粒形成期的库活性是弱势粒败育或灌浆受限的核心限制因子, 明确弱势粒中内源激素及多胺水平对其库活性的调控机制, 对探索密植条件下玉米弱势粒调控途径具有重要意义。本研究以典型玉米杂交种郑单958和先玉335为材料, 在控制授粉条件下(不完全授粉IcP、完全授粉CP), 比较分析了成功发育弱势粒(IcP处理)和发育不良弱势粒(CP处理)的内源激素及多胺水平差异及其与库活性的关系。结果表明, 品种和年度对籽粒库活性、内源激素和多胺水平整体无显著影响。IcP处理下弱势粒的可溶性酸性蔗糖转化酶(SAI)活性显著高于CP处理, 平均差异和最大差异分别达13.5%和21.8%。在玉米籽粒形成期, 弱势粒中玉米素和玉米素核苷(Z+ZR)、生长素(IAA)、赤霉素(GA3)和脱落酸(ABA)含量在两种控制授粉处理间无显著差异。弱势粒中多胺含量表现为IcP处理显著高于CP处理, 而乙烯释放速率则恰恰相反。弱势粒中SAI活性与多胺含量显著正相关, 而与乙烯释放速率显著负相关, 且多胺含量与乙烯释放速率显著负相关。可见, 在玉米籽粒形成期, 其弱势粒中Z+ZR、IAA、GA3和ABA与其库活性即SAI活性无关; 弱势粒库活性主要受多胺和乙烯含量影响, 多胺促进SAI活性而乙烯则抑制其活性, 二者的平衡关系决定了弱势粒成功发育与否; 多胺和乙烯平衡关系受同化物质供应水平的调控。
Sink activity at blister stage of maize is the primary limiting factor of the abortion and/or filling stagnation of inferior kernels. Clarifying the effect of endogenous hormone and polyamine contents on sink activity of inferior kernels in maize is of great importance for regulating inferior kernels in crowding maize colony. In this present study, two typical commercial maize hybrids Zhengdan 958 and Xianyu 335 were planted in 2014 and 2015. At silking stage, two pollination treatments, incomplete pollination (IcP) and complete pollination (CP), were imposed to each cultivar. The objective of incomplete pollination, in which the pollinated filaments within the basal region of ear was decreased by hand-cutting, was to stimulate the inferior kernel setting in the apical region of ear, where the inferior kernels should be aborted or filling-stagnated in complete pollination. The endogenous hormone and polyamine contents were compared between IcP and CP treatments during blister stage, and the relationship of sink activity with endogenous hormone and/or polyamine contents was analyzed. There was no remarkable effect of hybrids and years on sink activity, endogenous hormone and polyamine of kernels. The soluble acid invertase activity of IcP was significantly higher than that of CP, by 13.5% on an average and 21.8% at the maximum. There was no significant difference in contents of Z+ZR, IAA, GA3, and ABA of the inferior kernels between IcP and CP treatments during blister stage. The polyamine content of IcP was significantly higher than that of CP, but the ethylene producing rate was just the opposite. SAI activity correlated with polyamine content positively, but with ethylene release rate negatively, moreover, ethylene release rate showed negative correlation with polyamine content. The results suggested that, during the blister stage of maize, the contents of Z+ZR, IAA, GA3, and ABA of inferior kernels have nothing to do with SAI activity. SAI activity of inferior kernels is mainly affected by polyamine and ethylene, which is promoted by polyamine content and inhibited by ethylene release rate. The balance between polyamine and ethylene determines the result of inferior kernel development, which is radically regulated by assimilate supply of maize plant.
密植条件下弱势粒不能正常发育或灌浆不充实造成的玉米产量损失在10%以上[1, 2], 促进弱势粒建成与灌浆是玉米产量挖潜的重要途径之一[2, 3, 4]。作物籽粒能否有效灌浆与作物籽粒库特征即籽粒库对同化物质的容纳和吸收能力有关[5]。作物籽粒库特征可分为库容量和库活性两个方面[6, 7]。库容量主要决定于胚乳细胞数目, 是物理性限制因子, 与胚乳细胞分裂过程有关[8]; 库活性则是库器官卸载向其输入的同化物质的能力, 在玉米籽粒形成期, 主要与可溶性酸性蔗糖转化酶(SAI)活性有关[9, 10, 11, 12]。梁红伟等[13]在控制授粉条件下比较分析成功发育弱势粒和败育弱势粒的库特征表明, 玉米籽粒形成期的库活性(SAI活性)是弱势粒败育或灌浆受限的核心限制因子; 徐云姬等研究则表明[14, 15], 在灌浆期玉米弱势粒灌浆差、粒重低与其较低的库活性(淀粉合成相关酶活性)密切相关。籽粒中激素含量及多胺水平高低对籽粒的灌浆充实起重要调控作用, 但前人的研究主要聚焦在不同粒位籽粒间的差异上, 对败育弱势籽粒和成功发育弱势籽粒间的内源激素及多胺含量差异研究甚少[9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19], 且玉米籽粒形成期的库活性是否受激素和多胺水平的调控并最终决定其能否成功发育也尚不明确。因此, 本试验通过控制授粉创造成功发育弱势粒和败育弱势粒, 比较二者间内源激素及多胺含量的差异, 并分析其与籽粒库活性的关系, 以期为探讨玉米弱势粒调控途径提供理论参考。
包头市土默特右旗萨拉齐镇(Salaqi, 40° 28′ N, 110° 28′ E)试验基地, 前茬为玉米, 土质为沙壤土。2014年0~30 cm土壤含有机质24.5 g kg-1、碱解氮21.2 mg kg-1、速效磷26.7 mg kg-1、速效钾120.4 mg kg-1, pH值为7.8; 生育期内总降雨量为417.1 mm, ≥ 10℃活动积温2896.5℃, 太阳辐射总量3450.1 MJ m-2。2015年0~30 cm土壤含有机质26.5 g kg-1、碱解氮20.5 mg kg-1、速效磷24.2 mg kg-1、速效钾90.8 mg kg-1, pH值为7.4; 生育期内总降雨量为398.5 mm, ≥ 10℃活动积温2934.5℃, 太阳辐射总量3503.8 MJ m-2 (图1)。
以典型玉米单交种郑单958 (ZD958)和先玉335 (XY335)为材料, 种植密度7.5万株 hm-2, 行距60cm, 完全随机排列, 3次重复, 共6个小区, 小区面积112 m2(8 m × 14 m)。以P2O5 105 kg hm-2、纯N 40 kg hm-2(磷酸二铵)、K2O 40 kg hm-2(硫酸钾)为底肥于春播前旋耕入土, 于拔节期追施纯N 150 kg hm-2(尿素), 其他管理同当地大田生产。
采用冯汉宇等[20]的方法, 玉米抽丝前在各小区内选取生长整齐一致、有全田代表性的植株80~100株挂牌标记并对其雌穗套袋, 待到花丝完全抽出后, 选取一半植株的果穗做不完全授粉处理(IcP, 果穗顶部和中部小花正常授粉, 通过剪掉外围花丝使果穗下部花丝不授粉), 另一半植株的果穗做完全授粉处理(CP, 玉米果穗全部花丝同步授粉), 分别建成弱势籽粒和败育(或发育不良)弱势籽粒。
从授粉后开始每隔6 d选不完全授粉和完全授粉果穗各5个, 取2~10环籽粒(从果穗最顶端数起)为上部弱势籽粒, 脱100粒左右混匀后, 随机挑出20粒左右称其鲜重后放入15 mL的玻璃试管, 并在试管中放入一条浸湿的滤纸条以保持湿度, 管口用配套的翻口皮塞塞紧, 25℃条件下避光放置12 h后采气, 采用GC-2014型气相色谱仪测定乙烯含量并计算乙烯释放速率[21]。
随机选取10粒左右参照高俊凤[22]的方法测定可溶性酸性蔗糖转化酶活性。剩余部分用于内源玉米素(Z)、玉米素核苷(ZR)、吲哚-3-乙酸(IAA)、脱落酸(ABA)和赤霉素(GA3)及精胺(Spm)、亚精胺(Spd)、腐胺(Put)含量的测定。提取、纯化和定量分析各内源激素参照徐云姬等[13]的方法, 采用Agilent-1200型液相色谱仪检测分析。色谱条件为Dubhe C18 4.6× 250, 5 μ m, 流动相体积比为5%乙腈、50%甲醇、45%的0.6%冰乙酸, 流速为0.8 mL min-1, 采用梯度洗脱法, 检测波长为254 nm; 柱温30℃, 进样量10 μ L。样品回收率为(86.6± 2.3)%, 每一个样品重复3次, 外标法定量。
提取、纯化和定量分析籽粒中多胺参照刘华英等[23]的方法并加以改进。采用Agilent-1200型液相色谱仪(带600控制器和双波长吸光度检测器), 流动相为甲醇∶ 水=60∶ 40, 流速0.7 mL min-1, 等度洗脱; 进样量为10 μ L, 采用C18反相柱测试, 柱温30℃, 在波长254 nm下检测。
采用Microsoft Excel 2003、Origin 8.0统计分析数据, SPSS17.0中One-way ANOVA进行方差分析, SigmaPlot 12.0作图。
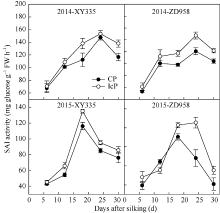
由图2可见, 两年度不同品种玉米弱势粒的可溶性酸性蔗糖转化酶(SAI)活性随着生育进程呈单峰曲线变化, 在18~24 d间达到最大值。弱势粒的SAI活性都表现为IcP处理(成功发育弱势粒)显著高于CP处理(发育不良弱势粒), 平均差异达13.5%, 最大差异达21.8%。
随着籽粒发育进程, 籽粒各内源激素含量变化差异明显(表1)。细胞分裂素类物质(Z+ZR)及3-吲哚乙酸(IAA)含量呈单峰曲线变化, 在授粉后18 d左右达到峰值; 脱落酸(ABA)含量变化呈相反趋势, 至授粉后12~18 d降至低谷, 之后明显回升; 赤霉素(GA3)含量则随灌浆进程呈持续降低趋势。除IAA含量在授粉后12~24 d间表现为不稳定的交替上升趋势, Z+ZR含量在2014年授粉后6 d表现为IcP> CP, GA3含量在2014年授粉后6 d表现为CP> IcP外, 各激素含量在CP和IcP处理间整体差异不显著。
| 表1 不同授粉处理下玉米弱势粒的Z+ZR、IAA、GA3和ABA含量 Table 1 Z+ZR, IAA, GA3, and ABA content of inferior kernels of maize under different pollination treatments |
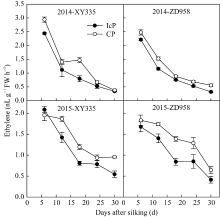
由图3可见, 各处理玉米弱势籽粒乙烯释放速率变化趋势表现一致, 授粉后6 d弱势籽粒乙烯的释放速率最大, 随籽粒发育进程乙烯释放速率逐渐降低。CP处理弱势粒的乙烯释放速率显著高于IcP处理, CP处理较高的乙烯释放量可能是造成其弱势籽粒败育或灌浆停滞的重要因子。
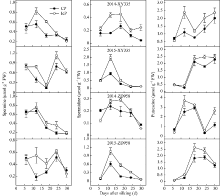
由图4可见, 控制授粉后, 同年份间两品种籽粒中多胺含量变化趋势整体一致, 品种间无显著差异, 但年际间存在明显差异, 且变化趋势不一致, 表现为峰值出现的时间不同。2014年精胺和腐胺含量峰值出现在授粉后12 d, 2015年则出现在授粉后18~24 d, 而亚精胺含量峰值出现在授粉后12~18 d, 年际间相对稳定。IcP处理籽粒多胺含量在12~24 d都显著高于CP处理。
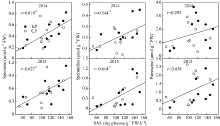
玉米弱势籽粒内源乙烯释放速率与SAI活性呈极显著负相关(r = 0.497* * ~0.850* * )(图5), 而Spm含量和Spd含量与SAI活性呈极显著正相关(r = 0.544* ~0.627* * ), 各年份、品种及处理间规律一致(图6)。由图7可见, 乙烯释放率与Spm和Spd含量呈显著或极显著负相关(r = -0.489* ~ -0.562* * )。但Put含量与SAI活性及乙烯释放速率相关不显著。
作物籽粒库特征受库容量和库活性两个因素的影响[6, 7]。梁红伟等[13]在不同控制授粉处理下比较玉米成功发育弱势粒和败育弱势粒籽粒形成期的库特征后认为, 胚乳细胞分裂过程和最大胚乳细胞数即库容量不是弱势粒败育或灌浆停滞的制约因子, 弱势粒败育或灌浆受限主要受这一时期库活性(SAI活性)控制。但玉米籽粒形成期SAI活性受何因素调控则并不清楚。综合一些学者在不同位势籽粒间对籽粒库活性的研究结论, 影响作物籽粒库活性的因素可概括为两个方面, 一为籽粒内源激素水平, 另一为籽粒中多胺和乙烯水平及其平衡关系。
研究表明, ABA和IAA水平对作物籽粒库活性有正向调控作用, 而GA3则明显抑制库活性。杨建昌等[5]研究表明, 水稻灌浆早期喷施低浓度ABA后, 籽粒中蔗糖-淀粉关键酶活性显著提高, 说明ABA通过调控籽粒中蔗糖-淀粉代谢途径关键酶活性来促进籽粒灌浆。王艳芳等[24]研究认为, 玉米籽粒中IAA含量高低顺序与淀粉含量高低顺序有良好的一致性, 说明高IAA含量有利于淀粉的合成; 孙庆泉等[19]也认为灌浆期籽粒中IAA含量越高, 越利于籽粒的物质充实。很多研究认为, 在胚乳细胞活跃增殖期或籽粒活跃灌浆期, 籽粒中较高GA3会使α -淀粉酶等水解酶活性增强, 促进淀粉的水解, 降低玉米的粒重[25, 26, 27]。也有研究表明, 籽粒中的内源激素比例影响其库活性, 王纪华等[9]和张凤路等[11]认为, 当ABA水平偏高, 而GA3水平偏低时, 籽粒中SAI活性升高, 也就是相对较高ABA/GA3比例可促进库活性, 利于同化物质在籽粒库中的转化卸载。细胞分裂素类物质不参与籽粒库活性的调节, Morris等[17]研究表明, 作物籽粒中高水平的细胞分裂素类物质Z+ZR与籽粒灌浆始期和中期的灌浆速率和灌浆百分比显著相关, 徐云姬等[14]通过玉米强势粒和弱势粒的比较研究认为, 这种调节作用可能是通过调控胚乳细胞的分裂和增加库容来实现的。从本研究的结果来看, 各内源激素含量在成功发育弱势粒和败育弱势粒间皆无显著差异, 说明在玉米籽粒形成期, 内源激素未参与SAI活性的调控; 但从相关分析结果来看, 各内源激素含量与弱势粒胚乳细胞分裂速率和灌浆速率显著相关(未发表数据), 这与徐云姬等[14]的研究结果一致, 说明Z+ZR、IAA、GA3和ABA在籽粒形成期主要影响籽粒库容量, 而与这一时期籽粒库活性无关, 但在线性灌浆期是否参与调解其他与库活性相关的酶类活性有待于进一步研究。SAI是灌浆初期转化蔗糖并使其代谢产物向库卸载的酶, 是打开籽粒库使其接纳光合物质的钥匙; 在糖分卸载到籽粒当中后, 后续的籽粒淀粉合成中也有多种酶发挥作用, 它们对库活性的影响也会影响籽粒的最终建成。杨建昌等[15, 29]通过研究水稻、玉米的灌浆动态, 对比弱势粒和强势粒的多种酶活性发现, 在水稻和玉米灌浆活跃期, 强势粒中的焦磷酸化酶(AGPase)、淀粉合酶(StS)和淀粉分支酶(SBE)活性均显著高于弱势粒, 但各种内源激素是否参与这些酶活性的调节进而影响籽粒灌浆充实, 值得进一步深入探讨。
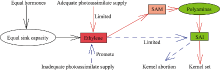
Yang等[5]对水稻弱势粒的研究认为, 籽粒中多胺和乙烯的平衡关系影响糖分卸载关键酶的活性。多胺和乙烯有共同的合成前体S-腺苷甲硫胺酸(SAM), SAM既可以在ACC合成酶作用下转化为乙烯形成的前体物质ACC, 又可以在S-腺苷甲硫胺酸脱羧酶(SAMDC)及亚精胺合成酶和精胺合成酶的作用下, 经丙胺基转移反应依次形成亚精胺和精胺[29]。Feng等[21]研究认为, 乙烯和多胺的这种平衡关系可能受同化物质供应量的影响, 糖分供应充足时, 乙烯合成受到抑制, 而促进多胺的合成, 进而促进了籽粒灌浆, 但高水平多胺是通过什么影响籽粒灌浆则并不清楚。本研究则回答了这一问题, 试验结果表明, 成功发育弱势粒(IcP处理)和发育不良弱势粒(CP处理)的乙烯释放速率和多胺含量都有显著差异, 籽粒中多胺含量整体表现为IcP> CP, 而乙烯释放速率恰恰相反; 相关分析表明, 籽粒中SAI活性与多胺含量显著正相关, 而与乙烯释放率呈显著负相关, 且多胺含量与乙烯释放率也呈显著负相关, 说明乙烯生成会抑制多胺的合成, 从而降低SAI的活性。具体而言, CP处理较高的乙烯含量间接抑制了多胺的合成, 使SAI活性降低, 进而阻碍可溶性糖卸载, 造成弱势粒败育或灌浆受限; 而IcP处理较低的乙烯含量间接促进了多胺的合成, 较高的多胺含量使SAI活性提高, 而较高的SAI活性则促进了可溶性糖的卸载, 从而使弱势粒成功发育并灌浆充实。
实际上, 本研究采用冯汉宇等[20]的方法创造的两种不同发育状态的弱势粒, 其根本原因仍是不同的物质供应水平最终导致了弱势粒发育成功与否, 因此将本研究结果与Feng等[21]和梁红伟等[13]的结论综合分析, 可以基本明确不同物质供应水平通过影响乙烯、多胺的平衡, 进而影响SAI活性并最终导致弱势粒发育成功与否的生理途径(图8)。在同化物质供应充足条件下, 乙烯合成受到抑制, 使更多的SAM在多胺酶等转化酶作用下合成更多的多胺[28], 从而提高了SAI活性, 促进籽粒内还原糖的卸载, 使籽粒成功建成并灌浆充实; 在同化物质供应不足的条件下, 乙烯大量合成, 而抑制了多胺合成, 多胺含量降低进一步影响了SAI活性, 还原糖卸载受阻, 造成籽粒灌浆受限或最终败育。
玉米籽粒形成期的弱势粒库活性即SAI活性受其内源多胺和乙烯含量及其平衡关系调控, 多胺促进SAI活性, 而乙烯抑制其活性。多胺和乙烯平衡受物质供应状况影响, 当同化物质供应充足时, 多胺大量合成抑制乙烯释放, 从而促进SAI活性使糖分向籽粒中卸载, 使弱势粒成功建成; 当同化物质供应不足时, 多胺合成受限而乙烯大量合成, 抑制SAI活性, 还原糖卸载受阻, 籽粒败育或灌浆受限。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|