第一作者联系方式: E-mail: daisy19920829@foxmail.com
目前常用的转基因载体元件大多为真菌或细菌来源, 引发对转基因食品安全性的担忧。本研究克隆了豌豆终止子 rbc-T, 并用其替换农杆菌终止子 nos-T构建转化载体, 利用基因枪法将携带Ubi启动子、 GUS基因和终止子 rbc-T组成的最小表达框片段转化普通小麦, 同时以带有 nos-T终止子的载体为对照, 经过PCR检测筛选获得T2代稳定遗传的转基因小麦株系。GUS组织化学染色及酶活定量分析结果表明, 带有 nos-T及 rbc-T的转基因小麦中均能检测到 GUS基因不同程度的表达。因此认为, 豌豆终止子 rbc-T可以代替农杆菌终止子 nos-T用于小麦的转基因研究。
The fungal- or bacterial-origin vector elements are commonly used in transgenic crops, which raise great concerns about the safety of GM foods. In the study, we isolated the pea ( Pisum sativum) terminator, rbc-T, and constructed a transformation vector by replacing the Agrobacteriumterminator nos-T with rbc-T.The minimum transformation fragment consisting of Ubiquitin promoter, GUS reporter gene and terminator rbc-T was transformed into common wheat by particle bombardment method. Meanwhile a minimum transformation fragment with the Agrobacterium terminator nos-T was used as the control. The T2transgenic lines were regenerated after PCR validation of the transformation. In the transgenic lines carrying both kinds of terminators, GUS gene expression was detected by GUS histochemical staining and enzyme activity analysis, indicating that the pea terminator rbc-T is applicable as an alternative of the Agrobacterium terminator nos-T in transgenic wheat research.
终止子是给予RNA聚合酶转录终止信号的特殊DNA序列, 对于基因的表达调控具有重要作用。目前, 植物转化载体所使用的终止子主要是一些通用终止子, 常用的载体元件(如终止子、启动子等)大多为真菌或细菌来源[1]。这些外源基因通过遗传转化整合进入植物基因组可能会增加人们对转基因植物安全性的担忧[2]。因此, 开发利用植物来源的终止子元件就显得尤为重要。
小麦是重要的粮食作物, 转基因技术的应用有助于小麦品种改良和种质创新, 而关于植物终止子在转基因小麦中的应用研究鲜有报道。本研究选取常用报告基因GUS[3, 4]为目的基因, 构建基因枪遗传转化表达载体, 采用玉米的Ubiquitin启动子及豌豆的终止子rbc-T, 以nos-T终止子为对照, 利用基因枪法转化普通小麦, 对获得的后代阳性植株进行GUS组织染色及蛋白酶活性分析, 结果证明豌豆终止子(rbc-T)在小麦体内发挥正常的转录终止活性, 且与农杆菌胭脂碱合酶终止子(nos-T)功能无明显差异。豌豆终止子rbc-T在小麦转基因研究中的应用将对小麦基因转化方法、转化效率及转基因小麦生物安全的研发和产业化产生一定的促进作用。
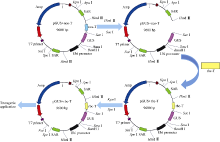
利用双元载体pKM24KH (GenBank登录号为HM036220)[5]分别构建携带豌豆终止子rbc-T和农杆菌终止子nos-T的载体pGUS+rbc-T和pGUS+nos-T, pGUS+ rbc-T的结构和构建过程如图1。
利用在线工具(https://www.ncbi.nlm.nih.gov/tools/ primer-blast/)设计GUS序列特异性引物(F: 5′ -TTAACCAC AAACCGTTCTACTTTAC-3′ ; R: 5′ -AATCGCCGCTTTGG ACATA-3′ ), 以及豌豆终止子rbc-T扩增引物(F: 5′ -GTTC GAGTATTATGGCATTG-3′ ; R: 5′ -GTGTTTTACTCCTCAT ATTAAC-3′ )。引物合成及测序由北京奥科鼎盛生物科技有限公司完成。
利用限制性内切酶Hind III和Sac I酶切pGUS+nos-T去掉农杆菌终止子nos-T, 1%琼脂糖凝胶检测酶切产物并回收。从pKM24KH扩增豌豆终止子rbc-T, PCR产物切胶、纯化并送测序, 将测序正确的豌豆终止子片段与已回收的载体片段连接转化大肠感受态Top10, 选取阳性菌液送测序, 测序正确后提取质粒。用Kpn I和Spe I酶切pGUS+rbc-T, 将整个SAR片段从载体骨架上分离作为最小表达框片段, 1%琼脂糖凝胶检测酶切产物并回收, -20℃保存。
参照徐琼芳等[6]描述的基因枪转化方法和培养体系, 用pGUS+rbc-T和pGUS+nos-T转化受体小麦科农199, 对T0代移栽成活的小麦取样进行PCR检测, 将阳性转基因株系进行温室加代培养, 经过逐代筛选并扩繁, 目前已获得稳定遗传的T2代转基因小麦株系8个, 其中5个携带农杆菌胭脂碱合酶终止子(nos-T), 3个携带豌豆终止子(rbc-T)。以正常生长1周的T2代转基因小麦为材料, 采用CTAB法提取植物样品DNA, 参照Lipp等[7]描述的方法, 并稍作改动。
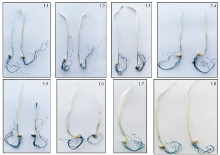
按Jefferson等[8]描述的方法对T2代稳定遗传的转基因小麦株系的种子和幼苗进行GUS组织化学染色分析。取5粒小麦种子置于10 mL离心管中, 分别加入GUS检测液至完全浸没种子, 于37℃过夜避光孵育(约8 h), 无水乙醇洗脱2~3次, 肉眼观察种子染色情况, 并照相记录。将15粒小麦种子于6 cm培养皿中发芽, 长出幼根后移至水培环境中生长1周左右, 取两叶期幼苗置于50 mL离心管中, 加入检测液, 于37℃过夜(约8 h)避光孵育, 无水乙醇洗脱2~3次, 肉眼观察幼苗染色情况并照相。每个材料3次重复。
参考Kevan等[9]所报道的方法分析GUS蛋白酶活性, 试验步骤略作改动。生长2周左右的幼苗取样后分作两组, 一组为整株用锡箔纸包裹, 经液氮速冻后保存于-80℃冰箱, 用于不同转基因株系间的比较; 另一组先按根、茎、叶分样, 再用锡箔纸包裹, 液氮速冻后于-80℃冰箱保存, 用于比较同一株系不同组织中的酶活性。试验均设3个生物学重复。
以科农199为转化受体, 农杆菌终止子nos-T轰击1000个幼胚, 豌豆终止子rbc-T轰击1200个幼胚。前者共获得再生植株52株, 移栽成活36株, 对成活再生植株进行PCR检测共获得T0代的阳性转基因植株12株, 阳性率为33.33%; 后者共获得再生植株56株, 移栽成活28株, 对成活再生植株进行分子检测获得T0代阳性转基因6株, 阳性率为21.43%。对T1代转基因株系进行检测, 已获得8个稳定转化株系, 其中携带农杆菌终止子(nos-T)的转基因小麦株系5个, 携带豌豆终止子(rbc-T)的转基因株系3个, 温室扩繁至T2代用于后续试验研究。
以携带不同终止子的8个转基因小麦株系的DNA为模板进行PCR扩增, 在两种终止子背景下均成功检测到大小为585 bp的GUS基因片段(图2), 阴性对照中均无目标带, 说明通过基因枪法转化最小表达框可以将目标片段整合到小麦基因组中。
为了鉴定豌豆终止子(rbc-T)在转基因小麦体内能否正常发挥功能, 随机取8个转基因小麦株系种子于试管内进行染色, 结果8个株系的种子均有不同程度的着色, 染色部位均集中于种胚、胚乳及腹沟, 从染色的深浅程度可以看出不同转基因株系间GUS表达水平存在差异(图3)。带有不同终止子的转基因小麦幼苗GUS染色结果相似, 染色部位均集中于根部, 由染色的深浅可以看出, GUS在根部的表达量较高, 而在叶片及茎的表达较少(图4)。
GUS酶活分析发现不同转基因小麦株系GUS酶活高低不同, 尤其是携带农杆菌终止子(nos-T)的转基因小麦株系间差异较大, 甚至达到极显著水平; 携带豌豆终止子(rbc-T)的株系间变化不明显, 且整体维持在一个稳定的表达水平(图5-a); 在5个携带农杆菌终止子(nos-T)的转基因小麦中, GUS在根中的表达量均高于茎和叶, 茎和根部的GUS酶活在L1、L2和L4株系间达到极显著差异水平, 而在叶中无明显差异; 在携带豌豆终止子(rbc-T)的转基因小麦中, 根、茎、叶中的GUS酶活差异较小, 且叶中略高(图5-b)。这与图4中GUS组织化学染色结果不尽相同, 推测可能是取样时间不同造成的。
综上, 利用基因枪转化法可以有效地将带有豌豆终止子rbc-T的GUS最小表达框转入植物体内, rbc-T在转基因小麦中可以发挥功能, 且与常用的nos-T相比没有明显效果差异。
终止子是能使mRNA脱离RNA聚合酶和模板DNA 的短序列。目的基因的表达, 需要可诱导的强启动子, 而基因的关闭则需要可靠的终止子, 因此, 基因工程在很大程度上依赖目的基因转录的有效启动和终止。目前, 基因工程载体构建元件中常用的终止子序列多为非植物来源, 对植物转基因生物安全存在一定地隐患, 且种类较少, 如果在复杂系统中重复使用同样的终止子序列, 可能会因为同源重复而消失, 因此迫切需要克隆其他物种, 特别是植物来源的终止子来适应植物基因工程技术的发展。
关于植物转化载体元件的研究已有较多报道。Voigt等[10]构建了包括582个大肠杆菌终止子在内的文库, 并从中筛选鉴定得到了近40个强终止子序列; 张发云等[11]克隆了毛白杨的叶绿体16SrRNA基因启动子Prrn、psbA基因启动子PpsbA及其终止子TpsbA; 金双侠等[12]获得了棉花叶绿体psbA基因启动子、终止子; 钟山等[13]分别以鲤鱼β -actin基因终止子和生长激素基因终止子构建载体, 利用显微注射技术研究这2种不同基因终止子在促进鲤鱼生长方面的效应差异。
本研究采用玉米Ubiquitin启动子和豌豆终止子(rbc-T), 以GUS为报告基因构建最小表达框片段转化普通小麦, 通过一系列实验证明豌豆终止子rbc-T在植物表达载体里能够有效地发挥其终止功能, 为以后利用最小表达框片段转化载体进行其他作物的转基因研究奠定基础, 促进植物转基因植物产品研发和产业化。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|