第一作者联系方式: E-mail:1473718700@qq.com
**同等贡献(Contributed equally to this work)
菌核病是一类非专一性的植物真菌病原菌, 寄主范围广泛, 严重危害农作物的生产。对高世代重组自交系群体(RIL)及F2群体终花期茎秆进行菌核病抗性接种鉴定, 根据构建的近红外模型对接种鉴定的茎秆木质素含量、单体组分比例进行测定, 并进行相关性分析和QTL定位。结果表明在2013年和2014年RIL群体茎秆菌斑大小与木质素含量呈极显著负相关, 相关系数分别为-0.348和-0.286, 与单体G/S呈显著正相关, 相关系数分别为0.198和0.167。2014年F2群体菌斑大小与木质素含量呈极显著负相关, 相关系数为-0.306, 与单体G/S相关性为0.142。F2:3家系抗(感)植株茎部切片间苯三酚染色观察表明抗性较强的材料木质素含量高于抗性较弱的材料。根据已构建的重组自交系高密度SNP遗传图谱, 利用复合区间作图法对上述性状进行QTL分析, 共检测到18个QTL, 其中9个菌核病抗性相关QTL分布于A05、A06、C04和C06染色体, 单个QTL可解释的表型变异为2.38%~12.05%; 3个木质素含量QTL分别位于A04、A05和C01染色体, 单个QTL可解释表型变异的2.03%~13.75%。6个木质素单体G/S QTL分布于A08、C03和C07染色体, 单个QTL可解释表型变异的2.06%~8.66%。本文研究结果为油菜菌核病抗性育种提供了新的思路和理论基础。
Sclerotinia sclerotiorumis a fungal pathogen causing disease in a wide range of plants, resulting in serious damage in crop production. The detached stem inoculation assay of RIL and F2 populations at final flowering stage was conducted, near infrared (NIR) spectroscopy was used to measure lignin content and monomer G/S in the stem, and correlation analysis and QTL mapping for these traits were performed. The lesion size of the RIL had a significantly negative correlation with lignin content, with a correlation coefficient at -0.348 and -0.286 in 2013 and 2014, respectively. The monomer G/S was significantly correlated with lesion size in the RIL population, and the correlation coefficient at 0.198 and 0.167 in 2013 and 2014, respectively. The lesion size of F2 in 2014 was significantly and negatively correlated with lignin content in the stem, with a correlation coefficient at -0.306. The cross sections of resistant and susceptible plants from F2:3family were stained with phloroglucinol-HCl, showing that the content of lignin was significantly lower in the less resistant materials than in more resistant plants. According to the high density SNP genetic maps and composite interval mapping, a total of 18 QTLs were identified, which were located on A04, A05, A06, A08, C01, C03, C04, C06, and C07 chromosomes, with the explained phenotypic variation by individual QTL ranging from 2.38% to 12.05% for nine QTLs of lesion size, from 2.03% to 13.75% for three QTLs of lignin content, and from 2.06% to 8.66% for six QTLs of monomer G/S. The research results provide some new insights for the Sclerotiniaresistance breeding in B. napus.
油菜(Brassica napusL.)属于十字花科芸薹属, 是世界范围内广泛种植的油料作物之一, 为全世界提供15%食用植物油[1]。油菜在中国占据重要的地位, 每年国内一半的食用植物油均为菜籽油[2]。菌核病作为油菜三大病害(菌核病、根肿病和病毒病)之一, 严重影响我国油菜的产量和品质, 每年造成的损失高达5%~30%。长江流域的发病情况最为严重, 轻病年可使油菜减产10%~30%, 重病年甚至可达80% [3]。该病害在澳大利亚可导致油菜年产量减少24% [4], 在北美以及欧洲主要油菜种植区危害也越来越严重[5]。核盘菌的寄主范围非常广泛, 产生的菌核以及子囊孢子能在土壤中存活若干年, 给该病的预防和治疗带来很大困难。尽管化学农药能在一定程度上抑制该病菌, 但植株发育阶段、外界环境以及施用时间等条件的不同都会影响预防效果[6], 令生产成本增加[7], 环境负担加重。选择和培育抗病品种是控制油菜菌核病最经济有效的途径, 但到目前为止, 仅发现一些对菌核病具一定生理抗性或避逆性的品种, 还未培育出对菌核病免疫的品种[8]。
菌核病作为油菜生产的第一大病害, 倍受广大遗传育种家的关注。随着QTL定位、关联分析及转录组测序分析在油菜菌核病研究中的普及和应用, 对油菜菌核病的研究取得了很大进展。Zhao等[9]在F2:3家系中检测到3个与叶片菌核病抗性相关的QTL, 分布在LG3、LG12和LG17连锁群上, 3个与茎秆菌核病抗性相关的QTL, 分布于LG7、LG10和LG15连锁群; Wu等[10]对DH群体苗期叶片和成熟期茎秆的QTL定位, 共检测到13个核盘菌抗性相关的QTL, 重复检测到2个主效QTL, 分别位于A09和C06染色体, 解释表型变异率为8.54%~32.61%; 周李鹏等[11]利用DH群体共检测4个菌核病抗性相关的QTL, 分布于A02、A03和C02连锁群, 解释8.00%~13.80%的表型变异; 梅家琴[12]在甘蓝F2无性系群体中检测到8个与叶片菌核病抗性相关的QTL, 4个与茎秆菌核病抗性相关的QTL, 位于C01、C03、C06、C08和C09染色体, 解释表型变异率为4.9%~18.8%; Wei等[13]对甘蓝型油菜全基因组关联分析, 检测到17个茎秆菌核病抗性相关的QTL, 分别位于A08和C06连锁群; Wu等[14]对接有核盘菌的油菜抗感植株进行转录组分析, 筛选到9001个差异表达基因, 它们主要参与病原体识别、MAPK信号级联、WRKY转录调控、茉莉酸和乙烯信号转导以及防御蛋白生物合成等途径。
木质素作为植物机械组织中重要组成部分和结构抗性物质, 其代谢途径与其他次生物质代谢途径相互交叉, 在植物防御病原体的过程中发挥重要的作用[15, 16, 17]。当植物受到病原体入侵或是机械损伤时便会大量产生木质素及其类似物[18, 19, 20], 而木质化的细胞壁可以增强草本和木本植物的抗菌能力[21, 22, 23]。杨向东[24]发现油菜木质素含量与抗菌核病之间存在显著正相关性。虽然疾病诱导木质素合成相关基因被激活的分子机理尚不清楚, 但在病原体入侵等生物胁迫下会改变木质素的组成即单体比例[25, 26, 27, 28]。木质素单体之间的相对比例及不同类型之间的化学键决定着木质素的复杂性和特异性。油菜是双子叶植物, 木质素主要为S、G型, H型木质素平均仅占总木质素含量的10.96%。S型木质素(syringyl lignin)由紫丁香基丙烷结构单体聚合而成, G型木质素(guaiacyl lignin)由愈创木基丙烷结构单体聚合而成, 不同材料间木质素单体S/G有极显著差异。因此本研究主要从单体组分比例(G/S)入手, 探讨其与油菜菌核病抗性之间的关系。
目前对油菜木质素含量研究的主要目的是降低种子其含量以提高饼粕利用效率。Snowdon等[29]利用SSR标记在甘蓝型油菜A09染色体上检测到1个与种皮木质素含量相关的主效QTL; Liu等[30]利用BSA法对RIL和BC1F2群体进行SSR标记分析, 检测到1个与种子木质素含量相关的主效QTL, 位于A09连锁群。曲存民等[31]在2个环境下共检测到12个种皮木质素含量QTL, 分布于4个连锁群, 可解释表型变异的4.50%~8.79%; Liu等[32]利用高密度SNP遗传图谱, 对4个环境下RIL群体种子木质素含量进行QTL定位, 共检测到8个QTL, 在所有环境中均能稳定检测到2个主效QTL, 分别位于A09和C05染色体, 解释的表型变异范围分别为31.6%~ 42.8%和8.1%~14.1%。木质素作为苯基丙烷衍生物单体构成的聚合物, 极大地限制了生物燃料的开发和应用。Chen等[33]在转基因苜蓿中通过下调木质素合成过程中相关基因的表达, 能大幅提高植物中糖化作用的效率以及纤维素乙醇的产量。黄杰恒[34]分析表明, 干旱处理和浇水对照条件下, 木质素单体S/G与抗折性均极显著正相关。Eynck等[35]以2个菌核病抗性不同的亚麻芥为材料, 发现在抗病植株中木质素单体S/G高于感病植株。在油菜中木质素单体G/S与菌核病抗性间的相关性以及木质素单体G/S相关的QTL尚未见报道。
高世代重组自交系群体亲本分别为GH06和P174, F2群体以中双11 (菌核病抗性较强)和E54 (菌核病抗性较弱)为亲本, 选用甘蓝型油菜中双11为抗病对照。随机选取172份重组自交系进行SNP标记分析, 构建高密度SNP遗传连锁图谱。
2013年10月播种RIL10群体, 次年4月鉴定其离体茎秆抗性; 2014年10月播种RIL11、F2群体, 次年4月鉴定其离体茎秆抗性。选取中双11为对照, 种植所有材料于重庆市油菜工程中心试验田, 随机区组设计3个重复, 每个小区2行, 每行10株。行距0.40 m, 株距0.24 m, 按常规生产方式进行田间管理, 确保所有样本的外部生长环境一致。
将纯化的菌核于PDA培养基传代培养至第3代。终花期对172份RIL群体和311份F2群体茎秆离体接种, 随机选取每份材料3株, 距离地面20 cm处截取长度约30 cm的主茎, 将茎秆两端用保鲜膜缠绕, 以防水分散失和伤到茎秆表面而影响试验结果。将茎秆排布在铺有湿毛巾和滤纸的铝合金框架上, 将PDA菌丝块接种于茎秆平滑处, 带菌面紧贴茎秆表面, 注意避开分枝结口部位, 每段茎秆接种2个菌丝块(两菌丝块间隔10 cm)。接种完毕, 将温湿度计与接种的茎秆一同密闭, 设置室内温度为22℃, 相对湿度为90%以上。接种后第3天统计菌斑长度。通过“ 相对感病度” (R)衡量材料抗性水平, R=V/V对照, 即待测植株菌斑大小与对照中双11病斑大小的相对比值。R值越小表明材料抗性越强, 反之代表材料越易感病, 若R=1, 则表明材料的抗性与中双11相当。
将接种鉴定后的离体茎秆晒干, 于60℃烘箱中彻底烘干(约48 h), 用FW80-1粉碎机彻底粉碎, 收集至自封袋, 密闭于干燥器中保存。用构建的近红外模型测定2013年和2014年种植的RIL群体及2014年种植的F2群体样品粉末木质素含量和单体G/S, 用SPSS18.0软件和Microsoft Excel 2013软件统计数据及分析表型相关性。
终花期从F2:3家系中选取株高一致的菌核病抗(感)性材料各2株, 于距离植株顶端10 cm处徒手横切茎端组织进行间苯三酚染色。将Leica CM1800冷冻切片机机箱温度降至-20℃。截取油菜茎秆(长约0.1~0.3 cm), 置样品托头上, 用OCT包埋剂包埋, 待包埋剂变白后将其移至切片机的机头上, 设置切片厚度(25~100 μ m), 进行切片。挑选组织结构完整的薄片, 用毛笔将其放入盛水的培养皿中清洗包埋剂。将组织薄片转移到载玻片上, 吸干剩余水分, 滴加1%的间苯三酚染色, 静置5 min, 再加入1滴35%浓盐酸显色。将载玻片置Olympus DP80型光学显微镜下观察, 并采用cellSens Standard软件采集图片, NIS-Elements AR 3.2分析图片。
所用的重组自交系高密度SNP遗传图谱, 包含2795个SNP多态性标记位点, 总长1832.9 cM, 相邻标记间平均距离为0.66 cM [32]。采用软件Windows QTL Cartographer 2.5及复合区间作图(Composite Interval Mapping, CIM)法对2年RIL群体的菌斑大小、木质素含量以及单体G/S进行QTL定位及效应检测。CIM分析时, 选取1 cM的步长(walking speed), 按照假定检测10和Zmapqtl模型6, 选取参数1000次回归, 显著水平为0.01, 检测区间可能存在的QTL, 软件分析的同时给出性状QTL的加性效应和解释的表型变异。当加性效应大于0时, 表明性状效应值来自父本P174, 加性效应小于0时, 性状效应值来自母本GH06。参照McCouch等[36]的方法, 以“ q” 加年份再加染色体编号和性状命名检测到的QTL。
如图1所示, 两年里RIL群体和F2群体中相对感病度、木质素含量及单体G/S均呈明显的正态分布, 变幅范围表现出双向超亲分离, 表明菌核病抗性、木质素含量和单体G/S是受多基因控制的典型数量性状。偏斜度和峰度值几乎都小于1, 适合于QTL分析(表1和表2)。
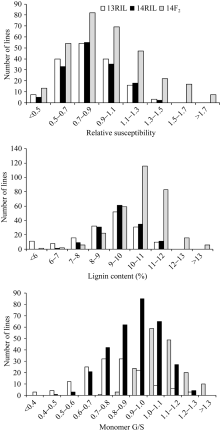 | 图1 RIL和F2群体茎秆相对感病度、木质素含量和单体G/S在2013年和2014年的频率分布Fig. 1 Frequency distribution of stem relative susceptibility, lignin content and monomer G/S fromB. napusRIL in 2013 and 2014 and F2in 2014 |
| 表1 RIL群体茎秆相对感病度、木质素含量及单体G/S的表型分布特征 Table 1 Phenotype distribution feature of stem relative susceptibility, lignin content and monomer G/S for RIL populations |
| 表2 F2群体茎秆相对感病度、木质素含量及单体G/S的表型分布特征 Table 2 Phenotype distribution feature of stem relative susceptibility, lignin content and monomer G/S for F2 populations |
如表3所示, 2013年RIL群体菌斑大小与木质素含量呈极显著负相关, 相关系数为-0.348, 与单体G/S呈显著正相关, 相关系数为0.198, 木质素含量与单体G/S之间无显著相关性; 2014年RIL群体菌斑大小与木质素含量呈极显著负相关, 相关系数为-0.286, 与单体G/S呈显著正相关, 相关系数为0.167, 木质素与单体G/S之间相关性未达到显著水平; 表4所示, 2014年F2群体菌斑大小与木质素含量呈极显著负相关, 相关系数为-0.306, 与单体G/S相关系数为0.142, 木质素含量与单体G/S之间无显著相关性。这说明木质素和单体G/S在油菜菌核病防御过程中均发挥重要的作用。同一性状在2013和2014年RIL群体及2014年F2群体中均表现为极显著正相关, 相关系数较高, 说明菌斑大小、木质素含量、单体G/S性状遗传稳定。
| 表3 2013年和2014年RIL群体菌斑大小、木质素含量及单体G/S的相关性分析 Table 3 Correlation coefficients among lesion size , lignin content and monomer G/S for RIL population in 2013 and 2014 |
| 表4 2014年F2群体菌斑大小、木质素含量及单体G/S的相关性分析 Table 4 Correlation coefficients among lesion size, lignin content and monomer G/S for F2 population in 2014 |
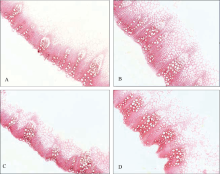
细胞产生的木质素会在细胞壁沉积, 间苯三酚-盐酸染液能将木质化的细胞壁染成樱桃红色或红紫色, 颜色越深, 木质素含量越高。A和C分别代表2个菌核病抗性相对较弱的材料(Z258和Z234), B和D分别代表2个菌核病抗性相对较强的材料(Z219和Z232)。图2为抗(感)植株茎秆局部冷冻横切图片, 在显微镜视野下观察到木质素含量以抗病较弱植株(A、C)低于抗病较强植株(B、D)。
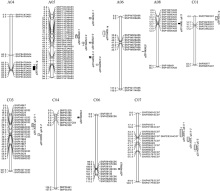
总共检测到18个QTL (表5和图3), 菌核病抗性相关的QTL有9个, 分布于A05、A06、C04和C06染色体, 单个QTL可解释的表型变异为2.38%~12.05%, LOD为2.78~7.45, 性状效应值均来自母本。两年内在A05染色体上均检测到1个有重叠置信区间的菌核病抗性QTL (q2013A05LS-2和q2014A05LS-2), 加性效应均为负, 说明其性状效应值来自母本GH06, 即抗性增效基因来自父本P174。对于木质素含量检测到3个QTL, 分别位于A04、A05和C01染色体, LOD为3.00~3.61, 解释表型变异为2.03%~7.35%, 其中q2013A05Lig与q2013A05LS-1的置信区间部分重叠。对于木质素单体G/S共检测到6个QTL, 分布于A08、C03和C07染色体, 单个QTL可解释表型变异在2.06%~8.66%之间, LOD值介于2.67~3.40之间, 在C07染色体上也检测到1个有重叠置信区间的木质素单体G/S的QTL (q2013C07LigG/S-1、q2013C07LigG/S-2和q2014C07LigG/S), 其加性效应为正, 说明增效基因均来自父本P174。检测到的数量性状位点中, 与菌斑大小相关的q2013A05LS-2和与木质素含量相关的q2014C01Lig, 其表型贡献率最大(R2> 12%)。
| 表5 利用复合区间作图法检测到茎秆菌斑大小(LS)、木质素含量(Lig)及单体G/S (Lig G/S)在2个环境中的QTL Table 5 Putative QTL detected by CIM for stem lesion size (LS), lignin content (Lig), and monomer G/S (Lig G/S) in two environments |
近年来, 对甘蓝型油菜茎秆木质素含量的研究逐渐增多, 尤其在茎秆抗病抗倒伏方面。杨向东等[24]分析了29个油菜材料茎秆木质素含量与抗菌核病间的相关关系, 相关系数为0.6971, 表明木质素含量与油菜抗菌核病之间存在显著正相关性。本研究表明, 2013年和2014年RIL群体菌斑大小和木质素含量相关系数分别为-0.348和-0.286, 2014年F2群体菌斑大小和木质素含量相关系数为-0.306, 菌核病抗性与木质素含量均呈极显著正相关, 与杨向东的结果一致。对F2:3家系菌核病抗(感)材料冷冻切片观察也表明, 抗性强的材料中木质素含量明显高于抗性弱的材料, 与上述结论一致。木质素单体之间的相对比例及不同类型之间的化学键决定着木质素的复杂性、特异性及稳定性。在病原体入侵等生物胁迫下木质素的组成即单体比例会发生改变[25, 26, 27, 28]。黄杰恒[34]分析表明, 干旱处理和浇水对照条件下, 油菜木质素单体S/G与抗折性均极显著正相关。Eynck等[35]发现, 亚麻芥木质素单体S/G在抗性植株中(1.7)高于在感性植株中(1.2)。在我们的研究中发现2013年和2014年RIL群体菌斑大小和单体G/S均呈显著正相关, 相关系数分别为0.198和0.167, 2014年F2群体中与单体G/S相关系数为0.142, 菌核病抗性与木质素单体G/S均呈负相关, 这与Eynck等[35]的结果一致。上述研究结果表明木质素单体组分比例(G/S)不仅与油菜抗倒伏相关, 还影响油菜菌核病抗性。
Li等[37]对油菜茎秆菌核病抗性相关QTL整合分析, 最终得到的保守QTL位于A09 (22.5~27.5 Mb)和C06 (29.5~36.1 Mb)染色体。尽管油菜菌核病抗性QTL定位的研究结果具有一定共性, 但是目前检测到的QTL分布相对比较分散, 很少能重复检测到QTL。目前油菜菌核病抗性相关QTL主要集中在A01、A02、A03、A05、A06、A08、A09、C02、C04、C06、C07、C08和C09染色体上[3, 9, 10, 11, 12, 13, 38, 39, 40], 鉴定出的油菜抗菌核病QTL数量较多但主效QTL较少, 且单个QTL能解释的表型变异有限。QTL检测的方法、被检测群体的种类和大小、接种的环境、方法和接种年份都会影响QTL的检测, 因此能检测出的主效QTL较少。本研究连续两年对RIL群体菌核病抗性进行QTL定位, 检测到9个与菌核病抗性相关的QTL, 分布于A05、A06、C04和C06染色体上, 与前人研究结果一致。同时其加性效应均为负, 说明抗病QTL的抗病性贡献都来自抗性较强的父本P174, 在抗性较弱亲本中没有检测到相关QTL, 这可能和遗传图谱的覆盖度有很大关系, 不能否定抗性较弱亲本中存在抗性QTL。在A05染色体上检测到1个有重叠置信区间的菌核病抗性QTL (q2013A05LS-2和q2014A05LS-2), 且抗性增效基因均来自父本P174, 可能为同一QTL。Tuberosa等[41]认为性状相关表型在QTL分析结果上, 可能存在控制不同性状QTL之间的紧密连锁或同一QTL位点控制不同性状的现象即一因多效。Zhao等[3, 9]发现油菜菌核病抗性QTL与种子硫甙含量及油菜开花时间QTL间有重叠区间。梅家琴[12]在F2无性系群体中发现油菜菌核病抗性QTL与开花期QTL区间存在部分区域重叠。本研究发现油菜菌核病抗性相关QTL (q2013A05LS-1)与茎秆木质素含量相关QTL (q2013A05Lig)的置信区间部分重叠, 佐证了菌斑大小与木质素含量极显著负相关性。上述研究结果表明在油菜抗菌核病QTL中也存在一因多效的现象。
甘蓝型油菜木质素的遗传基础报道相对较少, 多数研究认为木质素遗传基础较复杂, 表型易受外界环境影响, 属于多基因控制的数量性状。Snowdon等[29]在甘蓝型油菜染色体A09上发现1个种皮木质素含量相关的主效QTL。Liu等[30]利用BSA法对RIL和BC1F2群体进行SSR标记分析, 检测到1个与种子木质素含量相关的主效QTL, 位于A09连锁群上。Liu等[32]以4个环境下RIL9为材料, 对甘蓝型油菜种皮木质素含量进行定位, 共检测到8个QTL, 所有环境中均能稳定检测到2个主效QTL, 分别位于A09和C05上, 解释的表型变异率分别为31.6%~42.8%和8.1%~14.1%。前人关于油菜种皮木质素含量数量性状位点研究结果表明, 相关QTL主要集中在A09和C05上, 且多次在A09上检测到主效QTL, 由于不同遗传图谱上利用的分子标记不同, 因此还无法确定上述各研究中的QTL是否相同。本研究中检测到3个木质素含量QTL, 分别位于A04、A05和C01染色体, 单个QTL可解释表型变异的2.03%~13.75%。与前人对种子或种皮木质素含量相关QTL定位结果不一致, 推测种子或种皮木质素含量和茎秆木质素含量可能受不同基因控制, 因此它们在遗传上可能相互独立。本试验共检测到6个与木质素单体G/S相关的QTL, 分布在A08、C03和C07染色体上, 单个QTL可解释表型变异的2.06%~ 8.66%。其中q2013C07LigG/S-1和q2013C07LigG/S-2的置信区间重叠, q2013C07LigG/S-2和q2014C07 LigG/S置信区间部分相同, 3个QTL的加性效应均来自父本, 因此可能是同1个QTL。此外, 这种影响同一性状的不同QTL聚集在C07染色体的现象, 也可能是同一位点的复等位基因在多倍体形成过程中发生染色体重排所致。目前与木质素单体G/S相关的QTL尚未见报道, 因此还不能与前人研究作比较。
茎秆菌斑大小与木质素含量呈极显著负相关, 与单体G/S呈显著正相关。木质素含量以菌核病抗性较强的材料高于抗性较弱材料。共获得18个QTL, 分别位于A04、A05、A06、A08、C01、C03、C04、C06和C07染色体, 含9个菌核病抗性相关的QTL, 3个与木质素含量相关的QTL, 6个与单体G/S相关的QTL。其中q2013A05LS-2和q2014A05LS-2置信区间基本重合, 且抗性增效基因均来自父本, 可能是同1个QTL。q2013A05Lig和q2013A05LS-1的置信区间部分重叠。q2013C07LigG/S-1和q2013C07 LigG/S-2的置信区间相重叠, q2013C07LigG/S-2和q2014C07LigG/S的置信区间有相同部分, 且3个QTL的加性效应均来自父本, 因此也可能是同1个QTL。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|