第一作者联系方式: E-mail:344498529@qq.com
木薯( Manihot esculenta Crantz)块根有色体是类胡萝卜素贮藏和调控多种生理生化过程的场所。本研究发现Percoll密度梯度离心法最适合于木薯块根有色体的提取, 利用光学显微镜观察发现40%~50% Percoll梯度层富含完整有色体, Western blot分析显示该层的线粒体标志酶Vdac1杂交信号较低, 而质体标志酶RbcL杂交信号最高, 并以此确定木薯块根有色体的分离方法。利用蛋白质组学方法显示SC9块根有色体存在34个差异蛋白质, 其中上调表达17个, 下调表达17个; 涉及碳代谢及能量代谢相关蛋白所占比例最高。STRING蛋白质互作网络显示, Enolase 2与Elongation Factor互作关系最多, 是整个互作网络的核心蛋白质。qRT-PCR定量分析显示 Enolase 2在高类胡萝卜素的蛋黄木薯SC9的表达水平显著高于低类胡萝卜素品种SC6068。推测其可能是影响SC9与SC6068类胡萝卜素差异的主要蛋白质之一。
Chromoplasts are the sites to store carotenoids and regulate a variety of physiological and biochemical process in the storage roots of cassava ( Manihot esculenta Crantz). In the present study, it was found that Percoll density gradient centrifugation was suitable for isolating the chromoplasts from cassava storage roots. Rich and intact chromoplasts were located in 40% to 50% layer of Percoll and the expression level of Vdac1, a mitochondrial marker, was the lowest and the expression level of RbcL, a plastid marker, was the highest compared with other layers using Western blot. Thirty-four differentially expressed proteins were detected in SC9, in which 17 were up-regulated, and the others were down-regulated. The differential proteins related to carbohydrate and energy metabolism accounted for the highest proportion. The STRING protein-protein interaction network showed that Enolase 2 and Elongation Factor were the hub proteins, which play the key roles in the whole regulatory network. Quantitative analysis by qRT-PCR confirmed the Enolase 2expression was more significantly up-regulated in the high carotenoid cassava variety than in the low carotenoid cassava SC6068. These two proteins may be the key points for affecting the carotenoid content between SC9 and SC6068.
木薯(Manihot esculenta Crantz)为大戟科木薯属植物, 是世界热带地区近8亿人的主粮, 木薯不仅具有高光效和高淀粉积累特性, 而且耐贫瘠和干旱, 对环境适应能力强[1, 2, 3]。然而普通木薯栽培品种类胡萝卜素含量较低, 长期食用会引起视力下降, 夜盲症和干眼病等症状, 因此选育富含高类胡萝卜素的木薯新品种越来越受到重视。
木薯块根有色体是类胡萝卜素的载体[4], 而类胡萝卜素是光合作用的辅助色素, 为光合元件提供必要的保护, 同时也是植物激素脱落酸(ABA)和独角金内酯(strigolactone)合成的前体[5]。开展木薯块根有色体蛋白质组研究, 有助于发掘有色体中与类胡萝卜素合成, 有色体转化等相关功能蛋白质。而双向电泳(two-dimensional electrophoresis, 2-DE)是蛋白质组学研究的重要技术手段, 该技术与质谱技术(mass spectrometry, MS)、生物信息学技术连用, 能够实现对生物体某一个时期内细胞全蛋白质的高通量分离和功能蛋白质高效、准确鉴定[6, 7]。随着亚细胞分离技术的发展[8, 9, 10, 11], 亚细胞蛋白质组学已逐步成为植物研究的热点。叶绿体[8, 9, 10, 11]、线粒体[12]、液泡[13]等亚细胞结构蛋白质组的研究已经陆续开展。已有研究表明, 从植物组织中分离获得完整的有色体, 常用的方法是加入适当提取缓冲液后用搅拌机使植物组织破碎, 差速离心获得有色体粗提物, 使用密度梯度离心法可以从有色体粗提物中获得较多完整的有色体。番茄、辣椒、柑橘、花椰菜[14, 15, 16, 17]等植物有色体分离方法研究表明, 使用不同方法从植物中获得的有色体及其蛋白质有较大差异。
木薯蛋白质组学研究多集中在块根和叶片等植物器官全蛋白组水平上, 如安飞飞等[18]采用苯酚抽提法提取木薯叶片蛋白质, 并通过2-DE技术研究不同叶片蛋白质组差异, 宋雁超等[19]利用2-DE技术研究木薯高淀粉与低淀粉种质块根的差异蛋白质。对于木薯亚细胞结构中有色体提取方法研究较少。本试验研究木薯块根有色体提取分离方法, 同时, 运用2-DE结合质谱技术分离2个木薯品种块根有色体全蛋白质, 筛选和鉴定差异蛋白质点, 为木薯块根有色体类胡萝卜素的合成研究提供基础数据。
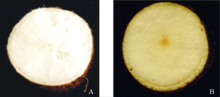
供试材料SC6068 (图1-A)和SC9 (图1-B)取自中国热带农业科学院热带作物品种资源研究所国家木薯种质资源圃, 本课题组经早期研究得出SC9和SC6068栽培种块根成熟期的β -胡萝卜素含量分别为2.70 μ g与0.65 μ g[20], 差异达显著水平。本研究选取生长达9个月且未被病虫侵染的完整块根, 用双蒸水洗净后提取有色体。
1.2.1 Percoll密度梯度离心法 参考辣椒有色体提取方法[15]并加以改进。取块根500 g切碎, 加入预冷提取缓冲液500 mL [1 mmol L-1 NaP2O7, 50 mmol L-1 HEPES (pH 7.5), 330 mmol L-1山梨(糖)醇, 2 mmol L-1 EDTA, 1 mmol L-1 MgCl2 2 mmol L-1 MnCl2, 2 mmol L-1 DTT], 后用搅拌机破碎, 用Calbiochem生物公司的4层神奇滤布过滤匀浆, 离心5 min (500× g, 4℃), 取上清液, 将上清液再次离心10 min (5000× g, 4℃), 取沉淀部分加入1 mL提取缓冲液悬浮。小心吸取平铺于Percoll梯度液上层悬浮的有色体 (20%~30%、30%~40%、40%~50%、50%~60%各1.5 mL), 离心45 min (8000× g, 4℃), 小心吸取各个梯度的黄色分层, 用5倍体积的提取缓冲液重复清洗3次后, 得到有色体沉淀。
1.2.2 蔗糖密度梯度离心法 参考番茄有色体提取方法[17]并加以改进。取块根500 g切碎, 加入预冷的提取缓冲液500 mL [50 mmol L-1 HEPES (pH 7.5), 2 mmol L-1 EDTA, 330 mmol L-1山梨(糖)醇, 5 mmol L-1 2-mercaptoethanol], 后用搅拌机破碎, 4层神奇滤布过滤匀浆, 离心5 min (500× g, 4℃), 去除粗淀粉, 取上清液再次离心10 min (5000× g, 4℃), 取沉淀部分, 得有色体粗提物。将有色体粗提物小心加入5 mL的50%蔗糖梯度液悬浮后, 小心平铺于蔗糖梯度液(50%、30%、17%)上, 离心45 min (62 000× g, 4℃), 小心吸取各个梯度分层, 用10倍体积的缓冲液重复清洗3次, 得到有色体沉淀。
1.2.3 Nycodenz密度梯度离心法 参考柑橘有色体提取方法[16]并加以改进。取块根500 g切碎, 加入预冷缓冲提取液500 mL [1 mmol L-1 NaP2O7, 50 mmol L-1 HEPES (pH 7.5), 330 mmol L-1 sorbitol, 2 mmol L-1 EDTA, 1 mmol L-1 MgCl2 2 mmol L-1 MnCl2, 2 mmol L-1 DTT, pH 6.8], 用搅拌机破碎3次, 每次10 s; 4层神奇滤布过滤匀浆。离心5 min (500× g, 4℃), 取上清液再次离心10 min (6000× g, 4℃), 取沉淀部分, 得到有色体粗提物。而后加入2 mL提取缓冲液清洗。小心平铺于Nycodenz粉剂配置而成的梯度液 (30%、24%、20%、15%)上, 离心45 min (8000× g, 4℃), 小心吸取0/15%与15%/20%间的淡黄色梯度层, 加入10倍体积提取缓冲液重复清洗3次(5000× g, 10 min), 得到有色体沉淀。
1.2.4 木薯有色体提取纯度分析 利用光学显微镜检测有色体的完整性, 同时使用Western blot检测有色体的纯度, 所用抗体分别为线粒体外膜标记抗体(电压依赖型阴离子通道抗体, Vdac1, 29 kDa, 1:5000稀释)和质体标记抗体(二磷酸核糖酮羧化酶大亚基、RbcL、53 kDa, 1:5000稀释)。
1.2.5 木薯有色体全蛋白质提取 参考木薯块根全蛋白质提取方法[21]加以改进。取已纯化的SC9和SC068有色体1 g, 加入1 mL提取缓冲液(0.1 mol L-1 Tris pH 8.0, 50 mmol L-1 DTT, 2% SDS, 5%蔗糖, 2%蛋白抑制剂), 室温涡混5 min, 加入等体积Tris-平衡酚, 涡混5 min。离心15 min (8300× g , 4℃), 将酚相转移至新离心管, 并加入提取缓冲液(不含蛋白抑制剂)涡混5 min。离心15 min (8300× g , 4℃), 加入5倍体积的饱和乙酸铵甲醇溶液, -20℃保存6 h以上。离心15 min (8300× g, 4℃), 重复3次。加入5倍体积丙酮清洗沉淀, 离心15 min (8300× g, 4℃), 以80%丙酮再次清洗, 离心, 氮气吹干, -20℃保存。
取已吹干的木薯有色体蛋白质样品, 加入蛋白质样品溶解液(9.5 mol L-1尿素; 2.0 mol L-1硫脲; 4% CHAPS; 1% DTT; 2.5 mmol L-1 EDTA; 2.5 mmol L-1 EGTA), 室温溶解1 h, 室温离心5 min (9500× g), 取上清液, 而后使用BSA试剂盒(Thermo, USA)对蛋白质溶液定量分析。
根据木薯有色体全蛋白质定量结果, 使用pH4-7、13 cm的预制IPG胶条(Immobiline DryStrip, GE Healthcare, 下同)。配制样品水化体系: 蛋白质样品 (300 μ g)、水化液(7 mol L-1尿素、2 mol L-1硫脲、3% CHAPS、0.5% Trixon-100)、IPG 缓冲液和溴酚蓝。在IPG泡涨盘(IPGbox, GE Healthcare)中水化10 h以上, 结束后使用等电点聚焦仪器(Ettan IPGphor3 GE Healthcare), 参考An等[21]的程序进行等电点聚焦。完成后将胶条置1% DTT和2.5% IAA分别平衡15 min, 再转移至分离胶浓度为12%的SDS-PAGE胶上端, 使用EPS 601电泳仪(GE Healthcare)进行第二向垂直电泳(100V 10 min; 160 V 300 min以上)。完成电泳后进行固定染色, 用Image Scanner扫描仪扫描。
采用胰蛋白液酶解差异蛋白质点, 采用MALDI-TOF-TOF-MS/MS 进行二级质谱鉴定。参照An等[18]的方法。比对数据库时, 参照设置如下: 数据库为NCBInr全库, 胰酶消化, 最大允许漏切位点为1, 二级质谱肽段质量精确度为0.5 Da。多肽带点情况为+1。
取SC6068与SC9块根各100 mg, 参照TIANGEN RNAprep Pure Plant Kit多糖多酚试剂盒说明书提取木薯块根总RNA。参照TaKaRa公司PrimeScript RT regant Kit with gDNA Eraser (Perfect Real-time)进行基因组去除及RNA反转录。
经差异蛋白质组学及蛋白质功能分析, 选取代谢途径网络核心的2个蛋白质, 即点4 (烯醇化酶Enolase 2)和点18 (延长因子elongation factor), 使用实时荧光定量PCR技术验证表达量的变化。Enolase 2蛋白质的特异引物为Enolase 2-F (5′ -GTCAGATCC TCCATCCCTTAG-3′ )和Enolase 2-R (5′ -GTTACCAT CGTCTCCGTCAG-3′ ), Elongation Factor蛋白的特异引物为Elongation Factor-F (5′ -GCTTTGTGCAGT TCTGTTATGA-3′ )和Elongation Factor-R (5′ -CAACA CGATACCTTTGAGCCT-3′ )。以木薯看家基因Actin为内参基因, 引物序列为Actin-F (5′ -TGATGAGTCT GGTCCATCCA-3′ )和Actin-R (5′ -CCTCCTACGACC CAATCTCA-3′ ), 依照TaKaRa公司的SYBR Prime Ex Taq试剂的要求混合反应液, 其中含SYBR Prime Ex Taq II 5 μ L, 上下游引物各0.5 μ L, cDNA模板1 μ L, dH2O 3μ L。PCR反应循环条件为94℃ 1.5 min, 94℃ 30 s, 59℃ 30 s, 72℃ 30 s, 40个循环; 绘制熔解曲线。以SC6068的表达量为1, 采用2-Δ Δ Ct分析SC9的基因表达量。每个处理3次生物学重复。
采用SPSS 22.0软件分析数据, 使用Image J软件分析Western blot条带, 用Microsoft Excel 2016软件绘图。采用Delta2D软件对SC9及SC6068有色体蛋白质图谱斑点检测, 对检测出的蛋白质斑点的总浓度均一化处理。
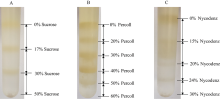
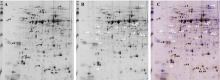
图2所示, 木薯块根有色体经三种密度梯度离心后都有比较明显的分层。其中蔗糖梯度分离法分离(图2-A)的有色体粗体物共有3层, 各条带间分层明显, 分别为0/17%、17%/30%和30%/50%, 但所分离的各梯度层颜色较淡。Percoll密度梯度离心法(图2-B)分离的有色体层共有5层, 分别为0/20%、20%/30%、30%/40%、40%/50%和50%/60%, 各梯度也有明显的分离层, 且梯度层间的颜色较深。
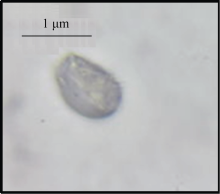
Nycodenz密度梯度离心法(图2-C)分离有色体粗提物共有4层, 分别为0/15%、15%/20%、20%/24%和24%/30%, 其中0/15%的梯度层有明显的深黄色条带, 而15%/20%的梯度层间分离不明显, 20%/24%和24%/30%的梯度层仅有细的淡黄色条带。光学显微镜下观察, 蔗糖密度梯度法和Nycodenz密度梯度法所分离的有色体大多破碎, 且含有其他细胞器结构。而Percoll密度梯度离心法分离的有色体比较完整, 其在40%/50%的梯度层间仅含有少量破碎的有色体。在光学显微镜下(图3)可以看到木薯块根的有色体具有膜结构包围, 主要积累晶状有色体。
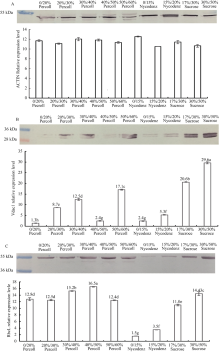
Western blot检测不同密度梯度离心法表明, 以看家基因Actin (图4-A)蛋白质表达水平作为内参, 均一化处理后, 质体标记抗体RbcL (图4-C)的杂交信号在Percoll梯度离心法的40%/50%梯度层间的含量最高, 对比其他层间达到显著水平, 表明有色体在该梯度得到高度富集。Nycodenz梯度法的杂交信号最低, 表明该方法所分离各梯度层中的有色体含量较少。蔗糖梯度法居中, 表明其在各梯度间也富集了部分有色体。相反, 在各梯度层检测不到或较少检测到其他亚细胞器标记蛋白的杂交信号。线粒体标记抗体Vdac1 (图4-B)在40%/50% Percoll DGCM梯度层中的杂交信号对比其他分离层含量较低, 对比其他梯度层达到显著水平。而蔗糖梯度分离法17%/30%与30%/50%梯度层中Vdac1的杂交信号最高, 表明其受到了线粒体的污染。而Nycodenz梯度分离法所分离的梯度层Vdac1杂交信号也较低。
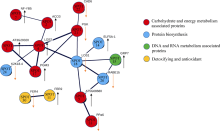
从双向电泳图谱(图5), 经Delta2D分析软件分析, 选取表达量差异为2.0倍[15]以上的蛋白质点34个(图5-C)。其中上调表达的蛋白质点为17个(图5-A, 用黑色箭头表示), 下调表达的蛋白质点17个(图5-B, 用白色箭头表示)。运用KEGG数据库鉴定出的蛋白质点按功能分为8类(表1)即碳代谢及能量代谢相关蛋白(12个, 蛋白质点1、2、3、4、5、7、8、17、21、22、33)、抗氧化及解毒蛋白(6个, 蛋白质点10、11、12、23、27、30)、氨基酸代谢蛋白质(3个, 蛋白质点9、24、31)、蛋白质生物合成蛋白(5个, 蛋白质点6、14、29、20、18)、分子伴侣蛋白(1个, 蛋白质点13)、DNA及RNA代谢相关蛋白质(1个, 蛋白质点15)、DNA结合蛋白质(1个, 蛋白质点19)及未知功能蛋白质(5个, 蛋白质点16、25、26、28、34)。其中, 碳代谢与能量代谢相关的差异蛋白质点所占比例最大(35.2%), 抗氧化及解毒的蛋白质(17.6%)其次。结合差异蛋白质点的相对表达量可以看到, 碳代谢与能量代谢、分子伴侣、DNA及RNA代谢相关蛋白在SC9块根有色体中大部分上调表达。而抗氧化及解毒、蛋白质生物合成、氨基酸代谢等在SC9和SC6068均有上调或下调表达。
 | 图5 SC9(A)和SC6068(B)块根有色体双向凝胶电泳及其叠加图(C)Fig. 5 2-DE images of the chromoplast global proteins from cassava storage roots of SC9 (A) and SC6068 (B), and their overlap map (C) |
| 表1 SC9与SC66068块根有色体差异蛋白质鉴定 Table 1 Identification of chromoplast differential proteins from cassava storage roots of SC9 and SC6068 |
34个差异蛋白质点中通过质谱分析(使用Phyto- zome及NCBI数据库比对), 得到匹配的28个蛋白质(点1、2、3、4、5、7、8、17、21、22、33、10、11、23、27、30、9、24、31、14、29、6、20、18、13、15、25和26)。通过String在线软件(http://www.string-db.org/)将其构建蛋白质互作调控网络, 并隐藏没有相互作用的蛋白质点。由图6得知共有16个蛋白质点建立18种互作关系, 连接线的粗细代表互作的强弱关系。其中互作最多的蛋白质是点4 (Enolase 2)与点18 (elongation factor, partial-Triticum aestivum), 均与6种蛋白质发生互作关系, 点4为上调表达, 点18为下调表达。其次为点21 (phosphoglycerate kinase, 下调)共与4种蛋白质有互作关系, 再次为点17 (phosphoglucomutase, 上调)、点20 (elongation factor Tu, chloroplastic-like, 上调)和点5 (ATP synthase beta subunit, 上调), 都与3种蛋白质发生互作。点1 (Starch phosphorylase, 上调)、点2 (aconitase, 上调)、点15 (glycine-rich RNA-binding protein)均与2种蛋白质发生互作。点24 (sensory transduction histidine kinase, 下调)、点7(ccaat-binding transcription factor subunit A, 上调)、点14 (initiation factor eIF5-A, 上调)、点33 (putative inorganic pyrophosphatase, 上调)、点22 (sinapyl alcohol dehydrogenase, 下调)、点30 (ferritin 2 precursor family protein, 下调)、点11 (ferritin, plant, putative, 上调)等仅与1个蛋白质点发生互作。
qRT-PCR显示, SC9的Enolase 2基因表达水平显著高于SC6068的表达水平, 为1.48倍, 与蛋白质组学的研究结果相一致。在转录水平上, SC9的Elongation Factor基因的表达量显著高于SC6068, 为其2.12倍, 但在差异蛋白质组学分析上, Elongation Factor在SC9中下调表达, 表达量仅为SC6068的0.42倍, 转录水平与蛋白质组学的研究结果相反。以SC6068作为对照, Enolase 2和Elongation Factor基因表达结果变化如图7所示。
类胡萝卜素具有抗氧化、预防肿瘤和心血管疾病的重要作用, 同时也是维生素A和植物激素ABA合成的前体物质, 对改良木薯的品质具有重要作用[4], 研究木薯块根有色体蛋白质表达谱的差异, 可为揭示块根类胡萝卜素的差异提供一定的理论基础。
细胞器的纯度及完整性是继续进行其蛋白质组学研究的关键, 提取分离方法决定了所得到亚细胞器结构的纯度和完整性[8, 9, 10, 11]。在柑橘、辣椒、番茄等植物中已有研究[14, 15, 16, 17], 首先将植物材料破碎差速离心获得有色体的粗提物, 再将粗提物用提取缓冲液稀释后平铺于Nycodenz、Percoll、蔗糖密度梯度液进行高速离心, 从而分离获得完整有色体。本研究显示, Percoll密度梯度离心法优于其他两种提取方法并能够从木薯块根中分离得到完整的有色体。蔗糖法的提取缓冲液所粗提得到的有色体含量较少, 原因是蔗糖密度梯度液中蔗糖分子是高渗透性分子, 在对木薯块根有色体分离的过程中造成渗透压的变化引起有色体的破裂, 破坏了有色体的完整性。Nycodenz梯度离心法与Percoll梯度离心法所用的提取缓冲液的配方一致。但Percoll法的20%-30%- 40%-50%-60% Percoll密度液能够较好地对有色体粗提物悬浮液进行充分分离, 提高样品分离率。光学显微镜观察发现有色体结构完整主要分布在40%~50%分离层的Percoll梯度层, 且此梯度间的样品经Western blot纯度检测, Vdac1的杂交信号要显著低于其他层间, 而有色体提取过程中极易混杂线粒体等细胞器[22], 表明该层有色体的纯度较高。而质体标记性抗体RbcL的杂交信号要显著高于各个Percoll分离层及其他分离方法, 表明有色体在该层间得到高度富集。
本研究以低类胡萝卜素含量的木薯品种SC6068为对照, 分析比较高类胡萝卜素的SC9块根有色体蛋白质变化, 鉴定得到34个差异蛋白质点, 分属8个不同的蛋白质家族, 其中包含碳代谢及能量代谢、氨基酸代谢、蛋白质合成等诸多代谢途径, 表明木薯块根有色体含有丰富的代谢途径, 这与鉴定得到番茄有色体蛋白质组的结果相近[14]。其中最多的差异蛋白质点属于碳代谢与能量代谢途径的蛋白质, 共有11个且大部分上调。表明有色体作为异养型质体存在一系列合成代谢途径, 并依赖于能量的供给来推动必要的新陈代谢活动[23, 24]。腺嘌呤核苷酸转运体能够跨膜转运ADP与ATP。膜的形成与扩增是有色体生物合成与发育的重要特征, 在异养型细胞器中, 腺嘌呤核苷酸转运体能够优先调节ATP进入质体中影响新陈代谢的强度, 能够提供额外的能量形成有色体膜结构进而促进有色体的发育[25, 26]。SC9与SC6068差异蛋白质点中的点7 (转运体相关蛋白)和点5 (ATP合成相关蛋白)都在SC9中上调表达, 可能与SC9有色体和类胡萝卜素含量高有关。最新的蛋白质组分析表明与ATP合成及转运体相关蛋白质为有色体中丰度最高的蛋白质, 表明能量产生及转运体在有色体中的重要性[27]。此外鉴定得到一个参与碳代谢的点4 (Enolase 2)参与互作的关系最多且在SC9中上调表达。该酶催化2-磷酸甘油酸脱水生成磷酸烯醇式丙酮酸, 而最终产物丙酮酸作为类胡萝卜素生物合成的前体物质参与了有色体代谢。本研究还进一步运用qRT-PCR技术在转录水平上对Enolase 2基因进行验证, 发现其表达量在SC9块根要显著高于SC6068。SC9中该酶的上调表达促进了类胡萝卜素前体物质在有色体积累, 这可能是造成SC9与SC6068差异的原因之一。
本研究鉴定的差异蛋白质点中有6个与蛋白质合成相关, 3个与氨基酸代谢相关, 1个与分子伴侣相关。分子伴侣蛋白作为质子通道复合体蛋白的成员, 能够对蛋白质前体的转运具有重要的作用[28], 此外, 也能够参与蛋白质的折叠与去折叠, 组装与去组装[29, 30]。本研究鉴定一个热激蛋白在SC9中上调表达, 而热激蛋白能够作为辅因子参与到质体的分化和发育, 并参与稳定质体中部分折叠或未折叠蛋白质的构象。其中, 鉴定到2个蛋白质生物合成的延长因子(点18、点20)能够参与蛋白质的降解, 这些降解酶形成的复合体能够驱动前体蛋白进入质体而后切除导肽[14]。不同发育时期或环境条件下, 质体的结构和生理功能都发生明显变化[31], 因此保持蛋白质合成与降解相对平衡对于有色体的稳定至关重要[32]。有研究表明, 此蛋白质定位在质体上且与质体的发育和分化密切相关, 该蛋白能够影响植物生长及质体的分化[33]。推测其在SC9中的下调表达可能与SC9质体中类胡萝卜素积累有密切的关系。但转录水平上, elongation factor基因表达与差异蛋白质组的表达水平相反, 是否是转录后修饰造成表有待进一步研究。
建立一种适合木薯块根有色体的提纯方法。Percoll密度梯度离心法适合木薯块根有色体的提取且提纯的有色体具有较高的完整性和纯度。差异蛋白质涉及到以下途径: 碳代谢与能量代谢、抗氧化及解毒、氨基酸代谢、分子伴侣、蛋白质生物合成等。其中碳代谢与能量代谢所占比例最高, 表明高类胡萝卜素品种与低类胡萝卜素品种间在存在能量代谢上的差异, 而类胡萝卜素合成的前体物质是由能量代谢的中间产物所提供。尤其是互作网络中的核心蛋白醛缩酶在SC9上调表达与质体分化相关的延长因子蛋白下调表达是造成类胡萝卜素差异的原因之一。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|