第一作者联系方式: E-mail:736935396@qq.com
种子脱水干燥是杂交水稻制种过程的一个重要环节,种子自然脱水速率慢, 遇雨天还易引起成熟期推后和穗发芽等问题。利用脱水剂快速降低种子水分对种子安全生产有重要意义。本研究以Y两优689杂交水稻品种为材料, 比较不同脱水剂对其制种种子脱水及种子质量的影响。11种脱水剂均能加快种子成熟后期脱水, 7号和9号脱水剂喷施后5 d, 种子水分分别下降4.6%和3.6%, 且对种子千粒重、发芽和幼苗生长无不良影响, 种子可溶性蛋白、可溶性糖、ABA和GA3含量则显著高于对照。种子室温贮藏6个月后, 与对照相比, 7号、8号和9号脱水剂处理对种子发芽和幼苗生长无显著影响, 7号和9号脱水剂处理的种子可溶性蛋白含量、α-淀粉酶活性、ABA含量与对照无显著差异。7号比9号的脱水效果好, 可作为Y两优689的脱水剂。种子贮藏前, 7号、8号和9号脱水剂处理能提高种子中 OsNECD1和 OsNCED2基因的表达, 降低 OsGA2ox1的表达; 而种子贮藏6个月后, OsNECD1和 OsNCED2表达量下降, OsCYP707A5和 OsGA2ox1表达量上升。这表明经过6个月贮藏, 脱水剂处理对种子ABA合成相关基因和GA3分解相关基因表达的影响减弱, 同时 OsCYP707A5的高表达导致种子ABA含量减少, 可能是种子贮藏后萌发力提高的主要原因。
Seed dehydration is very important in hybrid rice seed production. For seed production safety, dehydrating agents are used in this process because natural dehydration is slow and easily affected by rainy weather, which often results in seed late mature of and pre-harvest sprouting. In this study, the effects of different dehydrating agents on seed dehydration and quality were compared using hybrid rice variety “Y Liangyou 689”. The eleven dehydrating agents tested all accelerated seed dehydration. Particularly, agents No.7 and No.9 resulted in seed moisture content at five days after spray decreased by 4.6% and 3.6%, respectively, and had no negative effects on 1000-grain weight, seed germination and seedling growth. Moreover, both agents significantly increased the contents of soluble protein, soluble sugar, ABA and GA3 in seeds. After storage at room temperature for six months, agents No.7, No.8, and No.9 had no negative effects on seed germination and seedling growth as compared to the control. There were no significant differences in soluble protein content, α-amylase activity and ABA content among agents No.7, No.9 and the control. Agent No.7 was better in lowering seed moisture content than No.9, suggesting its potential use in Y Liangyou 689 seed production. Interestingly, agents No.7, No.8, and No.9 induced OsNECD1and OsNCED2 expressions and reduced OsGA2ox1 expression in seeds before storage. After six-month storage, the expressions of OsNECD1 and OsNCED2 decreased and the expression of OsCYP707A5 and OsGA2ox1 increased in seeds treated with agents No.7, No.8, and No.9. This result indicate that the effects of dehydrating agents on ABA biosynthesis genes and GA3 catabolism genes in seeds weakened during storage and the high expression level of OsCYP707A5 resulted in the decline of ABA content, which might be a main reason for better seed germination.
杂交水稻制种过程中种子自然脱水速率慢, 如遇多雨天气, 籽粒难以自然干燥, 易引起成熟期推后、穗发芽等问题, 直接影响种子质量, 增加种子加工成本。因此, 利用脱水剂快速降低种子水分对种子安全生产有重要意义。目前用于农作物的脱水剂主要有植物激素和部分除草剂(草甘膦、百草枯、敌草快等), 敌草快和百草枯属于触杀型除草剂, 通过抑制植株的光合作用, 使植株迅速枯死, 从而快速降低籽粒和植株的含水量[1]。陈轶等[2]以20%的敌草快作为水稻成熟时的脱水剂, 使籽粒水分下降5%, 从而有效降低后期水稻的干燥成本。郝洪波等[3]对立收谷、草甘膦和乙烯利等在谷类作物成熟后期的脱水作用研究发现, 立收谷脱水效果良好。目前, 对脱水剂的研究大多侧重于粮食生产的脱水效果, 对种子生产中活力的影响研究较少, 尤其在杂交水稻制种中的应用研究更为缺乏。前期我们研究敌草快和百草枯在杂交水稻钱优1号种子上的脱水效果, 筛选了合适的脱水剂[4], 但是不同的杂交水稻组合的脱水特性可能存在差异, 脱水剂处理后的种子质量经过贮藏后的变化情况也尚无报道。
本文结合国内外研究现状, 以Y两优689杂交水稻品种为材料, 研究了喷施不同脱水剂对种子水分、发芽与幼苗生长情况及种子贮藏后种子质量的影响。筛选出既能有效降低种子含水量又不影响种子质量的适宜脱水剂, 并研究了施用脱水剂对发芽相关基因表达的影响。
杂交水稻籼型品种组合Y两优689 (Oryza sativa L.)的母本和父本种子, 均由浙江农科种业有限公司提供。
1.2.1 栽培方法与药剂施用 2015年, 在浙江大学紫金港校区农场制种。父本第1期于2015年5月22日播种, 6月15日移栽, 第2期于2015年5月29日播种, 6月22日移栽, 秧龄期均控制在25 d以内。2期父本与1期父本按1:1比例移栽, 株距24 cm。母本于2015年6月23日播种, 7月13日移栽, 秧龄期均控制在20 d以内。母本适当密植, 为15 cm (株距) × 18 cm (行距), 每穴5株。采用11种脱水剂处理(表1), 以清水处理为对照, 于F1种子蜡熟末期(2015年9月26日)喷施, 每处理重复3次, 每个重复的小区面积8.55 m2。在脱水剂喷施后的第3、第5、第7天从田间取样, 取一部分种子用聚乙烯袋包装带回实验室测定种子水分; 另取一部分种子用冰袋保存带回实验室, 液氮冷冻后, -80℃冰箱保存, 用于测定种子的内源激素含量; 剩下的种子用网袋包装, 悬挂在网室内通风晾晒至水分平衡, 用于测定种子千粒重、种子发芽、幼苗生长等指标。种子晾晒至安全水分以下, 用牛皮纸袋包装在室温下贮藏, 贮藏6个月后, 测定种子发芽、幼苗生长、可溶性糖、可溶性蛋白、内源激素含量和相关基因表达量等指标。
| 表1 11种脱水剂的成分和用量 Table 1 Components and dosages of 11 dehydrating agents (g hm-2) |
1.2.2 种子水分和千粒重测定 参照《农作物种子检验规程》(GB/T 3543.6-1995), 采用二次烘干法测定种子水分。待水分平衡后随机数取1000粒称重, 3次重复, 计算种子千粒重。
1.2.3 种子发芽测定 种子经0.1% NaClO溶液消毒15 min后用清水洗净[5], 选用规格为12 cm × 18 cm的发芽盒发芽, 每盒100粒种子为1次重复, 每个处理3次重复, 将种子置20℃/30℃光照培养箱中, 16 h光照/8 h黑暗24 h交替, 每天统计发芽种子数, 分别在发芽第5天和第14天计算发芽势和发芽率。于统计发芽率当天, 随机选择每个处理10株幼苗, 测定其鲜重, 然后将幼苗置105℃烘箱保持30 min, 再调整温度至80℃保持24 h, 取出放干燥器冷却后测定其干重。根长和苗高均为10株幼苗平均值, 每个处理3次重复。并根据每天发芽数计算发芽指数和活力指数。
发芽指数GI = ∑ (Gt/Tt), 活力指数VI=GI× S
式中, Gt为第t天的发芽种子数, Tt为与Gt相对应的发芽天数, S为10株正常幼苗的干重(g)。
1.2.4 种子生理生化指标测定 采用蒽酮比色法测定可溶性糖含量[6]。采用考马斯亮蓝G-250染色法测定可溶性蛋白含量[7]。采用3, 5-二硝基水杨酸法测定α -淀粉酶活性[8]。
1.2.5 种子激素含量测定 参考秦国臣的方法[9]。称取1 g水稻种子, 加液氮研成粉末, 加6 mL冷乙腈, 密封放入4℃冰箱浸提24 h, 12 298 × g (4℃)离心10 min, 取上清液, 再向残渣中加4 mL冷乙腈, 低温超声振荡1 h, 12 298 × g离心10 min, 取上清液, 重复提取2次, 合并3次上清液, 在35℃下用氮气吹干, 加入3 mL 0.1 mol L-1 pH 8.0磷酸缓冲溶液, 放入-80℃超低温冰箱中冰冻30 min, 在4℃条件下解冻, 12 298 × g离心15 min, 过滤弃去杂质, 用0.5 mol L-1盐酸调节至pH 3.0~3.5, 再用等体积的乙酸乙酯萃取3次, 合并酯相, 在35℃条件下氮气吹干, 用流动相定容至1 mL, 溶液经0.45 μ m的微孔滤膜过滤后用高效液相色谱仪测定(型号2487, Waters)。
1.2.6 种子基因的相对表达量测定 取100 mg的水稻种子采用GK类RNA提取试剂盒(Waryong, 北京)提取RNA, 利用NanoDrop 1000分光光度计检验RNA浓度和纯度后, 添加RNase free H2O调节浓度至200 ng mL-1, 然后将所提RNA反转录为cDNA, 以水稻β -OsActin基因作为内参基因, 进行qRT-PCR, 采用Primer 5软件设计引物, 反应体系含5× SYBR Green Mix 10 μ L, 10 μ mol L-1特异性正向引物和反向引物各1 μ L, cDNA模板2 μ L, 补水至20 μ L, 程序为95℃预变性30 s, 95℃变性5 s, 60℃退火20 s, 72℃延伸30 s, 进行40个循环。目的基因扩增的特异性经熔解曲线分析和琼脂糖凝胶电泳确认。
将试验所得百分率数据进行反正弦转换, 用SAS软件进行方差分析和多重比较(α = 0.05, LSD)。
| 表2 采用实时荧光定量PCR所用的引物序列 Table 2 Primer pairs of genes for quantitative RT-PCR |
脱水剂喷施后3 d, 1号、2号、3号和11号脱水剂处理的种子水分比对照显著下降, 其余7种脱水剂处理的种子水分与对照比无显著下降, 所有脱水剂处理的种子千粒重与对照无显著差异(表3)。脱水剂喷施后5 d, 所有脱水剂处理的种子水分均显著低于对照, 其中1号脱水剂处理下降7.4%, 脱水效果最明显, 10号和11号脱水剂处理下降最少, 分别下降2.4%和2.3%。除1号、3号和6号脱水剂处理外, 其余处理的种子千粒重与对照无显著差异。脱水剂喷施后7 d, 除了4号、5号、8号和9号处理的种子水分与对照没有显著差异外, 其余7种处理的种子水分均比对照显著下降。2号、5号、7号、8号、9号和11号脱水剂处理后, 种子千粒重与对照无显著差异, 其余5种处理的种子千粒重显著低于对照。
| 表3 不同脱水剂处理对杂交水稻Y两优689种子水分和千粒重的影响 Table 3 Effects of different dehydrating agents on seed moisture content and 1000-grain weight of Y Liangyou 689 hybrid rice |
脱水剂喷施后5 d, 4号、5号、6号、7号和9号脱水剂处理的种子发芽率和发芽势与对照无显著差异。6号、7号和9号脱水剂处理的种子发芽指数和活力指数与对照无显著差异, 说明6号、7号和9号脱水剂处理对种子发芽无显著影响(表4)。脱水剂喷施后7 d, 1号、4号、5号和9号脱水剂处理的种子发芽率和发芽势与对照无显著差异。4号、5号、6号、8号和9号脱水剂处理的种子发芽指数和活力指数与对照无显著差异, 说明4号、5号和9号脱水剂处理对种子发芽无显著影响。
| 表4 不同脱水剂处理对杂交水稻Y两优689种子发芽率、发芽势、发芽指数和活力指数的影响 Table 4 Effects of different dehydrating agents on germination percentage (GP), germination energy (GE), germination index (GI), and vigor index (VI) of Y Liangyou 689 hybrid rice seeds |
脱水剂喷施后5 d, 11号脱水剂处理的种子幼苗苗高和根长显著低于对照, 其余10种脱水剂处理的幼苗苗高和根长与对照无显著差异(表5)。11号脱水剂处理的幼苗鲜重显著低于对照, 干重与对照无显著差异, 其余10种脱水剂处理的幼苗干鲜重与对照无显著差异。说明除了11号脱水剂, 其余10种脱水剂处理对幼苗生长无显著影响。脱水剂喷施后7 d, 3号、4号、5号、6号、7号、8号、9号和10号脱水剂处理的幼苗苗高和根长与对照无显著差异。2号脱水剂处理的幼苗干重显著低于对照, 其余10种脱水剂处理的幼苗干重与对照无显著差异。1号、2号、6号和10号脱水剂处理的幼苗鲜重显著高于对照, 其余7种脱水剂处理的幼苗鲜重与对照无显著差异, 说明3号、4号、5号、6号、7号、8号、9号和10号脱水剂处理对幼苗生长无显著影响。
| 表5 不同脱水剂处理对杂交水稻Y两优689幼苗根长、苗高、苗干重和苗鲜重的影响 Table 5 Effects of different dehydrating agents on root length (RL), shoot height (SH), fresh and dry weights (SFW, SDW) of Y Liangyou 689 hybrid rice seedlings |
脱水剂喷施后5 d采收的种子贮藏6个月后, 4号、5号、6号、7号、8号和9号脱水剂处理的种子发芽率和发芽势与对照无显著差异, 4号、5号、6号、7号、8号和9号脱水剂处理的种子发芽指数和活力指数与对照无显著差异, 说明4号、5号、6号、7号、8号和9号脱水剂处理的种子贮藏6个月对种子发芽无显著影响(表6)。脱水剂喷施后7 d采收的种子贮藏6个月后, 6号、10号和11号脱水剂处理的种子发芽率和发芽势显著低于对照, 其余8种脱水剂处理的种子发芽率和发芽势与对照无显著差异。8号和9号脱水剂处理的种子发芽指数和活力指数与对照无显著差异, 说明8号和9号脱水剂处理的种子贮藏6个月对种子发芽无显著影响。
| 表6 不同脱水剂处理的Y两优689种子贮藏6个月对种子发芽率、发芽势、发芽指数和活力指数的影响 Table 6 Effects of different dehydrating agents on germination percentage (GP), germination energy (GE), germination index (GI) and vigor index (VI) of Y Liangyou 689 hybrid rice seeds after storage for 6 months |
脱水剂喷施后5 d采收的种子贮藏6个月后, 5号脱水剂的幼苗根长显著高于对照, 苗高与对照无显著差异, 3号、4号、6号、7号、8号和9号脱水剂处理的幼苗苗高和根长与对照无显著差异(表7)。11号脱水剂处理的幼苗鲜重显著低于对照, 其余10种脱水剂处理的幼苗干鲜重与对照无显著差异, 说明3号、4号、5号、6号、7号、8号和9号脱水剂处理的种子贮藏6个月对幼苗生长无显著影响。脱水剂喷施后7 d采收的种子贮藏6个月后, 3号、6号、7号、8号、9号和10号脱水剂处理的幼苗苗高和根长与对照无显著差异。4号、6号、7号、8号和9号脱水剂处理的幼苗干鲜重与对照无显著差异, 说明6号、7号、8号和9号脱水剂处理的种子贮藏6个月对幼苗生长无显著影响。
| 表7 不同脱水剂处理的Y两优689种子贮藏6个月对幼苗根长、苗高、苗干重和苗鲜重的影响 Table 7 Effects of different dehydrating agents on root length (RL), shoot height (SH), fresh and dry weights (SFW, SDW) of Y Liangyou 689 hybrid rice seedlings after storage for 6 months |
综合上述结果, 脱水剂喷施后5 d, 种子水分下降明显, 种子千粒重比喷施后3 d明显提高, 但是比喷施后7 d差异不明显, 因此认为脱水剂喷施后5 d是合适的收获时间。脱水剂喷施后5 d, 7号、8号和9号脱水剂脱水效果比较明显, 种子水分分别下降4.6%、4.3%和3.6%, 种子发芽率和发芽势较高, 且3种脱水剂处理与对照的种子千粒重无显著影响。此外, 除了8号脱水剂处理降低了种子发芽势外, 3种脱水剂处理对种子发芽和幼苗生长无不良影响。种子室温贮藏6个月后, 3种脱水剂处理的种子活力和幼苗生长与对照无显著差异。为了深入研究脱水剂处理对种子的影响, 后续试验选用7号、8号和9号脱水剂处理后5 d采收的种子进行激素、基因表达等测定。
种子贮藏前, 7号、8号和9号脱水剂处理的种子可溶性糖和可溶性蛋白含量均显著高于对照(图1), 8号处理的种子可溶性糖最高, 达到107 mg g-1。7号和9号处理的种子可溶性糖含量其次, 分别为102.9 mg g-1和102.3 mg g-1。9号处理的种子可溶性蛋白含量最高, 达到1.34 mg g-1。种子贮藏6个月后, 3种脱水剂处理的种子可溶性糖和可溶性蛋白含量均高于对照, 其中9号处理的种子可溶性糖含量达到显著水平。与贮藏前相比, 3种脱水剂处理的种子贮藏后可溶性糖和可溶性蛋白含量均下降。
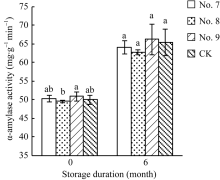
种子贮藏前, 3种脱水剂处理的种子α -淀粉酶活性与对照无显著差异(图2), 但贮藏后种子的α -淀粉酶活性显著高于贮藏前的种子。
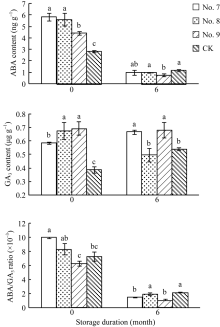
种子贮藏前, 7号、8号和9号脱水剂处理的种子中ABA和GA3含量显著高于对照(图3), 其中, 7号处理的种子ABA含量最高, 9号处理的种子GA3含量最高。8号和9号处理的种子ABA/GA3值与对照无显著差异, 7号处理的种子ABA/GA3值显著高于对照。种子贮藏后, 7号和8号脱水剂处理的种子中ABA含量与对照无显著差异, 7号和9号处理的种子GA3含量显著高于对照, 8号处理的种子GA3含量与对照无显著差异。7号和9号处理的种子ABA/GA3值显著低于对照, 8号处理的种子ABA/GA3值与对照无显著差异。
种子贮藏前, 7号、8号和9号脱水剂处理的种子中ABA合成相关基因OsNECD1和OsNCED2的表达量显著高于对照, 而ABA分解相关基因OsCYP707A5表达量与对照无显著差异(图4-A, B, C)。种子贮藏后, 7号、8号和9号脱水剂处理的种子中OsNECD1基因表达量显著高于对照, 而OsNECD2基因表达量与对照无显著差异; 3种脱水剂处理的种子中ABA分解相关基因OsCYP707A5表达量显著高于对照。种子贮藏前, 7号、8号和9号脱水剂处理的种子中GA3合成相关基因OsGA20ox1和OsGA20ox2表达量与对照无显著差异, 7号、8号和9号脱水剂处理的种子中GA3分解相关基因OsGA2ox1表达量显著低于对照(图4-D, E, F)。种子贮藏后, 7号、8号和9号脱水剂处理的种子中OsGA20ox1和OsGA20ox2基因表达量与对照无显著差异, 8号和9号脱水剂处理的种子中OsGA2ox1基因表达量显著高于对照, 7号脱水剂处理的种子中OsGA2ox1基因表达量与对照无显著差异。
本试验喷施脱水剂后的2 d均为雨天, 导致喷施脱水剂后3 d采收的种子, 种子水分下降并不明显。其中11号脱水剂处理后的种子水分下降最多, 比对照下降2.2% (表3)。在喷施脱水剂后的3~5 d, 天气晴朗, 种子水分下降明显, 脱水剂处理后种子水分比对照下降2.3%~7.4%。在喷施脱水剂后的7 d是雨天, 种子采收时含有大量水分, 因此种子水分与喷施后5 d采收的种子比没有下降反而有所提高。喷施脱水剂后, 种子在5 d采收千粒重要显著高于3 d采收的, 但是7 d采收的种子千粒重相比于5 d采收的种子没有显著的上升。说明喷施脱水剂后5 d是一个合适的采收时间, 喷施后5 d收获, 种子水分下降明显且对产量影响较小。
植物体内糖含量越高, 新陈代谢越旺盛, 植物抵抗病原菌的能力就越强。糖也是植物感病后启动或加强磷酸戊糖途径的底物, 而磷酸戊糖途径的最终产物和中间产物是合成抗病性有关的次生代谢产物的前体。植物受到逆境胁迫时, 细胞内的可溶性糖浓度增加, 以提高植物细胞的抗逆性[10]。同时, 有研究指出水稻种子在成熟脱水后期, 种子内非还原性糖逐渐积累, 有助于种子获得脱水耐性[11]。7号、8号和9号脱水剂处理的种子可溶性糖和可溶性蛋白含量显著高于对照(图1), 这有助于种子获得脱水耐性以及增强抵抗脱水干燥损伤的能力。徐亮等[12]研究表明, 种子可溶性糖含量随着贮藏时间增加而不断下降, 种子中含有较高的可溶性糖和蛋白质有利于种子保持活力。本试验中, 种子贮藏6个月后, 脱水剂处理种子和对照种子的可溶性糖含量下降, 与前人研究一致。9号脱水剂处理的种子可溶性糖显著高于对照, 可溶性蛋白含量与对照无显著差异, 7号和8号脱水剂处理的种子可溶性糖和可溶性蛋白含量与对照无显著差异, 说明这3种脱水剂处理对种子的贮藏性无显著影响。
研究表明, α -淀粉酶活性与种子活力呈正相关[13, 14]。在本试验中, 8号脱水剂处理的种子α -淀粉酶活性下降(图2), 可能是引起种子发芽势降低的原因。7号和9号脱水剂处理的种子α -淀粉酶活性与对照无显著差异, 同时这2种脱水剂处理的种子活力与对照也无显著差异。种子贮藏6个月后, 3种脱水剂处理的种子α -淀粉酶活性相比贮藏前显著上升, 这与贮藏后种子活力提高相一致。
ABA和GA3是调控种子萌发的主要激素。在nced3、nced5、nced9、aba2、aao3等ABA合成缺陷的拟南芥突变体种子中, ABA的合成受阻, 其萌发速率明显快于野生型种子, 而NCED6和NCED9等过表达的拟南芥突变体种子发芽率明显降低[15]。此外, 有研究指出ABA与种子成熟脱水过程中获得脱水耐性密切相关[16], 且与贮藏养料的积累也有一定联系[17]。周可金等[18]用敌草快催熟油菜种子时, 认为敌草快引起种子ABA含量的上升是加快种子成熟的原因之一。本试验同样发现3种脱水剂处理的种子中ABA含量显著高于对照, 说明脱水剂能在内源ABA激素调控上促进种子成熟脱水(图3)。与ABA的抑制作用相反, GA3可促进种子萌发和幼苗生长。Shu等[19]研究表明, 在ga1等GA3合成缺陷的拟南芥突变体种子中GA3含量极低, 通过施加外源GA3后种子才能正常萌发。这与GA3促进禾谷类种子中淀粉酶的产生与释放以促进种子萌发密切相关[20]。稻谷贮藏后, 3种脱水剂处理的种子与对照种子中ABA/GA3值显著降低, 曹雅君等[21]发现水稻种子中ABA/GA3值降低, 种子萌发力加强。在本试验中, 同样也发现贮藏后种子中ABA/GA3值下降, 种子萌发力加强。
在水稻中, 有5个NCED家族基因, 3个CYP707A家族基因, 4个GA20ox家族基因和5个GA2ox家族基因, 其中OsNECD1、OsNCED2和OsCYP707A5被认为与水稻中ABA的合成代谢密切相关, 而OsGA20ox1、OsGA20ox2、OsGA20ox3和OsGA2ox1与GA3的合成分解密切相关[22]。贮藏前, 7号、8号和9号脱水剂处理的种子中OsNECD1和OsNCED2表达量均显著上升, OsCYP707A5则与对照无显著差异(图4), 种子内ABA明显升高。3种脱水剂对种子中GA3合成基因OsGA20ox1和OsGA20ox2的表达量影响与对照无显著差异, 但是显著降低了GA3分解基因OsGA2ox1的表达水平。贮藏6个月后, 3种脱水剂处理的种子OsNECD1和OsNCED2表达量下降, 但仍明显高于对照, OsCYP707A5和OsGA2ox1表达量有所上升, 且明显高于对照。表明种子经过贮藏, 脱水剂处理对种子ABA合成相关基因和GA3分解相关基因表达的影响减弱。同时, OsNECD1、OsNCED2表达下降, 而OsCYP707A5表达升高, 导致种子ABA含量下降, 可能是种子贮藏后萌发力加强的主要原因, 3种脱水剂对种子基因表达的影响趋势一致。
种子贮藏后, 3种脱水剂处理的种子发芽率、发芽势和α -淀粉酶活性显著上升, 而可溶性蛋白和ABA含量与对照无显著差异, 表明脱水剂对种子的影响在贮藏一段时间后减弱。其中, 8号脱水剂脱水效果良好, 达到4.3%, 但是种子中α -淀粉酶活性及种子发芽势显著低于对照。9号脱水剂对种子发芽及幼苗生长均没有不良影响, 但脱水效果与7号和8号相比较差。7号脱水剂脱水效果良好, 达到4.6%, 且对种子质量没有影响, 因此7号脱水剂被认为是Y两优689杂交水稻制种成熟后期合适的脱水剂。
杂交水稻Y两优689制种蜡熟末期, 喷施不同脱水剂能降低种子水分。其中以7号脱水剂效果最好, 喷施后5 d, 种子水分比对照下降4.6%, 种子千粒重、发芽和幼苗生长与对照无显著差异, 种子可溶性蛋白、可溶性糖、ABA和GA3含量显著高于对照。种子室温贮藏6个月后, 发芽和幼苗生长以及种子可溶性蛋白含量、α -淀粉酶活性、ABA含量与对照无显著差异。种子中OsCYP707A5的高表达导致种子ABA含量减少, 可能是种子贮藏后萌发力提高的主要原因。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|