第一作者联系方式: E-mail:trungduchanh@gmail.com
采用桶栽方式, 对抗旱性强的F172和抗旱性弱的YL6甘蔗品种在苗期进行重度干旱胁迫处理后, 应用蛋白质双向电泳技术进行差异蛋白质分析, 分别找出差异显著的28和20个差异蛋白点, 其中部分呈现上调表达, 部分呈现下调表达, 还有部分新增的蛋白点, 因品种抗性不同而表现各异, F172叶片中的差异蛋白主要表现为上调表达, 而YL6中大多表现为下调表达。在重度干旱胁迫下, 抗旱性不同的甘蔗品种蛋白质丰度变化有显著差异。采用MALDI-TOF-TOF/MS鉴定所获得的差异蛋白, 从YL6、F172中分别鉴定出18、14个蛋白的氨基酸序列, 对所鉴定的蛋白质根据功能分为8类。YL6中参与自由基清除的2个, 参与光合作用的6个, 参与细胞生长和分裂的1个, 参与基础代谢的6个, 参与防卫反应的2个, 未知功能蛋白1个。F172中参与自由基清除的1个, 参与光合作用的2个, 参与细胞生长和分裂的2个, 参与基础代谢的4个, 参与信号转导的2个, 参与蛋白加工的1个, 未知功能蛋白2个, 其中22 kD干旱诱导蛋白的丰度明显提高, 而在YL6中则检测不到此蛋白。这说明在干旱胁迫下抗旱性不同的甘蔗品种在蛋白质组成上有很大差异, 推测这是不同甘蔗品种间抗旱性差异的重要分子基础。
Drought stress is a major restraint in sugarcane production in China. Proteomic study in relation to drought stress provides valuable information in drought resistant breeding of sugarcane. In this study, the drought-resistant sugarcane variety, F172, and the drought-sensitive variety, YL6, were used in a pot experiment for differential proteome analysis. Seedlings of both varieties were exposed to severe drought stress for seven days and the leaf proteins were separated and analyzed using 2-DE technique and PDQuest software. From the protein profiles of F172 and YL6, 28 and 20 differential protein spots were detected between normal-irrigation and drought-stress treatments, respectively, including up- and down-regulated proteins and new protein spots. The differential proteins varied across the two varieties. Using MALDI-TOF-TOF/MS, 18 and 14 amino acid sequences were identified from YL6 and F172, respectively, and they were in eight function categories. In YL6, the 18 proteins consist of two participating in oxygen radical scavenging, six participating in photosynthesis, one participating in cell growth and division, six participating in basic metabolisms, two participating in protective response, and one unknown in function. In F172, the 14 proteins consist of one participating in oxygen radical scavenging, two participating in photosynthesis, two participating in cell growth and division, four participating in basic metabolisms, two participating in information transfer, one participating in protein processing, and one unknown in function. A drought-induced protein of 22 kDa was in high level in F172 but absence in YL6. These results indicate that protein compositions under drought stress are highly different in sugarcane varieties with different drought resistance and the differential proteins might give a hint to drought-resistant mechanism.
甘蔗是世界上也是中国最重要的糖料作物和能源作物。中国的蔗糖产量占食糖总产的90%以上。中国大陆的80%以上甘蔗种植在缺乏灌溉条件的旱坡地上, 而干旱是限制甘蔗产量的重要因素[1]。
蛋白质组(Proteome)是指基因组表达产生的所有蛋白质, 即细胞、组织或机体全部蛋白质的存在及其活动方式[2]。运用蛋白质双向电泳技术和质谱鉴定技术, 可大量研究逆境胁迫后蛋白质组的变化。迄今, 已经获得了大量的差异蛋白并进行了功能研究[3, 4, 5, 6, 7, 8]。
蛋白质组学的研究已经广泛应用到各种植物中。在缺水条件下, 植物蛋白的含量和种类会发生变化, 有的蛋白丰度不变, 有的蛋白丰度增加, 有的蛋白丰度降低, 或者有新的蛋白合成[9, 10]。但是, 有研究表明, 比起蛋白的增加或新蛋白的出现, 干旱更容易引起蛋白含量的减少或丢失[10]。Xiao等[11]研究了不同来源的2个青杨种群受干旱胁迫后的蛋白质变化情况, 用质谱分析成功鉴定出40个干旱响应蛋白, 这些蛋白的功能涉及到多个方面, 其中抗氧化酶、HSPs以及次生代谢调控相关的蛋白等对青杨的抗旱能力起了重要作用。Salekdeh等[9]用干旱处理2个水稻品种, 经双向电泳分析, 发现有42个蛋白点的表达量在干旱胁迫前后表现出显著变化, 推测2个品种之间的蛋白差异导致抗旱性显著差异。孙存华等[12]研究表明, 在中度干旱胁迫时, 藜叶有5个蛋白点的谱带明显加强; 在重度干旱胁迫时, 其中的2个蛋白点谱带增强, 但弱于中度干旱胁迫时的谱带。章玉婷等[13]在干旱与正常处理条件下研究马铃薯叶片表达差异蛋白质组, 经电泳图谱分析和质谱鉴定获12个差异蛋白点, 其中有保护马铃薯光合系统以及线粒体正常运转的酶类, 调节该植株对环境胁迫响应的信号传导以及调控其组织内N、C运输系统的功能蛋白, 这些蛋白在受到干旱胁迫时表达量均升高, 从而揭示出该类蛋白是马铃薯在干旱条件下产生的耐受相关蛋白。在甘蔗上, Su等[14]应用iTRAQ技术研究甘蔗与黑穗病互作的蛋白差异表达谱, 发现抗病和感病基因型中筛选出的与转录组关联的差异蛋白中, 与差异基因表达趋势相同的均为关联上调表达, 且其中近半数以上的关联差异蛋白与植物抗逆性密切相关, 如过氧化物酶、病程相关蛋白、葡聚糖酶、热休克蛋白和植物凝集素等。我们之前的研究发现, 在用10% PEG-6000进行水分胁迫的条件下, 抗旱性强的甘蔗品种ROC22中Drought inducible 22 kD protein和ATPase CF1 subunit beta蛋白的相对丰度高于抗旱性弱的甘蔗品种ROC16, 这2种蛋白有可能作为不同品种抗旱性标志蛋白[4]。
甘蔗抗旱蛋白质组研究以及甘蔗品种抗旱性的分子机制探索, 有望为甘蔗抗旱性鉴定和培育高产、优质、抗旱性强的甘蔗品种以及旱地甘蔗栽培技术研发提供重要的理论依据, 对甘蔗的生产实际具有重要的应用意义。本研究拟在对甘蔗进行干旱胁迫处理的基础上, 开展甘蔗抗旱蛋白质组学研究, 以期探索抗旱性不同的甘蔗品种对干旱胁迫的响应机制, 进而为利用基因工程改良甘蔗品种的抗旱性提供理论依据。
根据韦汉文等[15]和檀小辉等[16]的研究结果, 选取园林6号(简写YL6, 抗旱性弱)、台糖172 (简写F172, 抗旱性强) 2个甘蔗品种作为供试材料。在广西大学农学院甘蔗研究所的智能温室大棚内, 2012年4月21日桶栽单芽蔗茎, 桶的上径49.3 cm、下径34.5 cm、高34.4 cm, 每桶3个单芽的甘蔗茎段, 每个处理20桶。桶中装入配置的土壤(大田表土:河沙:牛粪 = 5:4:1), 每个桶的底部都钻3~5个直径为4 mm的圆孔防止积水, 每桶装约2/3桶的土壤。参考朱理环等方法[17]在苗期对2个甘蔗品种进行正常灌溉(CK)和重度干旱胁迫(停止供水7 d, 土壤含水量为7.5%~10.0%)。于干旱胁迫处理7 d后(2012年6月30日), 从每个品种的干旱胁迫处理和对照随机选取3株甘蔗, 分别在其+1叶(最高可见肥厚带叶)距肥厚带18 cm处剪取5 cm叶片, 放入冰盒中拿回实验室冰浴清洗, 剪成碎片在冰浴条件下快速磨样待测。
PROTEAN i12 IEF等电聚焦仪(Bio-Rad, USA)、Biorad Powerpac Universal 164-5070 (Bio-Rad, USA)、Bio-Rad Mini-PROTEAN Tetra Cell垂直电泳仪(Bio-Rad, USA)、Bio-Rad GS-800扫描仪(Bio-Rad, USA)、Dynamica Velocity 18R高速冷冻离心机(Dynamica, Australia)。
采用Bio-Rad Protean IEF cell等电聚焦系统, 17 cm IPG胶条。等电聚焦结束后分别用含2% DTT (平衡液1)和2.5%碘乙酰胺(平衡液2)的胶条平衡缓冲液(6 mol L-1尿素, 2% SDS, pH 8.8、0.375 mmol L-1 Tris-HCl, 20%甘油)平衡胶条各15 min。第2向电泳采用Bio-Rad大型垂直电泳系统和制胶模具, 分离胶浓度为12.5%。按Zhou等的方法[4], 第一步, 用固定液固定2 h, 然后用双蒸水洗3次, 每次5 min。第二步, 用敏化液敏化1 h, 然后用双蒸水洗3次, 每次10 min。第三步, 用银染液染色30 min, 然后用双蒸水洗3次, 每次1 min。第四步, 用显色液显色, 约5 min, 然后用冰乙酸终止反应10 min。
采用Bio-Rad GS-800扫描仪进行图像扫描, 保存图像。扫描仪分辨率为300 dpi, 对比度与亮度采用软件默认值。用PDQuest软件分析扫描图像, 寻找差异蛋白点。
采用4700串联飞行时间质谱仪(4700 Proteomics Analyzer (TOF/TOFTM) Applied Biosystems, USA)进行质谱分析, 激光源为355 nm波长的Nd:YAG激光器, 加速电压为20 kV, 采用正离子模式和自动获取数据的模式获取数据。获得的PMF采用基于质谱数据库和MOWOSE概率算法的蛋白质鉴定系统Mascot软件, 对一级和二级质谱数据综合分析, 设置NCBIInr和Uniprot蛋白质数据库(全部生物种类)检索参数, 数据检索方式为Combined (MS+MS/MS); 消化多肽的酶为胰蛋白酶, 设定Mowse Score大于65分的蛋白即为鉴定的蛋白。
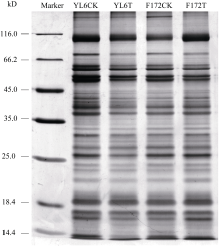
从图1可看出, 所提取的蛋白条带清晰, 处理与对照之间的蛋白丰度存在差异, 表明干旱胁迫后甘蔗叶片的蛋白表达有变化。并且所提取蛋白无杂质污染, 质量较好, 定量准确, 能较好地分离甘蔗叶片总蛋白, 可以用于双向电泳分析。
PDQuest软件对各个处理的电泳图谱分析显示, 3个生物学重复间的相似度较高, 平均匹配率为65%。在2个甘蔗品种的CK和重度干旱胁迫处理间分别找到差异显著的蛋白点28个和20个(图2和图3), 这些差异蛋白点的局部放大图见图4和图5。与CK相比, 两个甘蔗品种各差异蛋白点上调、下调情况见表1和表2。显示在YL6所分离到的28个蛋白中, 干旱胁迫处理后有15个下调表达, 7个上调表达, 新产生蛋白6个; 在F172所鉴定到的20个蛋白中, 干旱胁迫处理后有5个下调表达, 15个上调表达。
 | 图2 甘蔗品种YL 6幼苗叶片蛋白质的双向电泳图谱Fig. 2 2-DE profile for proteins from leaves of sugarcane variety YL 6 seedling |
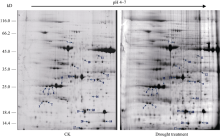 | 图3 甘蔗品种F172幼苗叶片蛋白质的双向电泳图谱Fig. 3 2-DE profile for proteins from leaves of sugarcane variety F172 seedlings |
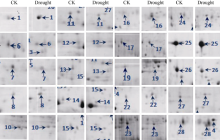 | 图4 甘蔗品种YL 6的差异蛋白质点的局部放大图Fig. 4 Enlarged pictures of the differential protein spots in sugarcane variety YL6 |
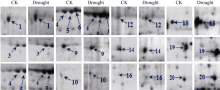 | 图5 甘蔗品种F172的差异蛋白质点的局部放大图Fig. 5 Enlarged pictures of the differential protein spots in sugarcane variety F172 |
| 表1 干旱胁迫后甘蔗品种YL6差异蛋白点的表达类型 Table 1 Expression modes of differential protein spots in sugarcane variety YL6 under drought stress |
| 表2 干旱胁迫后甘蔗品种F172蛋白差异点的表达类型 Table 2 Expression modes of differential protein spots in sugarcane variety F172 under drought stress |
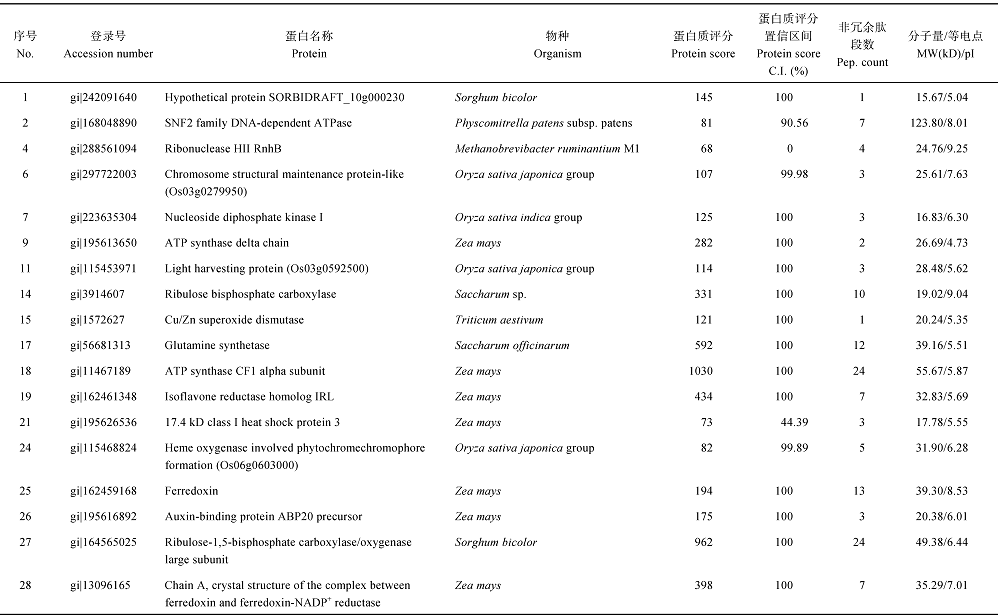
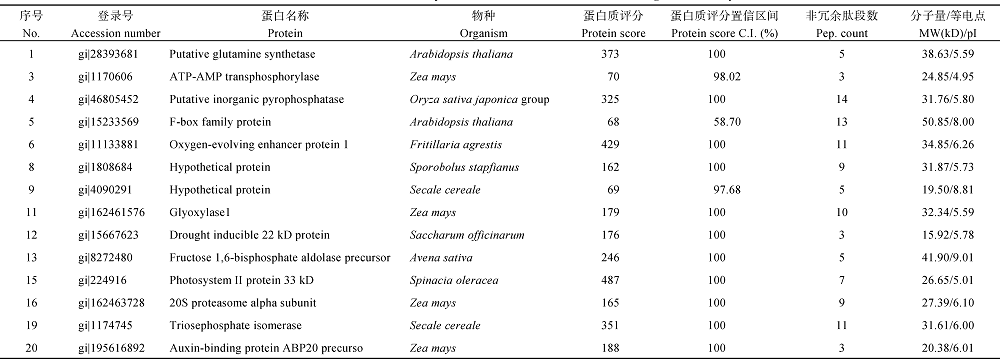
分别挖取YL6、F172甘蔗幼苗叶片2-DE凝胶28个和20个差异蛋白点进行(MALDI-TOF-TOF/ MS)分析, 通过MASCOT数据库对获得的数据信息进行搜索比对, Mowse Score大于65分的蛋白即为鉴定的蛋白。根据鉴定报告分别有18、14个差异蛋白鉴定成功, 鉴定率分别为64.3%和70.0% (表3和表4)。
| 表3 甘蔗品种YL6差异蛋白的MALDI-TOF-TOF/MS鉴定结果 Table 3 Identification of differential proteins with MALDI-TOF-TOF/MS in sugarcane variety YL6 |
| 表4 甘蔗品种F172差异蛋白的MALDI-TOF-TOF/MS鉴定结果 Table 4 Identification of differential proteins with MALDI-TOF-TOF/MS in sugarcane variety F 172 |
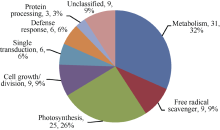
根据前人已鉴定的功能蛋白对鉴定的32个蛋白进行功能分类[18, 19, 20, 21, 22, 23], 可将它们分为8类(图6): (1)参与光合作用的10个蛋白中, 从YL6中鉴定出来的有6个, 包括Os03g0279950 (spot 6)、Os03g0592500 (spot 11)、二磷酸核酮糖羧化酶(ribulose bisphosphate carboxylase, spot 14)、Os06g0603000 (spot 24)、铁氧还原蛋白(ferredoxin, spot 25)、核酮糖-1, 5-二磷酸羧化/加氧酶大亚基(ribulose-1, 5-bisphosphate carboxylase/oxygenase large subunit, spot 27); 从F 172中鉴定出来的有2个, 为放氧增强蛋白1 (oxygen- evolving enhancer protein 1, OEE1, spot 6)和33 kD光系统II蛋白(Photosystem II protein 33 kD, spot 15)。(2)参与自由基清除的3个蛋白中, 从YL6中鉴定出来的有2个, 包括Cu-Zn超氧化物歧化酶(Cu/Zn superoxide dismutase, spot 15)、铁氧还原蛋白和铁氧还蛋白-NADP-氧化还原酶复合体晶体结构A链(chain A, crystal structure of the complex between ferredoxin and ferredoxin-NADP+ reductase, spot 28), 从F172中鉴定出来的有1个, 为乙二醛酶1 (Glyoxylase1, spot 11)。(3)参与防卫反应的2个蛋白仅在YL6中鉴定出, 分别为类异黄酮还原酶(isoflavone reductase homolog IRL, spot 19)和17.4 kD一级热击蛋白3 (17.4 kD class I heat shock protein 3, spot 21)。(4)参与基础代谢的10个蛋白中, 从YL6中鉴定出来的有6个, 包括DNA依赖性ATP酶(SNF2 family DNA-dependent ATPase, spot 2)、核糖核酸酶(ribonuclease HII RnhB, spot 4)、核苷二磷酸激酶(nucleoside diphosphate kinase I, spot 7)、ATP合酶δ 亚基(ATP synthase delta chain, spot 9)、谷氨酰胺合成酶(glutamine synthetase, spot 17)、ATP合酶CF1α 亚基(ATP synthase alpha subunit, spot 18); 从F172中鉴定出来的有4个, 包括推定的谷氨酰胺合成酶(putative glutamine synthetase, spot 1)、叶绿体腺苷酸激酶(Adenylate kinase, chloroplastic, spot 3)、磷酸丙糖异构酶(triosephosphate isomerase, spot 19)、果糖- 1, 6-二磷酸醛缩酶前体(Fructose 1, 6-bisphosphate aldolase precursor, spot 13)。(5)参与细胞生长分化的3蛋白中, 从YL6中鉴定出来1个, 为生长素结合蛋白ABP20前体(auxin-binding protein ABP20 precursor, spot 26); 从F172中鉴定出来2个, 为推定的无机焦磷酸酶(putative inorganic pyrophosphatase, spot 4)和生长素结合蛋白ABP20前体(spot 20)。(6)参与信号转导的2个蛋白均来自F172, 分别为F-box家族蛋白(F-box family protein, spot 5)和22 kD干旱诱导蛋白(drought inducible 22 kD protein, spot 12)。(7)参与蛋白加工的1个蛋白来自F172, 为20 S蛋白酶体α 亚基(20 S proteasome alpha subunit, spot 16)。(8)未知功能蛋白3个, 其中来自YL6的有1个, 为假定蛋白(hypothetical protein, spot 1); 来自F172的有2个, 为假定蛋白(hypothetical protein, spots 8 and 9)。
植物在遭受逆境胁迫后往往会诱导一些蛋白质的合成也会使一些蛋白合成受阻或被降解, 因而分析胁迫前后蛋白点的变化有望从蛋白水平上了解植物的抗逆机制[19, 20, 21, 22, 23, 24, 25, 26]。本研究利用蛋白质组学技术研究了干旱胁迫过程中不同抗旱性的甘蔗品种蛋白质组的变化。双向电泳分析结果表明, 抗旱性弱的品种YL6在干旱胁迫处理后所分离到的差异蛋白以下调表达为主, 而抗旱性强的品种F172在干旱胁迫处理后所分离到的差异蛋白以上调表达为主。从YL6和F172甘蔗品种中成功鉴定了32个干旱响应相关的差异蛋白, 涉及自由基清除、光合作用、细胞生长和分裂、新陈代谢、防卫保护、蛋白加工、信号转导等过程, 还有部分获得的蛋白是未知的假定蛋白。
本研究中, 在重度干旱胁迫下, 抗旱性不同的2个甘蔗品种均有蛋白质表达丰度的下调, 如YL6的Rubisco亚基(spot 27)、二磷酸核酮糖羧化酶(spot 14)、铜/锌超氧化物歧化酶(Cu/Zn SOD, spot 15)蛋白、铁氧还原蛋白(spot 25)、铁氧还蛋白-NADP-氧化还原酶复合体晶体结构A链(spot 28)、ATP合酶δ 亚基(spot 9)蛋白、核苷二磷酸激酶蛋白(spot 7)、类异黄酮还原酶(spot 19)、一级热激蛋白(spot 2)以及F 172的乙二醛酶(spot 11)等。同时, 抗旱性弱的品种YL6中下调的蛋白质种类和数量均明显多于抗旱性强的品种F172, 而且还出现多个新的蛋白点。在F172中, 没有检测到任何新的蛋白点, 且参与光合作用的相关蛋白放氧增强蛋白(spot 6)和系统II蛋白(spot 15), 参与代谢的相关蛋白果糖-1, 6-二磷酸醛缩酶前体(spot 13)和磷酸丙糖异构酶(spot 19)、腺苷酸激酶蛋白(spot 3)、谷氨酰胺合成酶(spot1)蛋白, 细胞生长和分裂相关蛋白无机焦磷酸酶(spot 4)和生长素结合蛋白ABP20前体(spot 20)蛋白, 参与蛋白加工相关蛋白20S蛋白酶体α 亚基(spot 16), 参与信号转导相关蛋白Drought inducible 22 kD protein的表达丰度均上调, 相比较而言, YL6中检出的18个蛋白只有参与代谢的相关蛋白ATP合酶CF1 α 亚基(spot 18)蛋白、谷氨酰胺合成酶(spot 17)以及细胞生长和分裂相关蛋白生长素结合蛋白ABP20前体(spot 26)出现上调。由此可见, 重度干旱胁迫对抗旱性弱的甘蔗品种YL6的伤害程度远大于抗寒性强的甘蔗品种F172, 这在蛋白质水平上得到充分表现, 其中绝大部分功能蛋白的表达丰度明显降低, 推测正是这不可避免地降低了甘蔗品种光合作用和清除氧自由基的能力[27, 28, 29, 30, 31], 进而严重影响甘蔗体内新陈代谢的正常进行和对干旱胁迫的防卫功能[32, 33, 34, 35]。
20S蛋白酶体是一种不依赖ATP及泛素的蛋白酶, 由α 和β 这两种亚基构成。它是26S蛋白酶体中的20S催化颗粒, 是蛋白酶体的重要组成部分, 在基因转录、细胞周期调节、蛋白质降解等各种细胞生理过程中具有重要作用[36, 37]。也有研究表明蛋白酶体α 亚基表达量上调, 能有效减轻水稻镉胁迫下细胞内各种异常的或受损的蛋白质积累[38, 39], 从而增强水稻耐镉能力。本研究中, 在干旱胁迫的条件下, 抗旱性强的甘蔗品种F172中20S蛋白酶体α 亚基(spot 16)和Drought inducible 22 kD protein均上调表达, 推测蛋白酶体的增加有利于清除在干旱胁迫条件下产生的非正常蛋白, 从而增强甘蔗对低温胁迫的适应能力。22 kD干旱诱导蛋白是ASR中的一员。Sugiharto等[40]发现维管束鞘细胞中的Sodip22在甘蔗应答干旱胁迫的信号传递过程中起到重要作用, 这一过程受脱落酸的调节。Desclos等[41]发现油菜干旱诱导的22 kD蛋白同时具有水溶性叶绿素结合蛋白活性和胰蛋白酶抑制剂活性, 它能通过保持蛋白的完整性和正常的光合作用保护油菜幼嫩组织不受逆境的影响。在本研究中, 抗旱性强的甘蔗品种F172中Drought inducible 22 kD protein的相对丰度高于抗旱性弱的甘蔗品种YL6, 且在干旱胁迫后此蛋白在F172中上调表达而在YL6中下调表达, 这与我们以前用PEG-6000胁迫处理甘蔗所获得的结果是一致的[4]。
综上所述, 在干旱胁迫下, 抗旱性强的甘蔗品种F172叶片中与光合作用、自由基清除、新陈代谢、细胞生长和分裂、防卫反应、蛋白加工、信号转导等相关的蛋白主要表现为上调表达, 而抗旱性弱的甘蔗品种YL6中大多表现为下调表达, 这可能是他们之间抗旱性差异的重要分子基础, 可作为甘蔗抗旱分子育种的重要参考。
抗旱性强的甘蔗品种F172叶片中与光合作用、自由基清除、新陈代谢、细胞生长和分裂、防卫反应、蛋白加工、信号转导等相关的蛋白主要表现为上调表达, 而抗旱性弱的甘蔗品种YL6中大多表现为下调表达。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|