bHLH转录因子对植物生长发育、形态调控有重要作用, 为了研究 BoLH27基因在甘蓝叶片发育及形态建成中的调控功能, 本文以甘蓝品种519为材料, 克隆出转录因子 BoLH27基因。序列分析表明, 该基因含有一个795 bp的开放阅读框, 编码264个氨基酸, 具有一个保守的典型bHLH结构域。以农杆菌介导的遗传转化方法将正义 BoLH27基因导入甘蓝品种519中以增强表达, 通过PCR筛选出9株T0代转基因单株, 结合T2代单株的qRT-PCR分析表明, 筛选的转基因植株内 BoLH27基因的表达积累量明显高于野生型。试验基地隔离网内种植的转基因甘蓝表型明显, 主要表现为莲座期茎叶间距拉长、叶柄伸长以及植株茎和叶柄显示紫色, 植株叶片平展, 无向上向内卷曲趋势, 表明 BoLH27基因可能对甘蓝叶片发育有重要的调控作用。
bHLH transcription factor plays an important role in plant growth, development and morphological control. In order to explore BoLH27 gene regulatory function for leaf development and morphologic formation, the BoLH27 gene was cloned from cabbage ( Brassica oleracea L.) variety 519. Sequence analysis indicated that the length of BoLH27 gene was 795 bp, which encoded 264 amino acids. The BoLH27 protein contained conservative structure domains of the bHLH family. The sense BoLH27gene was transformed into cabbage variety 519 by Agrobacterium mediated method, PCR analysis exhibited that BoLH27was genetically transformed into nine individual plants, qRT-PCR analysis revealed that BoLH27 had higher expression level in T2 transgenic cabbage than in wild type. The phenotype at rosette stage of transgenic cabbage grown in the test base was obvious, showing elongated the stems and leaves, elongated petiole, purple stems and petiole, and flat leaves without upward inward curling trend. It suggested that BoLH27may play important roles in the control of leaves development.
bHLH (basic helix-loop-helix)转录因子家族是植物中最大的转录因子家族之一, 1989年Ludwig等[1]首次从玉米中分离出bHLH类蛋白质Lc (leaf colour), 证明该基因参与调控花青素合成。Ling等[2]在番茄中鉴定出bHLH类基因FER, 发现该基因调控番茄适应缺铁胁迫。Kiribuchi等[3]从水稻中分离出bHLH基因类RERJ1, 发现该基因通过茉莉酸信号途径响应干旱胁迫。拟南芥基因组中经测序鉴定发现的bHLH转录因子已经超过150个[4, 5]。bHLH 结构域约含50~60个氨基酸, 由碱性区域(basic region)和α 螺旋1-环-α 螺旋-2 (helix-loop-helix)组成, 其碱性区域通常能与基因启动子区域的E-Box和G-Box结合[6, 7, 8], 一些关键氨基酸位点通常保守, 13E-16R是结合下游基因启动子E-box的2个关键位点[9], Leu23是bHLH功能域形成同源或异源二聚体的关键位点[10]。
植物bHLH转录因子家族具有重要的生物学功能, 参与植物一系列的生命活动, 涉及生长发育[11, 12]、代谢调控[13, 14]以及对非生物胁迫的抗性等[15]。同样, 具有bHLH结构域的转录因子在叶片发育和形态建成中也有重要调控作用。SPATULA (SPT)是一种bHLH转录因子, 拟南芥中SPT功能缺失的突变体具有较大的子叶, 较长的下胚轴和较大的叶片, 而SPT的过表达则导致较小的子叶和叶片[16]。在拟南芥中利用PAtML1启动子超表达表皮细胞中特异表达的ABS5 (bHLH30), 能使植株形成叶片卷曲的表型[17]。金鱼草中发现一种cin突变体, 能编码具有bHLH结构域的TCP蛋白, cin突变体的叶片边缘区域过度生长, 逐渐使原本平展的叶片变得卷曲[18]。拟南芥中下调表达TCP3、TCP4、TCP10、TCP24四个基因能导致叶片变皱[19]。在拟南芥中增强表达TCP4基因会使植株早熟, 细胞增殖减慢, 叶片变小[20]。在拟南芥中下调表达TCP5、TCP13、TCP17三个基因会造成叶片变大, 邻近的叶片会扩张到叶柄区域[21]。2013年莫晓婷[22]在玉米中克隆到转录因子bHLH-4, 在拟南芥中超表达时植株呈现出矮化, 叶片数量增加, 叶片长宽比变大, 叶片及果荚皱缩。
本课题组前期利用转录组测序技术发掘在甘蓝519莲座期和结球期差异表达的基因, 从中选出在结球期上调表达的基因BoLH27。本试验克隆出BoLH27基因的编码序列, 进行了序列生物信息学分析, 通过农杆菌介导转化法将BoLH27转入甘蓝519, 令其超量表达, 并初步分析转基因植株表型, 以期为进一步探讨BoLH27基因在甘蓝叶片发育及形态建成中的调控功能和作用机制提供依据。
中晚熟结球性好的纯合稳定品种甘蓝519, 由西南大学十字花科研究所提供, 2013年9月将幼苗种于重庆歇马试验基地, 2014年9月将T0代幼苗种植在试验基地, 转基因甘蓝开花后, 单株人工自花授粉留种, 2015年9月种植经PCR鉴定的T1代9个株系, 每个株系30个单株, 2016年9月选取3: 1分离的T2代4个株系, 共种40株幼苗。2014年10月选取10株T0代8片叶的幼苗期叶片用于转基因植株的PCR鉴定, 2016年10月随机取3株T2代8叶片幼苗期的叶片(每株3片)用于转基因植株的荧光定量表达鉴定。
克隆载体pEASY-Blunt Simple购于北京全式金公司。根癌农杆菌EHA105菌株、载体pBL525和植物表达载体pCAMBIA1300为本实验室保存。
用植物总RNA提取试剂盒(天根, 北京)提取甘蓝幼嫩茎尖总RNA, 通过1.0%的琼脂糖凝胶电泳检测RNA的完整性, 之后利用反转录试剂盒(宝生物工程(大连)有限公司)将总RNA反转成cDNA用于基因克隆, 荧光定量取材部位为幼苗期叶片, 方法同上。
利用芸薹属数据库(http://brassicadb.org/brad/ index.php)和甘蓝数据库(http://www.ocri-genomics. org/bolbase/)查找同源序列, 结合前期课题组通过转录组测序获得的包含BoLH27的片段, 对比数据库, 得知转录组获得的片段包含完整的BoLH27, 根据序列的保守性运用Primer premier 6.0软件设计特异性扩增引物, 采用高保真酶PrimeSTAR Max DNA Polymerase (宝生物工程(大连)有限公司)从cDNA中扩增基因, 基因扩增所用引物klBoLH27见表1。PCR程序为98° C预变性1 min; 98° C变性20 s, 63° C退火15 s, 72° C延伸60 s, 35个循环; 72° C延伸10 min。将目的片段与克隆载体pEASY连接(全式金生物技术有限公司, 北京), 转化大肠杆菌DH5α 感受态细胞, 挑取阳性单克隆委托成都擎科梓熙生物技术有限公司测序。
| 表1 试验使用的引物 Table 1 Primers used in this study |
下画线为酶切位点。Sequences underlined indicate enzyme restriction site.
用EditSeq软件推导基因编码的氨基酸序列, 运用ExPASy (http://expasy.org/tools/)分析氨基酸的基本理化性质, 用在线网站Swiss-model (http://swissmodel.expasy.org/)、SMART (http://smart.embl- heidelberg.de/)、PROSITE (http://www.expasy.org/ prosite)预测蛋白质的二级结构、功能位点和保守结构域。在线预测跨膜结构(http://www.cbs.dtu. dk/services/TMHMM/)和信号肽(http://www.cbs.dtu. dk/services/SignalP/), 用在线网站WOLF PSORT (https://wolfpsort.hgc.jp/)进行亚细胞定位预测。用ClustalX软件进行多序列比对分析, MEGA6.0软件的邻接法构建系统进化树。
将酶切位点BamH I引入引物, 载体构建所用引物pcBoLH27见表1。用带有BamH I酶切位点的引物扩增BoLH27, 采用高保真酶PrimeSTAR Max DNA Polymerase (宝生物工程(大连)有限公司)。PCR程序为98° C预变性1 min; 98° C变性20 s, 62° C退火15 s, 72° C延伸60 s, 35个循环; 72° C延伸10 min。将全长BoLH27用BamH I单酶切, 连接载体pBL525同时用BamH I单酶切, 把BoLH27连接到载体pBL525上, 转化DH5α 后保存PCR检测正向插入的菌液, 提取质粒后用Hind III和EcoR I双酶切, 同样用Hind III和EcoR I双酶切植物表达载体pCAMBIA1300, 连接后转化DH5α , 双酶切验证后送公司测序进一步验证, 将构建正确的质粒命名为pC35S-BoLH27。采用农杆菌介导甘蓝的遗传转化方法, 利用根癌农杆菌EHA105菌株侵染甘蓝下胚轴。组培所用培养基参考何绍敏等[23]并做了修改, 甘蓝预培养基含MS+3 mg L-16-BA+0.25 mg L-1NAA+3%蔗糖+0.8%琼脂; 甘蓝筛选培养基含MS+3 mg L-16-BA+0.25 mg L-1NAA+5 mg L-1PPT+500 mg L-1Carb+3%蔗糖+0.8%琼脂; 甘蓝生根培养基含MS+0.25 mg L-1NAA+5 mg L-1PPT+500 mg L-1Carb+3%蔗糖+0.8%琼脂。筛选抗性植株在育苗室内培养成活后转入室外培养。
采用CTAB法提取转基因甘蓝叶片总DNA。采用Taq Master Mix (南京诺唯赞生物科技有限公司)进行PCR检测, 委托成都擎科梓熙生物技术有限公司对PCR产物测序。取3株T2代8叶片幼苗期的超表达转基因植株叶片(每株3片叶作为生物学重复) 提取RNA并反转录cDNA为模板, 参照SYBR Premix Ex Taq II (宝生物工程(大连)有限公司)试剂盒说明书进行荧光定量PCR, 配制20 μ L反应体系, 在荧光定量PCR仪CFX96 (Bio-Rad, 美国)上进行, 反应体系为1.6 μ L cDNA模板, 10 μ L SYBR Premix, 0.8 μ L正向引物, 0.8 μ L反向引物(表1中的qBoLH27), 加ddH2O至总体积20 μ L。定量PCR条件为95° C预变性30 s; 95° C变性5 s, 58° C退火30 s, 40个循环。以上反应每个样品的技术重复3组。采用非转基因甘蓝519作为参照比对超表达植株的BoLH27基因表达情况。
随机取T2代生长健壮的3个株系每株系3株24片叶的莲座期超表达转基因甘蓝, 从根部向上数第16片叶的叶柄处开始计数, 向上连续测量5片叶的叶柄长度, 测量这5片叶在主茎的叶柄着生点的间距, 并以同样物候期的未转化甘蓝519为对照。
以甘蓝结球期茎尖cDNA为模板, PCR扩增出约800 bp条带。经测序分析发现该cDNA序列长度为795 bp, 包含一个完整的编码框, 将其命名为BoLH27。推导的氨基酸序列见图1, 分子量为3.0 kDa, 理论等电点为4.82, 编码264个氨基酸。不稳定系数为57.47, 推测为不稳定蛋白, 亲水性为-0.583, 是亲水性蛋白。其二级结构由27.65%的α -螺旋、12.88%的β -折叠和59.47%的无规则卷曲构成。跨膜结构分析表明BoLH27为非跨膜蛋白, SignalP信号肽预测显示该蛋白不含信号肽。亚细胞定位预测结果显示其定位在细胞核。
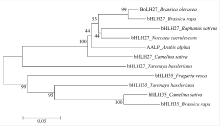
通过结构域和功能位点分析发现, BoLH27在50~99氨基酸处有一个典型bHLH结构域, 多序列比对发现, BoLH27所含的bHLH结构域具有保守的氨基酸位点(图2), 分别是13E-16R和Leu23, 13E-16R是结合下游基因启动子E-box的2个关键位点[9], Leu23是bHLH功能域形成二聚体的关键位点[10]收集其他物种BoLH27的同源序列, 通过ClustalX软件进行多序列比对后, 运用Mega6.0进行系统进化树的构建, 从图3可见BoLH27与白菜、萝卜、遏蓝菜bHLH27聚为一类; 醉蝶花、亚麻荠、白菜bHLH35聚为一类。与甘蓝BoLH27亲缘关系近的白菜、萝卜、遏蓝菜均为十字花科植物, 同科植物蛋白同源性较高, 基因很保守, 其中与白菜bHLH27亲缘关系最近, 推测其蛋白质有相似的功能。
甘蓝下胚轴在筛选培养基上经过3~4周的培养后, 少量获得抗性的下胚轴可以存活, 在切口脱分化形成愈伤组织, 将长出不定芽的材料(图4-A)多次转到新鲜的筛选培养基上继代培养, 直至不定芽长至3 cm时, 切下不定芽转至生根培养基上培养, 4~5周后长出白色的根(图4-B, C)。在育苗室内炼苗4~7 d后转入试验基地隔离网内栽种(图4-D)。
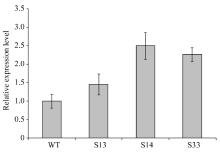
通过农杆菌转化法共获得34株BoLH27抗性植株, 在生长到8片叶的幼苗期时随机取10株植株, 以叶片为材料提取基因组DNA, 之后以基因组DNA为模板进行PCR检测, 以构建成功的正义载体作为阳性对照, 非转基因519甘蓝为阴性对照, 野生型中没有下游检测引物的NOS序列, 所以扩增不到产物。图5表明, 10株抗性甘蓝植株中的9株扩增到了预期的约1000 bp的条带, 只有10号和阴性对照没有检测到, 把PCR产物送擎科公司测序, 结果显示扩增序列与Nos和BoLH27基因片段序列完全一致, 说明植物表达载体已成功整合到转基因植株1~9号中。随后我们对目标基因的表达情况进行了荧光定量PCR检测, 从已经鉴定的成功转基因植株的T2代植株中随机选取3株在8片叶的幼苗期叶片进行荧光定量, 从图6看出, 3株超表达植株的BoLH27基因相对表达量均高于野生型, 最高为2.5倍, 平均为2.07倍。
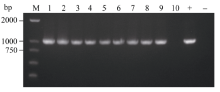 | 图5 转基因植株PCR检测 M: DL2000; 1~10: 转基因甘蓝; +: 阳性对照; -: 非转基因甘蓝。Fig. 5 PCR analysis of transgenic plants M: DL2000; 1-10: transgenic cabbage; +: positive plamid; -: non-transgenic cabbage. |
在10片叶幼苗期野生型甘蓝519的叶片呈卵圆形, 叶柄较短, 叶柄及叶脉均为白色, 基本没有叶耳(图7-A: WT); BoLH27超表达甘蓝的叶片呈椭圆形, 但具有缺刻, 叶柄明显拉长, 显示轻微的紫色, 叶柄上着生的叶耳明显, 叶耳多数左右对称分布(图7-A: BoLH27)。在24片叶莲座期野生型甘蓝519的叶片呈圆形, 叶片宽大, 叶柄急剧短缩, 几乎无叶柄, 叶脉为白色, 无叶耳(图7-C: WT); 转基因甘蓝的叶片呈椭圆形, 相比野生型更狭长, 叶柄伸长, 叶柄平均长15.5 cm (表2), 叶柄及叶脉明显变紫, 叶柄基部有叶耳及赘生物, 叶片平展(图7-C: BoLH27); 主茎呈紫色, 轮生叶在主茎着生点的间距比野生型明显变大(图7-B: BoLH27), 着生点的间距平均为1.7 cm (表2), 而野生型甘蓝519紧凑, 几乎没有间距(图7-B: WT)。
| 表2 超表达株系平均叶柄长度和平均叶间距 Table 2 Average petiole length and average leaf spacing in overexpressed lines |
截至目前有关bHLH转录因子家族的报道大多集中在拟南芥、玉米、水稻等模式作物上[7, 24]。本研究克隆获得了甘蓝BoLH27基因, 其蛋白包含典型的bHLH家族保守序列, 有碱性区域和α 螺旋1-环-α 螺旋-2, 与前人报道的一致[26, 27], 功能域关键氨基酸位点保守, 与前人报道的相同。包括结合下游基因启动子E-box的2个关键位点13E-16R[9], bHLH功能域形成二聚体的关键位点Leu23[10]。在系统进化中, 十字花科植物BoLH27较为保守。
研究表明, bHLH类转录因子在叶片发育和形态调控方面具有重要作用。HLH蛋白ILI1和PRE1能与bHLH蛋白IBH1结合, 在水稻中超表达IBH1基因能使叶片竖直生长; 在拟南芥中超表达该基因导致植株矮小[27]。ILI1和PRE1可能通过形成异源二聚体的方式使IBH1转录因子的抑制作用失活, ILI1或者PRE1的超表达能增加细胞的长度和抑制矮小的表型[27]。大豆隐花色素GmCRY2a基因与bHLH类型转录因子GmCIB1在蓝光下发生特异的相互作用, 在大豆中超表达GmCIB1基因使植株叶片早衰, 这种机制是由于GmCIB1能促进衰老相关基因GmWRKY53b的转录[28]。酵母双杂交证实转录因子bHLH048可以与LOB基因启动子区域相互作用[29], LOB蛋白在叶片近-远轴建立中起负调控作用, 超表达LOB基因会使叶形变小, 子叶和叶片向上向内弯曲[30]。TCP蛋白是一种具有bHLH结构域的蛋白, TCP7/23可能通过调控细胞增殖来调控叶片早期的发育, 酵母双杂交证实TCP7和TCP23可以相互作用, 并可强增KNOX1基因的表达, KNOX1基因在植物顶端分生组织的维持上有重要作用[31]。TCP1在拟南芥的超表达造成了叶柄和丛生叶的伸长, TCP1能和油菜素内酯合成的关键酶DWF4基因的启动子相互作用, 此外TCP1能正向调控DWF4的转录丰度[32]。在本研究中, 超表达BoLH27的甘蓝植株在幼苗期和莲座期均观察到了明显的叶柄伸长, 这与在拟南芥中超表达TCP1基因造成叶柄伸长的表型极为类似。在拟南芥中超表达miRJAW会降低TCP2/3/4/ 10/24五个TCP基因的表达, 进而使植株形成卷缩叶[33], 与之相似的是本研究获得的BoLH27基因超表达的甘蓝植株, 在莲座期后期其本应向上向内卷曲的叶片继续平展生长, 由此表明, 在甘蓝中BoLH27可能起到了类似与拟南芥中同为bHLH转录因子TCP2/3/4/10/24的功能, 在叶片卷曲过程中起负调控作用。
bHLH转录因子还可以调节类黄酮生物合成, 而花青素是类黄酮中的一大类。玉米中的Lc同源基因ZmR和ZmB参与紫色花青素合成的调节[34]。矮牵牛花中bHLH基因phan1和phan2能促进花青素合成基因的转录从而调控花的着色[35]。AtTT8是拟南芥中发现的调控类黄酮合成的bHLH转录因子, AtTT8的转录丰度受PAP1蛋白的负调控[36]。拟南芥中bHLH成员AtGL3和AtEGL3相继被发现, 在其双突变体中花青素的合成受到抑制[37]。在杨梅中发现了转录因子MrbHLH1, 通过烟草叶片的异源瞬时表达发现MrMYB1能与MrbHLH1结合从而引起花青素合成的显著增加, 用双荧光素酶报告基因检测的方法揭示了MrMYB1和MrbHLH1能够选择性地激活五种特异的启动子(MrCHI、MrF3’ H、MrDFR1、MrANS、MrUFGT)[38]。在十字花科植物花椰菜中发现一种Pr(Purple)突变体, Pr编码一种R2R3-MYB转录因子, 上调表达的Pr能特异地激活bHLH转录因子BobHLH1和几个花青素结构基因, 能在凝乳组织和其他组织中合成大量的青花素, 使突变体呈现显著的紫色表型[39]。与上述报道的情况类似, 本研究中通过在甘蓝519材料中超表达bHLH转录因子BoLH27基因, 使转基因植株的茎和叶脉呈现紫色(图7-B: partial; 图7-C: partial), 表明在甘蓝中BoLH27可能正向调控花青素的积累, 并在多序列比对中BoLH27和BobHLH1两者均具有高度保守的bHLH结构域(图2), 然而是该蛋白直接调控花青素积累相关的结构基因的表达, 还是与其他转录因子一起共同参与调控等问题还有待进一步研究。
从甘蓝519材料中克隆了一个bHLH转录因子BoLH27的编码序列, 该蛋白具有典型的bHLH结构域和完全保守的关键位点13E-16R和Leu23。获得了BoLH27超表达转基因植株, 转基因植物茎叶间距变大、叶柄伸长、叶耳明显、叶片平展生长, 且植株茎和叶脉呈现紫色, 推测BoLH27可能在甘蓝形态建成和花青素积累过程中有调控作用, 该研究对于进一步研究植物bHLH转录因子的功能具有一定的科学意义。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|