第一作者联系方式: E-mail: shijunqiong@163.com
叶色突变既可作为形态标记用于杂交稻育种, 又是研究光合系统的结构和功能、叶绿素生物合成及其调控机制的理想材料。EMS (ethyl methane sulfonate)诱变籼稻恢复系“缙恢10号”获得1个稳定遗传的黄绿叶突变体, 暂命名为 ygl6( yellow-green leaf 6)。前期我们通过图位克隆筛选出候选基因 Os12g23180, 通过遗传互补实验证实了黄绿叶基因 YGL6为 Os12g23180, BLASTp分析表明 YGL6基因编码NAD(P)-结合的Rossmann折叠超家族蛋白质, 属于短链脱氢酶/还原酶家族, 推断为异黄酮还原酶、糖脱水酶或mRNA结合蛋白。利用qRT-PCR进行表达模式的分析表明 YGL6基因仅在绿色组织如心叶、成熟叶、叶鞘和绿色颖壳中表达, 尤其以心叶的表达量最高, 同时 YGL6基因表达还受光照的诱导。构建亚细胞定位载体, 转水稻原生质体结果表明YGL6蛋白定位于叶绿体。本研究丰富了水稻突变体库, 为 YGL6基因的功能分析奠定了基础。
Leaf color mutants are used not only as morphological markers in hybrid rice breeding, but also as ideal materials in studies on the structure and function of photosystem, chlorophyll biosynthesis and regulation mechanism. A new rice mutant exhibiting stable inheritance was derived from ethyl methane sulfonate (EMS)-treated restorer line Jinhui 10 ( Oryza sativa), tentatively named as yellow-green leaf 6( ygl6). The ygl6 leaf displayed yellow-green at seeding stage, and pale green at jointing stages. The YGL6 complementation experiment implied that the Os12g23180 is the YGL6 gene. The expression pattern analysis indicated that YGL6 was expressed in green tissues including young leaves, mature leaves, sheaths and green glume, with the highest expression level in young leaves. And YGL6 expression was induced by light. Transient expression of the YGL6-GFP protein in rice protoplast showed that YGL6 was localized in chloroplasts. These results provide a foundation for functional analysis of YGL6.
水稻叶色突变是比较常见的, 突变基因往往直接或间接影响叶绿素的合成和降解, 从而影响水稻光合作用, 造成植株减产甚至死亡。近年来, 大量研究结果显示, 叶色突变体是植物光合作用机制、叶绿素生物合成途径、叶绿体的结构功能和遗传发育调控机理、作物标记性状等研究的理想材料[1, 2, 3]。
水稻叶绿素缺乏突变类型丰富, 目前已鉴定突变体90多个, 除第12染色体外, 其他染色体均发现了叶绿素缺乏突变基因(http://www.shigen.nig.ac. jp/rice/oryzabaseV4/)。虽然其大部分已被定位, 但仅少数被克隆, 它们分别参与叶绿素的生物合成、降解和叶绿体的发育[4, 5, 6, 7, 8, 9, 10, 11, 12]。叶色突变的机制复杂, 除叶绿素代谢和叶绿体发育引起外, 还有质-核信号转导途径受阻[13]、血红素的反馈调节紊乱[14]、光敏色素调控受阻[15]、叶绿体蛋白转运受阻[16]、ATP转运蛋白基因[17]等其他突变机制。随着新的水稻叶色突变体的发现, 叶色突变相关基因的分子机理研究将更加透彻。
叶绿体RNA结合蛋白是一类定位于叶绿体, 参与叶绿体RNA代谢的由核基因编码的蛋白。叶绿体RNA结合蛋白与细胞核或细胞质中的RNA结合蛋白具有类似的功能, 包括参与RNA的稳定和RNA转录后的加工过程等。此外, 叶绿体RNA结合蛋白对细胞核与叶绿体之间的信息传递和功能协调起重要作用。本研究利用EMS诱变恢复系缙恢10号, 从其后代中获得一份稳定遗传的黄绿叶突变体ygl6, 该突变体叶片在苗期呈黄绿色, 分蘖后期至成熟期转为淡绿色。图位克隆及测序结果表明Os12g23180为候选基因, 遗传互补实验证实黄绿叶基因YGL6为Os12g23180。根据gramene网站(http://www. gramene.org/)提供的信息, YGL6蛋白属于RNA结合蛋白类, 利用qRT-PCR分析表明YGL6基因仅在绿色组织如心叶、成熟叶、叶鞘和绿色颖壳中表达, 并受光照条件的诱导。构建YGL6与GFP的融合表达载体转化水稻原生质体发现YGL6与GFP的融合蛋白定位于叶绿体, 因此YGL6极有可能是叶绿体中的RNA结合蛋白, 并参与了水稻叶绿体的发育过程。本研究初步揭示了YGL6的基因功能, 为进一步研究奠定了基础, 并丰富了水稻突变体库, 深化了当前对叶绿体发育过程的研究。
黄绿叶突变体ygl6由EMS诱变缙恢10号 (Jinhui 10)所得, 经多代培养已遗传稳定。缙恢10号是西南大学水稻研究所选育的优良籼稻恢复系, 以其作为野生型对照。
由于pCAMBIA1301上的单酶切位点在YGL6基因的基因组DNA序列均存在, 并且扩增片段较长, 则采用重组酶的方法进行。引物6HBF1和6HBR2分别与载体pCAMBIA1301 BamH I和Hind III酶切后的片段有15 bp的重叠; 引物6HBR1和6HBF2有15 bp的重叠用于连接前后2个扩增片段的重叠片段。引物6HBF1、6HBR2、6HBF2、6HBR1的序列分别为5° -cggtacccggggatcAACATGGTCAGGCACA GTGATGAGAT-3° 、5° -AGATAGGAGATGGTAGCAG GAGGCTG-3° 、5° -TACCATCTCCTATCTCTGACTTC AGTAGTGC-3° 和5° -GGCCAGTGCCAAGCTGGTC AAGCTCCCTGGTGAGGCTAT-3° 。载体参照Shi等[18]的方法构建与转化。
参照Ren等[19]的方法分析YGL6蛋白的进化。
参照Shi等[18]的方法进行RNA的提取和纯化、cDNA的合成和qRT-PCR的表达分析。
以野生型、突变体和互补植株为材料, 上午9:00在种植小区中间随机选择长势相对一致的5个单株, 测定叶片中部的光合色素含量。称取0.1 g叶片剪碎装入离心管, 加25 mL丙酮∶ 无水乙醇(1∶ 1, v/v) 混合液封口暗处理24~48 h, 其间经常摇动, 每个样品重复3次。用分光光度计测定470 nm、645 nm和663 nm的光吸收值, 参考Lichtenthaler[20]的方法计算。
选择载体pTCK303为载体骨架, 其上的Ubiquitin为启动子, BamH I和SacI为双酶切位点。设计引物扩增YGL6基因的整个CDS片段, 前引物ATG前加入来自pTCK303 BamH I酶切后Ubiquitin侧15 bp, 后引物不含终止密码子。再设计1对引物扩增GFP基因的整个CDS片段, 前引物与YGL6的后引物有15 bp的重叠, 后引物加入来自pTCK303 SacI酶切后NOS侧15 bp碱基。引物6OEPF1、6OEPR1、6GFPF1和6GFPR1的序列分别为5° -tacttc tgcaggatcATGGCAGCAACAGCCTCCCT-3° 、5° -tcacc atgacgctgaCGAGCTTCTTGCC-3° 、5° -tcagcgtcatggtga GCAAGGGCGAGGA-3° 和5° -CAAATGTTTGAAC GGTTACTTGTACAGCTCGTCCATGCCG-3° 。参照Ren等[19]转水稻原生质体的亚细胞定位方法。
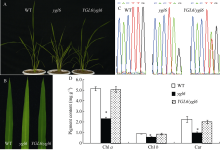
为了验证通过图位克隆筛选出的候选基因Os12g23180就是YGL6基因[18], 构建了基因组互补载体, 将野生型中Os12g23180基因组片段包括上游3500 bp、编码框和下游1500 bp序列利用重组酶整合到pCAMBIA1301表达载体中, 然后通过农杆菌介导法遗传转化突变体ygl6。在T0获得的转基因植株中, 共观察到12株转基因植株的突变体表型得以恢复(图1-A, B)。同时通过提取DNA后测序比对发现, 12株转基因植株在突变位点均出现了双峰, 证实互补载体成功转入突变体, 使其表型得以恢复正常(图1-C)。分析表明恢复表型的转基因植株的叶绿素a、叶绿素b和类胡萝卜素含量均达到了野生型的色素含量水平(图1-D)。
通过比对水稻基因组序列, 在其他位置未发现与YGL6基因高度相似的序列, 表明YGL6基因是单拷贝基因。利用NCBI网站对YGL6蛋白质BLASTp分析表明, YGL6基因编码NAD(P)-结合的Rossmann折叠超家族蛋白质, 属于短链脱氢酶/还原酶家族, 推断为异黄酮还原酶、糖脱水酶和mRNA结合蛋白等。YGL6蛋白质具有多个保守结构域, 如SDR-a1结构域、NAD(P)-结合位点、UDP-葡萄糖-4-异构酶C末端亚基、短链脱氢酶、RNA结合蛋白、NAD依赖的异构酶家族等。
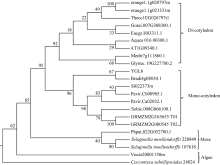
YGL6蛋白在网站gramene (http://www.gramene. org/)预测是一个RNA结合蛋白, 生物信息学分析该蛋白质定位于叶绿体, 系统进化树分析表明其与其他物种的叶绿体茎环结合蛋白聚类在一起。从系统进化中可以看出, 该基因属于高保守低拷贝, 从藻类、苔藓到高等植物均含有此蛋白, 并且藻类、苔藓、单子叶和双子叶植物各自组成一个分支(图2)。
通过qRT-PCR检测, YGL6基因在苗期除根外, 心叶、成熟叶和叶鞘中均有表达, 尤以心叶的表达量最高, 达到成熟叶的6倍多(图3-A); 在孕穗期, 仅在叶片和叶鞘中有表达, 在心叶的表达量最高; 在抽穗期的绿色颖壳中也有表达(图3-B)。以上结果表明YGL6基因在整个生育期的绿色部位表达, 尤以心叶的表达量最高。
对连续暗培养14 d的水稻幼苗光照处理表明, 随着光照时间的延长, YGL6基因的表达量不断上升(图4-A)。对连续光培养14 d的水稻幼苗进行黑暗处理表明暗培养0.5 h表达量下降, 但随后表达量逐渐上升, 在4 h时达到最大表达量, 随后逐渐下降, 在24 h时降到最低表达量(图4-B)。以上结果表明YGL6基因的表达受光照的诱导。
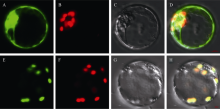
亚细胞定位分析网站(http://www.cbs.dtu.dk/ services/SignalP/)预测YGL6蛋白定位于叶绿体, 为了验证YGL6蛋白是否定位于叶绿体, 构建了35S-YGL6ORF-GFP和35S-GFP融合瞬时表达载体。将瞬时表达载体转化水稻原生质体, 用绿色荧光蛋白GFP做指示。结果表明, 在转35S-GFP原生质体, 除液泡外绿色荧光信号在整个细胞中均能观察到(图5-A~D); 而在转35S-YGL6ORF-GFP的原生质体中, GFP的绿色荧光信号(图5-E)和叶绿体自发的红色荧光信号(图5-F)重叠为黄色(图5-H), 说明YGL6蛋白定位在叶绿体。
在众多被鉴定的叶色突变体中, 仅有少数基因被克隆。叶绿素生物合成和叶绿体发育是一个相当复杂的过程, 目前已克隆的水稻叶色突变基因直接或间接影响叶绿素代谢或者叶绿体的发育。直接参与编码叶绿素合成与降解的酶基因有编码镁离子螯合酶H、D和I亚基的OsCHLH[7]、OsCHLD和OsCHLI[11]基因, 叶绿素酸酯氧化酶基因OsCAO1、OsCAO2[8], 叶绿素合成酶基因ygl1[12]。调控叶绿体发育的基因有鸟苷酸激酶基因virescent-2[9, 10], 三角状五肽重复蛋白基因OsPPR1[21], 叶绿体RNA聚合酶基因OsRpoTp[22]等。此外已成功克隆出的叶色相关基因还有持绿突变体基因SGR (stay green rice)[23], 叶绿素b还原酶基因NYC1(non-yellow coloring1)[24], 叶绿素b还原酶的同源基因NYC1-LIKE[25]等。通过图位克隆和基因互补实验表明YGL6基因是一个位于第12染色体的SDR超家族基因, 虽然目前已发现的叶色突变相关基因有90多个, 但在第12染色体鲜有叶色突变的报道, Shi等首次报道了ygl6突变体[18], 本研究证实了YGL6是一个调控叶色突变的基因。
最近有研究表明, 叶绿体有不同的RNA池, 其中有些RNA被翻译, 而其他的并不被翻译[26]。细菌RNA转录后即被翻译, 剪切、RNA编辑、内含子剪接等转录后加工在细菌中较少存在[27]。然而, 叶绿体的初级RNA产物均需要不同形式的转录后加工[28]。细菌的多顺反子直接进行翻译, 而叶绿体的多顺反子需要进一步剪切产生更小的多顺反子或单顺反子RNA, 有些还需要进一步的剪切或编辑产生成熟的RNA[28, 29]。多数质体RNA的成熟需要低特异性的核酸酶, 加工的程度通常由RNA结合蛋白和RNA的二级结构决定[28, 29]。叶绿体RNA代谢需要数量众多的RNA结合蛋白的参与, YGL6具有mRNA结合结构域, 亚细胞定位结果显示YGL6蛋白定位于叶绿体。综合上述结果可以确定YGL6基因是一个新的调控水稻叶绿体RNA代谢的基因, 有助于更进一步理解和完善水稻叶色突变的机制。
利用NCBI网站(https://www.ncbi.nlm.nih.gov/)对YGL6蛋白质BLAST分析表明, YGL6基因编码NAD(P)-结合的Rossmann折叠超家族蛋白质, 属于一个短链脱氢酶/还原酶家族 (short-chain dehydrogenase/reductase, SDR), 多数被鉴定的SDR被推断为异黄酮还原酶、糖脱水酶和mRNA结合蛋白等。Baker等研究表明菠菜一个mRNA结合蛋白CSP41和核苷-糖异构酶及羟类固醇脱氢酶同源[30]。CSP41是一类分子量为41 kD的叶绿体茎环结合蛋白, 目前已对多个物种的CSP41进行了克隆和功能分析。最早报道的CSP41a在体外可以结合到petD mRNA的3° 末端, 具有序列特异的茎环结构结合能力和核酸内切酶活性[31]。随后研究表明, CSP41蛋白也在质体编码的RNA PEP (plastid-encoded polymerase)或者质体核糖体中存在, 可能参与RNA的转录或翻译过程[32, 33]。但最近的研究却不能证实CSP41是PEP复合物的一部分[34]。研究表明CSP41缺乏已知的核酸内切酶基序, 但属于SDR超家族, 实验表明SDR基序可能是新类型的核酸内切酶基序[35]。CSP41的蛋白功能具有多样性, 并且已报道的CSP41蛋白均来自其他物种, 在水稻中尚无报道。水稻究竟行使以上的哪种或哪几种功能, 还是其他的未知功能, 以及YGL6蛋白质是否为CSP蛋白, 需要进一步的相关实验探究。
黄绿叶基因YGL6为Os12g23180, 与其他物种的叶绿体茎环结合蛋白聚类在一起。YGL6基因仅在绿色组织如心叶、成熟叶、叶鞘和绿色颖壳中表达, 尤其以心叶的表达量最高, 其表达还受光照的诱导。YGL6蛋白被定位于叶绿体。我们认为YGL6通过蛋白产物的RNA结合功能参与叶绿体的发育过程。本研究为进一步研究YGL6的基因功能奠定了基础, 并丰富了水稻突变体库, 深化了当前对叶绿体的发育过程的研究。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|