为探讨
The aim of this study was to understand the role of
小麦全蚀病是由禾顶囊壳小麦变种( Gaeumannomyces graminis var. tritici )引起的一种小麦根部土传病害, 可造成小麦减产40%~60%[1]。在我国河南、河北、陕西、内蒙古、山东、宁夏、甘肃等多个麦区均有发生, 目前已成为河南、山东、陕西、河北等地小麦优质高产的严重威胁。选育和种植抗病小麦品种是防治全蚀病最有效、最直接的途径[2], 但迄今, 常规育种中还没有抗全蚀病小麦品种的相关报道。采用转基因技术培育抗全蚀病小麦新种质成为拓宽小麦全蚀病抗源的重要途径。
ERF转录因子即乙烯答应因子, 是具有单个ERF/AP2 DNA结合域的调控蛋白。一些ERF转录因子与植物抗病反应有关,如超量表达拟南芥 ERF1 的转基因拟南芥植株对坏死营养型真菌和土传病原菌的抗性显著提高[3]。中间偃麦草ERF转录因子基因 TiERF1 受病原菌诱导, 该基因转入烟草后提高了植株对烟草赤星病菌和烟草花叶病毒的抗性[4]。现已发现 TiERF1 具有正向调控防御反应的作用, 其过表达可以提高转基因小麦对纹枯病抗性[5]。几丁质酶可通过水解真菌菌丝生长点初生细胞壁中的几丁质, 引起真菌细胞壁变薄, 导致真菌细胞溶解, 从而达到抑菌的效果。Anuratha等[6]从接种立枯纹枯菌( Rhizoctonia solani )的水稻中分离出的一个几丁质酶基因 RC7 , Datta等[7]将 RC7 转入水稻, 发现 RC7 超量表达显著提高了转基因水稻对纹枯病的抗性; 刘宝业等[8]通过体外抑菌实验证明 RC7 基因表达产物可显著抑制水稻纹枯病菌、小麦纹枯病菌、小麦赤霉病菌、棉花黄萎菌、烟草赤星菌的菌丝生长。为了增强转基因小麦的抗病效果, 我们构建了 TiERF1 和 RC7 双价基因的表达载体pTiERF1-RC7, 并通过基因枪法将 TiERF1-RC7 基因转入小麦(张增艳等未发表)。本试验对转 TiERF1-RC7 双价基因小麦进行分子检测和全蚀病的抗性鉴定, 并对其抗性机制进行初步探讨。
转基因小麦的受体为小麦推广品种扬麦18 (江苏里下河农业科学研究所程顺和院士提供)。转 TiERF1-RC7 扬麦18的T2代和T3代10个株系。小麦全蚀病菌( Gaeum annomyces graminis var. tritici , Ggt )由西北农林科技大学植保学院提供。
采用改良的CTAB法[9], 从T2至T3代植株叶片中提取基因组DNA。
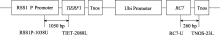
根据转基因载体pTiERF1-RC7 (图1)的序列, 设计2对特异引物(RC7-U/TNOS-23L和RSS1P-1038U/TIET- 2088L)用于检测 RC7 和 TiERF1 基因, 预期扩增片段分别为260 bp和1050 bp。RC7-U (5′-GGCAACCTCGACTG CTACAA-3′)位于 RC7 读码框3′端, TNOS-23L (5′-TGTA TAATTGCGGGACTCTAAT-3′)位于Tnos终止序列上; RSS1P-1038U (5′-CATCCCCAACCAGTCCTTTT-3′)位于RSS1P启动子序列上, TIET-2088L (5′-CTCGGTAGTGC TTCCCCCT-3′)位于 TiERF1 序列上[10]。
利用TRIZOL试剂(Invitrogen)提取PCR阳性植株和未转基因扬麦18的叶片总RNA, 纯化后采用RNA kit ver.3.0 cDNA合成试剂盒(TaKaRa)合成第1条链cDNA。以小麦cDNA为模板, 利用小麦 actin 基因(ActA: 5′-CA CTGGAATGGTCAAGGCTG-3′, ActB: 5′-CTCCATGTC ATCCCAGTTG-3′)进行模板均一化; 然后用 TiERF1 特异引物(TIE1-317U: 5′-CGTCGTGCTTCGGTTTCCT-3′, TIE1- 743L: 5′-TCGCCTCTCTTCCTTCTTTT-3′)和 RC7 特异引物(RC7Q-649U: 5′-ATCGGGGTGGACCTGCTGA-3′, RC7Q- 855L: 5′-GCCGTTGACGATGTTGGTG-3′)进行半定量RT-PCR 分析。
1.4.1 苗期人工接种鉴定 利用PDA培养基在25℃下培养小麦全蚀病菌12~15 d, 待菌丝布满培养基后切成直径 1 cm的圆形菌饼, 按照Penrose[11]菌饼法接种。小麦种子经1% H2O2消毒24 h并催芽, 待露白后将其接入菌饼, 置含灭菌沙的塑料盆中, 并用细沙覆盖, 每2~3 d浇水一次, 保持沙子湿润。每盆接种5粒, 在人工气候培养箱中培养28 d (18~22℃、12 h光照), 然后按0~6级记录反应型。其中, 0级为无病; 1~6级分别为黑根面积占总根面积的<5%、5%~10%、11%~25%、26%~40%、41%~65%和66%~100%。
1.4.2 田间成株抗病鉴定 选出苗期花盆鉴定出的抗性好的转 TiERF1-RC7 基因小麦10个株系T3代植株及其受体对照, 单株播种, 每株系30个单株进行全蚀病病圃鉴定。参照高小宁等[12]的方法制备接种体, 将谷粒与水按照1.0∶1.5的比例置1000 mL锥形瓶中, 连续3 d高压灭菌1 h, 待冷却后在无菌操作室中接种小麦全蚀病菌。接种后, 室内放置培养4周晾干备用。
在西北农林科技大学全蚀病专用病圃(陕西杨凌)进行田间鉴定。每小区10行, 行长1.5 m, 播种深度15 cm; 每行均匀播撒6 g上述接种体, 小麦种子每行30粒, 间隔5 cm; 同时设受体感病对照(未转基因扬麦18), 小麦生长期的管理与大田一致。以苗期死苗率及成株期的死亡率和白穗率反映其抗病性。
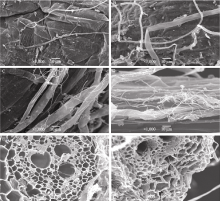
选择室内鉴定抗性好的转基因小麦材料和感病对照各8粒, 经消毒、催芽后, 按苗期室内鉴定方法接种小麦全蚀病菌, 分别在接种后的48、60和120 h切取穿过菌饼的幼根7~8段, 每段长约7 mm; 用4%戊二醛固定24 h, 再经CO2干燥和喷金处理, 于SEM6360LV扫描电镜下观察菌丝及小麦细胞生长情况。
在T2和T3代植株中, 特异引物PCR检测出10个转 TiERF1-RC7 双价基因小麦株系, 这些转基因株系均呈现260 bp ( RC7 )和1050 bp ( TiERF1 基因)的预期扩增片段, 而未转基因的受体扬麦18无此扩增条带(图2-A, B)。抗病T3代植株中目标基因的阳性检出率是100%, 说明这10个T3代株系中外源转 TiERF1-RC7 基因已基本纯合。
选择5个全生育期抗病的转基因株系T3代植株进行半定量RT-PCR分析, 结果这些植株中 TiERF1 与 RC7 基因的转录水平均明显高于未转基因扬麦18 (图2-C)。
苗期人工接种鉴定结果表明, 转 TiERF1-RC7 基因小麦T2代10个株系的各项抗病指标均好于受体扬麦18。对T3代转 TiERF1-RC7 基因小麦的10个株系继续鉴定, 其抗性显著增强, 其反应等级均在1~2级, 根部、茎基部的感病程度明显减轻, 且根系长度和根系面积均显著大于受体扬麦18 (表1)。说明转基因小麦苗期的抗病性显著高于受体小麦, 并增强了转基因小麦根系的生长势。
| 表1 转基因小麦及其对照苗期对全蚀病的抗性评价 Table 1 Resistance evaluation of transgenic wheat to take-all disease at seedling stage |
在病圃抗性鉴定中, 受体扬麦18苗期死苗率达30%, 成株期死亡率达45%, 白穗率达26.09%; 而5个转基因株系的苗期死苗率为15%~25%, 成株期死亡率为20~30%, 白穗率为0.00~12.5%, 均显著低于受体扬麦18 (表2), 说明在整个生育期中转基因小麦对全蚀病抗性均显著提高。
| 表2 病圃中转基因小麦材料的全蚀病抗性评价 Table 2 Resistance evaluation on transgenic wheat to wheat take-all disease at nursery (%) |
以感病受体扬麦18为对照, 转基因株系10ZGY-92为试材, 进行全蚀病菌侵染过程的电镜对比分析。接种全蚀病病菌48 h, 根表面形成了平行菌丝, 菌丝数量较少, 且匍匐于根细胞表面, 没有侵入到皮层细胞, 10ZGY-92根细胞表面上菌丝比感病受体的菌丝细(图2-A, B), 说明抗性好的材料中菌丝生长更慢。在接种60 h小麦根部细胞表面布满大量菌丝, 且多缠绕在根毛周围, 说明根毛是菌丝侵入皮层的重要途径, 同样看到10ZGY-92中的菌丝数量明显少于感病对照(图3-C, D), 菌丝侵入感病受体的皮层细胞, 且菌丝形成“∧”形。接种120 h感病受体的中柱层已有菌丝出现(图3-E), 说明此时菌丝已经进入中柱, 这与刘常宏和商鸿生[13]的研究结果一致, 而10ZGY-92的中柱中并未发现菌丝(图3-F)。
小麦全蚀病菌是由根到茎依次侵染的, 侵染后根系的发育情况也可以说明不同小麦材料对全蚀病的耐病性。因此, 本研究依据温室接种后小麦材料的黑根面积、总根面积、严重度(黑根面积与总根面积的比值)[14]、黑茎面积、黑茎率等指标鉴定苗期的抗病性, 并结合病圃评价小麦苗期、成株期抗性, 同时对导入转 TiERF1-RC7 基因小麦进行分子检测及利用扫描电镜观察病原菌丝情况, 进一步探讨了转 TiERF1-RC7 基因小麦抗全蚀病机制。
本研究表明, 转入的 TiERF1 和 RC7 基因在10个转基因小麦株系中可以遗传, 并显著提高了转基因小麦株系苗期对全蚀病的抗性; 这10个转 TiERF1 和 RC7 基因小麦株系的苗期反应型均在2级以下, 而受体扬麦18的反应型等级为5级; 在病圃抗性鉴定中, 其中5个株系 (10ZGY-15、10ZGY-49、10ZGY-92、10ZGY-113和10ZGY- 152)的苗期死苗率、成株期死亡率和白穗率均显著低于受体扬麦18对照。对这5个株系抗病植株中 TiERF1 与 RC7 基因的RT-PCR分析表明, 这些转基因植株中 TiERF1 与 RC7 基因的转录水平明显高于未转基因小麦扬麦18。扫描电镜(SEM)表明, 全蚀病菌的侵入部位大多集中在根毛区, 少数从茎侵入, 这与王裕中等[15]及郝祥之等[16]的报道结果相同; 抗病转基因小麦根表附着的全蚀病菌丝明显少于感病小麦的, 且在同一时期抗病转基因小麦根表的菌丝更细。上述结果说明, 转 TiERF1-RC7 基因的转录表达抑制了全蚀病菌侵入与发育, 从而提高了转基因小麦对全蚀病的抗性。
致谢:
衷心感谢中国农业科学院作物科学研究所徐惠君研究员、庄洪涛、李钊和祝秀亮等研究生在载体构建、转基因小麦材料创制与早代(T0和T1)分子检测工作中的贡献。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|