NAD(P)-苹果酸酶催化苹果酸氧化脱羧, 产生丙酮酸和CO2, 伴随NAD(P)的还原。在C4植物中, 苹果酸酶参与了C4光合作用。本研究对克隆的双子叶C4植物籽粒苋NAD-苹果酸酶基因(
The NAD(P)-malic enzyme (NAD(P)-ME) found in many metabolic pathways catalyzes the oxidative decarboxylation of L-malate, which results in producing pyruvate, CO2 and NAD(P)H. In C4 plants, NAD(P)-ME plays a key role in photosynthetic carbon fixation. This study was aimed to characterize the AhNAD-ME in dicotyledonous C4
苹果酸是植物代谢过程中的重要中间产物。苹果酸酶(malic enzyme, ME) 在金属离子Mn2+或Mg2+的存在下, 催化苹果酸氧化脱羧生成丙酮酸和CO2, 伴随产生还原性物质NAD(P)H, 调控植物体内的呼吸作用和脂类生成[ 1, 2]等重要代谢途径, 对于保持植物细胞的渗透势、稳定细胞质的pH值[ 3]、维持根系的离子吸收平衡、调节果实成熟和风味形成[ 4]、应对生物和非生物逆境胁迫[ 5, 6]等方面起重要作用。在C4植物中, 苹果酸酶催化叶肉细胞的苹果酸脱羧释放出的CO2被核酮糖-1,5二磷酸羧化酶/加氧酶(Rubisco)重新固定进入Calvin循环, 产生的丙酮酸再生为磷酸烯醇式丙酮酸(PEP), 使C4途径得以循环。CO2的释放提高了Rubisco周围的CO2浓度, 抑制了Rubisco的加氧功能, 提高了CO2固定效率[ 7, 8, 9]。
根据辅酶因子的不同, 苹果酸酶分为NAD依赖型(NAD-malic enzyme, NAD-ME)和NADP依赖型 (NADP-malic enzyme, NADP-ME)。根据在细胞和组织中的分布, NAD(P)-ME分为细胞质型和质体型, 根据功能又可分为光合型和非光合型等类型。玉米NADP-ME有光合型(C4)、非光合型(C3)和根型3种类型[ 10, 11]。光合型定位于绿色叶片, 参与C4光合循环; 非光合型定位于黄化叶片, 具体作用尚不清楚; 根型定位在根细胞中, 主要参与防御反应[ 12]。水稻和拟南芥的NADP-ME包含1个质体型和3个细胞质型[ 13], 具有组织和发育特异性表达。高等植物NAD(P)-ME家族成员催化同一个生化反应, 但代谢途径和表达模式不同[ 2, 14], 可能与其在细胞内的定位有关。
籽粒苋( A. hypochondriacus)粮饲兼用, 是双子叶C4植物, 属于苋科( Amaranthus)苋属( Amaranth-ceae), 原产于中美洲和东南亚, 近年我国年种植面积在10万公顷以上, 从黑龙江到海南均有分布[ 15]。籽粒苋能高效利用土壤养分[ 16]和水分[ 17], 光合速率快, 生物学产量很高[ 18]。在本课题组先前克隆到籽粒苋 NAD-ME ( AhNAD-ME)基因[ 19, 20]的基础上, 分析其序列特征, 进行亚细胞定位, 探明时空表达特性, 构建原核表达载体获得原核表达蛋白, 将为进一步研究其酶学特性和转基因利用奠定基础。
供试材料籽粒苋和克隆载体pSURE-AhNAD- ME由本实验室保存, 原核表达载体pEASY-E1和大肠杆菌菌株Trans1-T1和Transetta (DE3)的感受态细胞购自北京全式金生物技术有限公司。限制性内切酶、T4 DNA连接酶、LA- Taq酶、M-MLV反转录酶、DNA Marker、Premixed Protein Marker、IPTG、考马斯亮蓝R-250为大连宝生物公司产品; 氨苄青霉素购自Sigma公司。DNA凝胶回收试剂盒、RNA提取试剂盒购自北京艾德来生物科技有限公司。
以 AhNAD-ME基因推导的氨基酸序列作query, 利用BlastP在线工具分析其结构域和进化地位, PSORT (http://www.psort.org/)和SoftBerry ProtComp 9.0 (http://linux1.softberry.com/berry.phtml)在线预测AhDNA-ME的亚细胞定位, 用SignalP 4.1预测导肽[ 21]。用Clustal 1.8.1和MEGA 4.1软件构建系统进化树。
运用半定量RT-PCR检测 AhNAD-ME基因的表达量, 以 Actin为内标基因。将籽粒苋植株暗处理1 d后, 置光照下2、4、6和8 h, 分别提取暗处理和不同光照时段的根、茎、叶的总RNA, 以此为模板, 用Oligo dT Primer作引物, 通过反转录合成cDNA第1链。以cDNA第1链为模板, 扩增 AhNAD-ME基因和内标基因 Actin。扩增 AhNAD-ME的正向引物为5°-ACCCAC AAAGAGTGTTACCG-3°, 反向引物为5°-TTCCCT GATTAACGTGCC-3°, 扩增内标基因的正向引物为5°-CTACAATGAGCTTCGGGTTGC-3°, 反向引物为5°-GGACTTCTGGACAACGGAATCTC-3°。取RT-PCR产物20 μL经1%琼脂糖凝胶电泳, 然后成像, 采用软件BandScan进行灰度分析, 在Microsoft Excel中作图。
以含有 AhNAD-ME全长基因的克隆载体pSURE-AhNAD-ME为模板, 利用引物P1 (5°-CAAG ATCTCAATGTTGTTGCTTTGTAGTC-3°)和P2 (5°-C GGTAACCTTCAGCGTTTCTTGTACAC-3°)进行PCR扩增, 琼脂糖凝胶电泳中可见大约1.8 kb的片段, 将其纯化回收, 取4 μL与1 μL原核表达载体pEASY-E1混匀, 25℃连接15 min。反应结束后, 转化大肠杆菌Trans1-T1感受态细胞。挑取单菌落至LB (含100 mg L-1 Amp)液体培养基, 37℃过夜培养。提取质粒进行PCR检测, 以空载体pEASY-E1作为负对照, 引物为P1和P2。将PCR鉴定呈现阳性的单克隆提取质粒, 用 Xba I和 Sac I双酶切鉴定, 并送北京六合华大基因科技股份有限公司测序。
将基因序列无变异、插入方向正确的重组质粒, 通过电击导入Transetta (DE3)感受态细胞。挑取单菌落至LB (含100 mg L-1Amp)液体培养基, 37℃过夜培养。以菌液为模板进行PCR扩增, 以未转化的菌液为负对照, 引物为P1和P2。
将导入重组载体的6 mL单菌落菌液加入600 mL LB液体培养基(含100 mg L-1 Amp), 于37℃, 200转 min-1振荡培养。当菌液的OD600值为0.4~0.6时, 加入IPTG, 终浓度为1 mmol L-1。然后等量分成6管, 其中4管于30℃条件下分别诱导0、2、4和6 h。反应结束后, 从每管取菌液2 mL, 18 000× g离心1 min, 弃上清液, 加入SDS上样缓冲液, 悬浮混匀, 沸水浴5~10 min, 18 000× g离心1 min, 冰浴5 min, 进行SDS-PAGE电泳。另2管分别在30℃和16℃条件下诱导4 h, 离心收集菌体后用1×PBS将菌体悬浮, 用超声波破碎(20 mm的变幅杆, 400 W, 超声2 s, 间隔5 s, 重复60次), 9600× g离心10 min, 分离上清液和沉淀, 并分别加入SDS上样缓冲液, 混匀, 沸水浴5~10 min后上样, SDS-PAGE电泳。电泳完毕, 用考马斯亮蓝R-250染色并脱色至背景清晰。
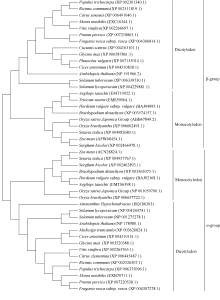
将 AhNAD-ME基因(GenBank登录号为HQ186303)编码的氨基酸序列提交NCBI, 进行BlastP。蛋白质保守结构域分析表明该序列含有完整的NAD-ME保守功能域, 包括苹果酸N端结构域和苹果酸酶的NAD结合结构域[含有6个NAD(P)结合位点]。系统进化树( 图1)显示, 该序列先与双子叶植物的NAD- ME的α亚基(62 kD)聚为一类, 再与单子叶植物的NAD-ME的α亚基(62 kD)聚为一类, 而单子叶植物与双子叶植物NAD-ME的β亚基(59 kD)聚为1类, 表明植物NAD-ME的α亚基和β亚基的分化在单、双子叶植物分化之前已经完成。
用SoftBerry ProtComp 9.0 (http://linux1.softberry. com/berry.phtml)在线预测AhNAD-ME的蛋白质亚细胞定位, 表明该蛋白位于线粒体。PSORT在线(http://www.psort.org/)分析进一步表明该蛋白质位于线粒体基质。SignaP4.1在线分析表明AhNAD-ME没有明显的导肽序列(结果未显示)。
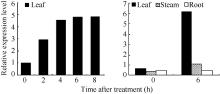
在暗处理或光照条件下, AhNAD-ME基因在叶片中均表达, 并且随着光照时间的延长, 表达量相应增加。在光照0~4 h区间, 随光照时间延长, 表达量增加幅度大; 在光照4~8 h区间, 表达量增加幅度趋缓, 证实 AhNAD-ME基因具有光诱导表达特性。根、茎、叶表达模式不尽相同。在暗处理条件下, AhNAD-ME在根、茎、叶中均有低水平表达, 但在光照处理后, 叶片中的表达量急速增加, 茎中表达量也明显增加, 但根中表达量无明显变化( 图2和 图3), 证实在无光条件下, 籽粒苋 AhNAD-ME基因呈现低水平的组成型表达, 在光照条件下则呈现绿色组织特异性表达。预示 AhNAD-ME基因低水平组成型表达可以满足苹果酸的基本代谢活动, 在光照条件下则可能参与了光合作用。
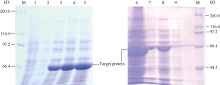
用IPTG诱导含有重组质粒的Transetta (DE3)菌株表达重组蛋白, SDS-PAGE检测结果表明, 30℃诱导2 h就有特异的蛋白条带出现。随着诱导时间延长, 条带颜色进一步加深。诱导蛋白的分子量约66 kD ( 图4), 与预期的蛋白质分子量相符。
为了获得能够可溶性表达的目的蛋白, 用IPTG分别在30℃和16℃下诱导4 h, 对上清液和沉淀进行SDS-PAGE电泳检测。结果表明, 在2个温度条件下, 融合蛋白均能被诱导, 但30℃诱导的表达量高于16℃, 但2个温度诱导的融合蛋白主要以包涵体的形式存在( 图4)。
植物的多数蛋白质由核基因编码, 在细胞质内与内质网相结合的核糖体上合成, 之后在前导序列的指引下到达特定的细胞器, 部分蛋白质被分泌到细胞外或留在细胞质中。蛋白质只有转运到正确部位才能参与细胞的各种代谢活动, 协同保证生命活动的正常运行。前导序列一般位于前体蛋白质N-端, 长度约20~80个氨基酸。有些蛋白质则由内部定位信号指导它们在细胞内的转运和定位。内部定位信号序列隐藏在成熟的蛋白质中, 不会被删除, 可能对蛋白质的折叠和功能有重要作用[ 22]。线粒体是重要的细胞器, 但线粒体的蛋白质合成能力有限。大量的线粒体蛋白质是在细胞质中合成的, 在前导序列, 也称之为导肽的指引下, 通过TOM复合体和TIM23转位酶分送到基质、内膜或膜间隙, 之后信号肽酶切除导肽, 前体蛋白变为成熟蛋白。导肽通常是疏水的, 这种特征性结构有利于穿过线粒体的双层膜。线粒体导肽有一些特征[ 23], 如富含丙氨酸、精氨酸、亮氨酸和丝氨酸, 很少含带有负电荷的谷氨酸、天冬氨酸以及异亮氨酸和赖氨酸, 在相对于切割位点-2位的氨基酸为精氨酸, 是protease-I的识别位点, 第8位为非极性氨基酸; 起始的2个氨基酸为Met-Leu。但同一种蛋白质的导肽在不同植物中差异较大, 不具有高度保守的序列[ 24]。我们用SignalP在线分析了AhNAD-ME的氨基酸序列, 发现其不具备导肽序列, 而Long等[ 25]微量测序结果表明成熟的AhNAD-ME的N-端缺少了31个氨基酸。分析AhNAD-ME N-端的31个氨基酸序列, 发现丙氨酸、精氨酸、亮氨酸和丝氨酸的含量占到54.8%, 不含有天冬氨酸以及异亮氨酸和赖氨酸等带负电荷的氨基酸, 符合线粒体导肽的序列特征。由于线粒体导肽的非保守性, 给判断蛋白质是否具有导肽序列带来困难, 需要生物信息学技术和亚细胞蛋白质组学技术相互印证。
植物的NAD-ME有不同的构成形式, 如三色苋( Amaranthus tricolor)、禾草龙爪稷( Eleusine coracana)[ 26]和洋野黍( Panicum dichotomiflorum)[ 27]叶片的NAD-ME是同源八聚体, 籽粒苋的NAD-ME是异源八聚体[ 22]。本研究用AhNAD-ME作query进行BlastP, 表明双子叶植物的α亚基(62 kD)先与单子叶植物的α亚基聚合, 双子叶植物的β亚基(59 kD)则先与单子叶植物的β亚基聚合, 似乎表明在单、双子叶植物分化之前这2个亚基的编码基因已经分化。不同物种的α亚基均具有完整的苹果酸酶的结构域, 似乎β亚基与α亚基的聚合对于酶活性调节具有重要作用。深入研究不同植物的NAD-ME构成形式及其活性, 将有助于加深理解NAD-ME功能的自我调节和进化机制。
蛋白质的体外表达是功能鉴定和抗体制备的基础。原核表达系统具有培养方法简单, 产量高、速
度快、稳定性好等优点[ 28, 29]。但真核基因在大肠杆菌中的正确表达受很多因子的影响, 如目的基因本身的特性、诱导温度和时间、密码子偏好性等。Transetta (DE3)菌株是BL21的衍生系, 该菌株补充了大肠杆菌缺乏的6种稀有密码子(AUA、AGG、AGA、CUA、CCC、GGA)对应的tRNA, 利于提高真核基因在原核系统中的表达水平。本研究将 AhNAD-ME基因重组到pEASY-T载体上, 电击转化到Transetta (DE3)菌株中, 在原核细胞中高效表达。籽粒苋 AhNAD-ME基因较大, 开放可读框长度为1872 bp, 编码623个氨基酸[ 20]。原核表达蛋白的获得为基因功能鉴定奠定了基础, 也为制备抗体提供了抗原。
籽粒苋AhNAD-ME具有苹果酸酶的完整功能域, 定位于线粒体基质中; 表达模式为光诱导、绿色组织特异性表达。构建了 AhNAD-ME基因的原核表达载体, 并在大肠杆菌中高效表达。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|