本文旨在揭示持绿型小麦品种的灌浆特性和籽粒蛋白质含量对外源激素的响应, 认识植物激素调控籽粒灌浆和蛋白质合成的作用机制。自盛花期开始, 连续4 d喷施10 mg L-1脱落酸(ABA)和6-苄基腺嘌呤(6-BA), 持绿型品种汶农6号的灌浆期(
This study aimed to understand the grain filling process and protein biosynthesis in grain of stay-green wheat in response to exogenous hormones. At blooming stage, plants of Wennong 6 (stay-green cultivar) and Jimai 20 (control) were sprayed with 10 mg L-1 abscisic acid (ABA) and 6-benzyladenine (6-BA) for four days. Compared with Jimai 20, Wennong 6 had longer grain-filling duration (
小麦籽粒中蛋白质的含量和组分对小麦的产量、营养品质及加工品质均有重要影响[ 1]。研究小麦籽粒灌浆进程中蛋白质含量动态变化以及蛋白质组分对于小麦品质有重要意义。植物激素是植物自身合成的生长调节物质, 对植物的生长发育发挥重要的调控作用[ 2]。当施用植物激素或植物生长调节剂后, 作物的氮代谢受到调控。烯效唑拌种提高了小麦叶片全氮含量[ 3]; 细胞分裂素可诱导与蛋白质合成有关基因的表达, 调节蛋白质的合成[ 4]; 小麦籽粒中玉米素核苷(ZR)含量与蛋白质含量呈显著正相关[ 5]; ZR在盛花期能促进棉花对氮素的吸收, 而降低结铃期后棉株ABA含量有利于氮素的吸收利用[ 6]; GA3可降低大豆根系硝态氮含量, 对硝酸还原酶有一定抑制作用[ 7]; GA3对棉铃Bt蛋白含量的调节效应与棉铃所处发育阶段有关[ 8]; 外源ABA可增加籽粒中蛋白质含量, 改变谷蛋白组分含量[ 9]。
研究表明, 持绿型作物叶片叶绿素含量高, 植株衰老过程中叶片失绿缓慢[ 10], 选育保绿品种是提高作物产量的有效途径[ 11, 12]。持绿型小麦绿叶面积大, 叶片光合能力强, 有较长的灌浆持续期[ 13]。不同持绿型小麦灌浆进程以及产量形成的生物学机制有显著差异[ 14, 15]。然而, 关于不同持绿型小麦品种籽粒灌浆进程及其蛋白质含量动态以及激素调控机制还有待深入研究。本试验选用不同持绿型小麦品种进行花后喷施外源ABA和6-BA, 并对照非持绿型品种分析籽粒灌浆进程、蛋白质含量、谷氨酰胺合成酶活性、成熟期籽粒蛋白质组分含量以及内源激素含量变化, 旨在研究持绿型小麦品种灌浆进程中蛋白质含量和组分及其合成关键酶的变化特性, 为以化学调控措施实现小麦高产、优质生产提供理论依据。
2010—2011和2011—2012小麦生长季, 在山东农业大学农学试验农场(山东泰安)进行田间试验。试验地耕层(0~20 cm)土壤含有机质12.3 g kg-1、全氮0.91 g kg-1、碱解氮87.2 mg kg-1、速效磷8.6 mg kg-1、速效钾57.5 mg kg-1。播种前施入基肥纯氮120 kg hm-2、P2O5100 kg hm-2、K2O 100 kg hm-2, 拔节期追施纯氮120 kg hm-2。其他田间管理同一般高产田。试验小区面积9 m2, 随机排列, 重复3次。
采用二因素随机区组设计。以品种为主区, 选用持绿型汶农6号和非持绿型济麦20; 花后喷施外源激素为副区, 设ABA、6-BA和清水(CK) 3个处理。于盛花期开始, 每天16:00左右在穗部喷施10 mg L-1 ABA或6-BA, 每个处理喷施9 m2, 用量为100 mL m-2, 连续喷4 d。为使激素能更好地附着于穗部, 激素溶液中加入0.5% Tween-20, CK为含Tween-20清水。
于开花期标记长相一致、同一日开花的麦穗。开花后7、14、21、28和35 d分别取中部小穗的第1、第2位籽粒(强势粒)和第3、第4位籽粒(弱势粒)。若无第4位籽粒, 则只取第3位籽粒为弱势粒; 若有第5位籽粒, 则取第3、第4、第5位籽粒为弱势粒。一半样品保存于-40℃冰箱中, 用于测定谷氨酰胺合成酶活性、内源激素含量测定; 另一半于55℃烘干至恒重, 用于测定蛋白质含量以及蛋白质组分。花后3、6、9、12、15、18、21、24、28和35 d (弱势粒从花后6 d开始)取穗样, 烘干后分强、弱势粒作籽粒灌浆动态模拟。
小麦成熟后每处理收获1 m2统计穗数, 脱粒后晾干称重, 计算产量。3次重复。
按朱庆森等[ 16]介绍的方法, 利用Richard方程模拟小麦籽粒增重动态。
式中, W为粒重, A为生长终止量, t为开花后天数, B、 k、 N为参数。对该方程求一阶导数, 可得灌浆速率( G)。
当灌浆进程达到 A的99%时, 实际灌浆终期( t3)、最大灌浆速率( Gmax)、平均灌浆速率( Gmean)和活跃生长期( D)分别用下列公式计算:
采用半微量凯氏定氮法测定氮含量, 再乘以系数5.7, 即为小麦籽粒粗蛋白质含量[ 17]。参照何照范[ 17]的方法分离和测定蛋白质组分。按王平等[ 18]的方法测定谷氨酰胺合成酶(GS)活性。
采用高效液相色谱法(HPLC)测定籽粒中4种内源激素的含量[ 19]。以体积比为50∶45∶5的甲醇∶乙腈∶0.6%乙酸作为流动相; 分析柱为Symmetry C18 (150.0 mm × 4.6 mm, 5 μm), 柱温为25℃, 流动相流速0.6 mL min-1; 检测波长为254 nm。玉米素、赤霉素、生长素、脱落酸标样均购自美国Sigma公司。
小麦籽粒产量为2年度数据, 而籽粒灌浆进程、蛋白质含量及组分、GS活性、内源激素含量均为2010—2011年度数据。用DPS7.05统计分析软件对数据进行方差分析和显著性检验以及相关性分析, 用MATLAB 7.0计算籽粒灌浆参数, 用Sigma 10.0作图。
两品种强、弱势籽粒增重过程均呈S曲线变化, 花后35 d粒重达到最大, 但此时持绿型品种的粒重高于非持绿型品种(图1)。喷施外源ABA和6-BA提高了两品种强、弱势粒粒重, ABA处理汶农6号花后35 d的强、弱势粒粒重分别提高5.93%和5.84%, 低于济麦20的15.01%和14.44%; 而6-BA处理后强、弱势粒粒重增幅在两品种间差异较小, 汶农6号的增幅分别为6.88%和6.55%, 济麦20的增幅分别为7.06%和9.11%。
两品种籽粒灌浆速率呈先升高再降低的趋势。济麦20灌浆速率在花后15 d达最大, 而汶农6号则在花后18 d达最大(图2)。喷施外源ABA, 汶农6号强势粒花后6~15 d的灌浆速率降低, 但强势粒花后18~28 d和弱势粒花后6~28 d的灌浆速率提高; 而济麦20强、弱势粒的灌浆速率均在花后6~35 d较CK提高。6-BA处理提高了汶农6号强势粒花后3~21 d和弱势粒6~15 d的灌浆速率, 对济麦20强势粒的作用时段与汶农6号相同, 而对弱势粒的作用时间更长(花后6~35 d)。
持绿型汶农6号强、弱势籽粒的 t3、 D、 Gmax和 Gmean参数值均大于非持绿型济麦20 (表1)。两品种强势粒的各灌浆参数均大于弱势粒。ABA处理后, 汶农6号强势粒的 t3和 D值没有明显变化, 但强、弱势粒的 Gmax和 Gmean明显升高; 6-BA处理后, 汶农6号的 t3和 D呈现强势粒减小, 而弱势粒增大的变化特点。与汶农6号不同的是, 两种外源激素处理后济麦20强、弱势粒的上述参数均呈增大趋势。这些结果表明ABA和6-BA对灌浆参数的影响存在粒位和品种效应。
| 表1 籽粒增重模型与籽粒灌浆参数 Table 1 The grain filling parameters and grain filling process model |
对照条件下, 汶农6号的千粒重和产量均显著大于济麦20, 表明持绿型品种产量较高。喷施ABA和6-BA显著提高两品种的千粒重和产量, 尤其是ABA处理, 汶农6号增产幅度大于济麦20。2010—2011年度ABA和6-BA处理的增产幅度, 汶农6号分别为14.1%和6.2%, 济麦20分别为5.3%和3.1%。两种外源激素处理对穗数和穗粒数没有显著影响(表2)。
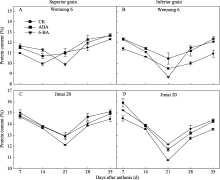
两品种强弱势籽粒蛋白质含量变化趋势相同, 均先降低后升高(图3)。济麦20的蛋白质含量高于汶农6号。花后35 d, 两品种强势粒蛋白质含量均高于弱势粒。喷施ABA和6-BA显著提高花后35 d的籽粒蛋白质含量, 且两品种强、弱势粒的蛋白质含量与对照的差异缩小。表明采用外源激素可以改善籽粒蛋白质含量。
| 表2 激素处理对不同品种小麦产量和产量构成的影响 Table 2 Effects of exogenous hormones treatments on the factors of wheat yield |
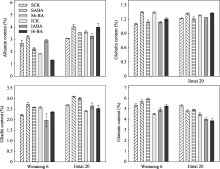
小麦籽粒中各蛋白质组分所占比例不同, 以麦谷蛋白含量最高。非持绿型济麦20强势粒的清蛋白、球蛋白、醇溶蛋白显著高于持绿型汶农6号。
在对照条件下, 汶农6号强势粒的清蛋白、醇溶蛋白、麦谷蛋白含量显著高于弱势粒; 而济麦20强势粒的清蛋白、球蛋白显著低于弱势粒, 醇溶蛋白、麦谷蛋白含量显著高于弱势粒。喷施ABA显著提高了两品种强势粒的清蛋白、球蛋白、醇溶蛋白含量; 6-BA处理显著降低汶农6号强、弱势粒清蛋白含量, 但显著提高济麦20强、弱势粒的清蛋白含量。ABA和6-BA处理后, 麦谷蛋白含量汶农6号显著升高, 而济麦20显著降低, 且强、弱势粒表现一致(图4)。可见, 激素处理对蛋白质组分含量的影响存在品种和粒位效应。
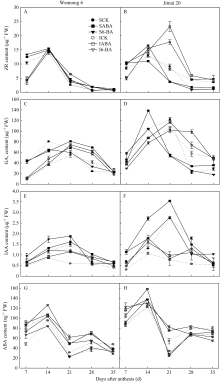
2.6.1 玉米素核苷(ZR) 两品种在灌浆期强、弱势籽粒的ZR含量均呈先升高后降低的趋势, 花后14 d达最高值(图5-A, B)。与对照相比, ABA处理后济麦20强势粒的ZR含量, 前期(14~21 d)降低, 后期(28~35 d)升高, 而弱势粒的ZR含量则持续(7~ 35 d)升高; 汶农6号强势粒ZR含量升高期为花后7~21 d, 比济麦20提早7 d。喷施6-BA显著提高济麦20弱势籽粒花后14~35 d的ZR含量, 且显著提高汶农6号强、弱势籽粒花后14~28 d的ZR含量。
2.6.2 赤霉素(GA3) 两品种籽粒GA3含量呈先升高后降低的变化趋势, 但强、弱势粒的峰值时间不同, 强势粒为花后14 d, 弱势粒为花后21 d(图5-C, D)。外源ABA处理对汶农6号强势粒花后7 d的GA3含量无显著影响, 但显著降低花后14 d的GA3含量; 显著提高汶农6号强、弱势粒花后21~35 d的GA3含量。6-BA处理显著降低汶农6号强势粒7~21 d的GA3含量, 但显著提高弱势粒花后7~28 d的GA3含量。
2.6.3 生长素(IAA) 小麦籽粒中IAA含量随灌浆进程呈先升高后降低趋势, 两品种强、弱势粒分别在花后21 d和14 d达峰值, 强势粒的IAA含量显著高于弱势粒。外源ABA和6-BA显著提高两品种强势粒的IAA含量, 作用时间不同, 前者为花后7~35 d, 后者为花后7~21 d; 而弱势粒的IAA含量在花后7~35 d持续增大, 两品种表现一致(图5-E, F)。
2.6.4 脱落酸(ABA) 与其他籽粒内源激素表现不同, ABA含量在灌溉过程中出现两次升高-降低的变化, 强、弱势粒峰值时间一致。ABA最大峰值出现在花后14 d, 第二峰值在花后28 d, 而花后21 d和35 d达到两个低谷值。花后7~14 d, 济麦20强势粒的ABA含量高于弱势粒, 但花后21~35 d, 弱势粒的ABA含量高于强势粒。花后7~35 d, 汶农6号弱势粒ABA含量显著高于强势粒。喷施ABA显著提高持绿型汶农6号花后7~28 d强、弱势籽粒及济麦20弱势粒中ABA含量。喷施6-BA显著提高汶农6号弱势粒花后7~28 d的ABA含量, 显著提高济麦弱势粒7~21 d的ABA含量(图5-G, H)。
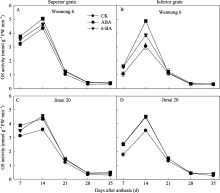
所有处理中GS活性均呈先升高后降低的变化趋势, 花后14 d达最大值; 济麦20的GS活性高于汶农6号(图8)。两品种强、弱势籽粒的GS活性存在显著差异, 花后7~21 d强势粒的GS活性高于弱势粒。ABA和6-BA均显著提高花后7~14 d的GS活性, 在花后28~35 d没有显著效应。ABA处理后, 强势粒花后7~14 d的GS活性相对较高, 6-BA处理花后28 d的GS活性下降相对缓慢, 保持较高的活性。
持绿型汶农6号的灌浆终期及活跃生长期均大于非持绿品种济麦20, 且汶农6号最大灌浆速率及平均灌浆速率均大于济麦20, 因而汶农6号在较长的灌浆期内能积累更多的同化物, 最终获得较高的粒重及产量(表2)。这进一步证实持绿型小麦品种由于叶片功能期较长, 籽粒灌浆时间长, 为籽粒灌浆提供充足的营养物质, 产量一般高于非持绿品种[ 15, 20, 21]。
植物激素在作物生长发育中起着重要的调控作用, 同化物质的转运及在库中的积累转化都有激素参与调控[ 22, 23]。外源ABA和细胞分裂素参与调控籽粒灌浆及籽粒中的物质代谢[ 24, 25], ABA参与光合产物的合成和积累[ 26]。研究表明, ABA促进氮素向籽粒的转运, 提高籽粒的蛋白质含量[ 27]。ABA促进贮藏物质的积累, 特别是贮藏蛋白的合成[ 28, 29], 贮藏蛋白的基因受ABA信号的诱导而提高表达水平[ 30]。也有研究认为ABA对贮藏蛋白合成的促进作用发生在转录水平上[ 31]。本试验中喷施外源ABA显著提高了两品种籽粒花后35 d的蛋白质含量。谷氨酰胺合成酶是合成蛋白质的关键酶之一, 喷施ABA提高了GS活性(图6), 因而有利蛋白质的合成, 这与Yang等[ 32]的报道一致, 即ABA通过提高GS活性促进蛋白质的合成。6-BA能提高小麦花后同化氮素对籽粒总氮的贡献率[ 33]。Criado等[ 34]发现, 6-BA能够抑制叶片蛋白质的降解及促进蛋白质的合成。Ananieva等[ 35]研究表明, 6-BA可促进茭瓜子叶中蛋白质和RNA的合成。在本研究中, 外源6-BA提高籽粒花后7~14 d的GS活性, 且显著提高花后35 d蛋白质含量。这表明外源ABA和6-BA均能提高GS活性, 提高小麦籽粒蛋白质含量。蛋白质的组分分为清蛋白、球蛋白、醇溶蛋白和麦谷蛋白[ 36]。研究表明, 6-BA处理小麦穗可提高小麦谷蛋白/醇溶蛋白比值[ 37]。本研究发现, 喷施ABA显著提高两品种强势粒清蛋白、球蛋白、醇溶蛋白含量; 6-BA处理显著降低汶农6号强、弱势粒清蛋白含量, 但显著提高济麦20强、弱势粒清蛋白含量。此外, 也证实ABA处理显著提高汶农6号强、弱势籽粒的麦谷蛋白含量[ 9]。
籽粒灌浆过程中各内源激素的含量在品种间存在基因型差异[ 38]。外源激素通过改变内源激素水平调节植物内在生理代谢的各个环节[ 39]。本试验中喷施ABA和6-BA不同程度地改变了两品种内源ZR、ABA、GA3、IAA含量, 且存在明显的品种和粒位效应。植物激素含量变化由基因表达调控[ 40], 作物的持绿特性由细胞核及细胞质基因控制[ 41]。持绿型汶农6号和非持绿济麦20的内源激素对ABA和6-BA的响应不同, 这可能是由两品种遗传基因的差异性造成的。研究表明, GA的生物合成受GA含量的反馈调节, 低含量的GA会激活GA的生物合成[ 42]。外源ABA能提高内源ABA的含量[ 19], 这一点也在本试验的两个品种中得到验证。ABA的生物合成类萜途径是由甲瓦龙酸(MVA)经中间产物异戊烯基焦磷酸(IPP)等一系列步骤[ 43, 44], 而IPP也是玉米素生物合成的起始物[ 45], 因而本试验中喷施ABA提高ZR含量可能是通过促使IPP向玉米素合成实现的, 而外源ABA提高GA3含量可能是通过降低前期内源GA3含量, 由GA3的反馈调节提高籽粒灌浆后期的GA3含量实现的。
内源细胞分裂素可以提高籽粒灌浆强度, 增大千粒重[ 46]。细胞分裂素与其特定受体结合后诱导基因表达, 促进RNA和蛋白质的合成[ 47]。GA对籽粒灌浆起调控作用, 且与粒重的决定密切相关[ 25]。也有研究认为, GA可诱导产生或激活α-淀粉酶等水解酶而不利于淀粉和蛋白质的合成和积累[ 48]。ABA表现多种生理功能, 如促进水稻籽粒灌浆[ 49]; 延长小麦叶片保绿时间, 延缓叶绿素降解[ 50]; 提高小麦穗颈节伤流强度, 促进营养物质的运转[ 51]; 抑制一些水解酶的活性, 并促进蛋白质的合成和积累[ 25]。IAA对胚乳细胞的发育以及籽粒中物质积累有调控作用[ 52]。外源ABA和6-BA对籽粒灌浆进程和蛋白质含量影响的机制可能在于, 外源激素处理引起籽粒中激素含量和比例变化, 导致蛋白质合成与分解的关键酶活性改变。本研究中, 喷施外源ABA和6-BA提高了两品种籽粒平均及最大灌浆速率, 但对灌浆期和活跃生长期的影响存在品种差异, ABA处理后, 汶农6号强势粒的灌浆期及活跃生长期没有明显变化。这可能是非持绿型品种叶片叶绿素含量低, 抗氧化性弱, 衰老快, 导致其功能期较短, 因而ABA和6-BA能延长非持绿型济麦20的灌浆期。
持绿型汶农6号的 t3、 D、 Gmean和 Gmax均大于非持绿型济麦20, 使汶农6号籽粒能积累更多的光合产物, 因而汶农6号粒重及产量较大。喷施外源ABA和6-BA使籽粒内源激素不同程度地改变, 平均灌浆速率和最大灌浆速率提高, 促进籽粒灌浆、千粒重和产量提高。ABA和6-BA处理后, GS活性及蛋白质含量均提高, 蛋白质组分较对照有不同程度改变。
| 1 |
|
| 2 |
|
| 3 |
|
| 4 |
|
| 5 |
|
| 6 |
|
| 7 |
|
| 8 |
|
| 9 |
|
| 10 |
|
| 11 |
|
| 12 |
|
| 13 |
|
| 14 |
|
| 15 |
|
| 16 |
|
| 17 |
|
| 18 |
|
| 19 |
|
| 20 |
|
| 21 |
|
| 22 |
|
| 23 |
|
| 24 |
|
| 25 |
|
| 26 |
|
| 27 |
|
| 28 |
|
| 29 |
|
| 30 |
|
| 31 |
|
| 32 |
|
| 33 |
|
| 34 |
|
| 35 |
|
| 36 |
|
| 37 |
|
| 38 |
|
| 39 |
|
| 40 |
|
| 41 |
|
| 42 |
|
| 43 |
|
| 44 |
|
| 45 |
|
| 46 |
|
| 47 |
|
| 48 |
|
| 49 |
|
| 50 |
|
| 51 |
|
| 52 |
|