第一作者联系方式: E-mail:sangxianchun@163.com
叶片早衰直接影响作物产量和品质, 鉴定早衰突变体、图位克隆调控基因对于研究植物衰老机制具有重要的意义。以甲基磺酸乙酯诱变水稻籼型恢复系缙恢10号, 获得
Premature senility directly influences crop yield and quality in the production. Therefore, it is crucial to identify early senescent leaf mutants and then clone genes associated with senescence by map-based strategy, which is significant in the research of senescence mechanism. An early senescent leaf mutant
植物衰老是一个细胞程序性死亡的过程, 涉及叶绿体发育、叶绿素合成与降解、激素和自由基代谢等途径, 既受遗传基因的调控, 也受外界环境的影响[ 1]。植物衰老的主要特征是叶片黄化、叶绿素降解和光合作用下降。自然衰老过程中, 营养物质从叶片转移至种子, 有利于植物的生长繁殖, 是其长期进化过程中形成的一种适应性[ 2]。但在农业生产中, 叶片早衰则会导致作物产量和品质的下降, 如水稻穗中60%~70%的碳是由功能叶合成转运而来的[ 3]。水稻不仅是单子叶模式植物, 也是重要的粮食作物, 克隆水稻早衰基因对探索植物衰老机制和水稻的遗传改良具有重要的意义。如 OsDOS编码一个水稻CCCH-Type锌指蛋白, 功能缺失促进叶片衰老, 过表达则延缓叶片衰老[ 4]。
基因克隆的策略很多, 其中, 转录组和蛋白质组是植物衰老机制研究的常用手段[ 5]。在双子叶模式植物拟南芥中, 利用表达谱芯片技术从衰老的叶片中鉴定到800个上调SAG (senescence-associated genes)[ 6], 在水稻剑叶自然衰老过程中, 则检测到533个上调SAG[ 7]。全基因组分析获得了大量的SAG, 为从基因组角度阐释叶片衰老机制奠定了基础, 但是这些SAG是否直接调控植物衰老尚需进一步的功能验证。图位克隆是基因分离和功能研究中最直接有效的技术手段, 植物基因组测序的大量完成进一步促进了这一技术的发展, 其关键是优良突变体的获得[ 8]。
目前, 在水稻中仅鉴定到十几个叶片自然早衰突变体, 其中9个基因已定位, 突变体 psl1、 pgl2、 psl3、 pse(t)、 es-t、 esl2、 esl3、 sms1和 lad的调控基因分别定位在第2、第8、第7、第7、第5、第4、第5、第8和第11染色体上[ 9, 10, 11, 12, 13, 14, 15, 16, 17]; 4个基因已克隆, NOE1与 OsDM I3均与过氧化反应有关, NOE1编码过氧化氢酶OsCATC, 基因功能缺失通过激活硝酸还原酶产生大量NO, 从而诱导叶片早衰, noe1突变体内H2O2的含量显著高于野生型[ 18]。 OsDMI3位于水稻第5染色体上, 编码Ca2+/CaM依赖型蛋白激酶, 在ABA诱导的抗氧化防护过程中具有重要的功能, OsDMI3功能缺陷可造成植株体内H2O2的过量积累, 导致叶片衰老[ 19]。 RLS1编码一个C端具有ARM结构域的核苷酸结合蛋白, 参与程序性细胞死亡过程, 叶绿素的快速降解是导致 rls1衰老的主要原因[ 20]; SPL28编码网格相关受体蛋白复合体亚基(AP1M1), 参与高尔基的物质运输途径, 其功能缺失引起植物过敏性反应, 形成叶片类病斑, 导致水稻叶片早衰[ 21]。
EMS诱变籼型水稻恢复系缙恢10号的种子, 在其后代中发现了一个稳定遗传的淡叶早衰突变体, 暂命名为 esl5, 本文对其进行了形态鉴定、理化分析和基因精细定位等研究, 为下一步基因的克隆和功能分析奠定了基础, 也有利于水稻的遗传改良。
缙恢10号是西南大学水稻研究所采用花粉管介导法将高粱DNA导入水稻品系明恢63, 利用分子标记辅助选择获得的一个晚籼恢复系。以甲基磺酸乙酯(EMS)诱变缙恢10号的种子, 从其后代中鉴定到一个淡叶早衰突变体 esl5, 连续6代种植, 突变性状均稳定遗传。以粳稻品种日本晴为母本, esl5为父本, 配制杂交组合, 利用F1和F2群体进行遗传分析, 并利用F2隐性群体进行基因定位。
1.2.1 形态鉴定 田间种植 esl5及野生型, 株行距25 cm×30 cm, 3次重复, 全生育期调查植株表型, 成熟后取小区中间5株, 测定有效穗、穗粒数、穗实粒数、结实率、千粒重、籽粒长和籽粒宽等主要农艺性状。
1.2.2 光合色素含量和光合作用测定 田间种植情况下, 参照文献[ 22]描述的方法在分蘖期和抽穗期分别测定 esl5和缙恢10号的光合色素含量, 并于抽穗期利用LI-6400型便携式光合作用仪测定净光合速率、气孔导度、蒸腾速率和胞间CO2浓度。
1.2.3 生理指标检测 参照文献[ 14]描述的方法测定超氧阴离子(O2-)含量; 利用南京建成生物工程研究所生产的试剂盒, 参照其说明书测定过氧化氢(H2O2)、·OH、丙二醛(MDA)、可溶性蛋白质(SP)和脯氨酸(PRO)含量以及超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性。
1.2.4 细胞超微结构观察 抽穗期, 取 esl5和野生型叶片, 以戊二醛和锇酸双重固定, 不同梯度的乙醇逐级脱水, 置换和包埋, 制超薄切片, 经醋酸双氧铀和柠檬酸铅液双重染色后, 利用H600型透射电镜观察并照相。
从日本晴/ esl5的F2群体中分别取10株典型的正常单株和突变单株, 剪取等量叶片混合后构建正常池和突变池。采用改良的CTAB法提取亲本、正常池和突变池的基因组DNA, 利用碱煮法提取F2定位单株的基因组DNA[ 23]。
参照http://www.gramene.org/microsat, 由上海英骏生物公司合成SSR引物序列。PCR总体系12.5 μL, 包括1.25 μL的10×PCR buffer、0.75 μL的25 mmol L-1 MgC12、0.5 μL的2.5 mmol L-1 dNTPs、7.9 μL的ddH2O、1.0 μL的10 μmol L-1引物、1.0 μL的模板DNA和0.1 μL的5 U μL-1 Taq DNA聚合酶。PCR程序为94℃预变性3 min; 94℃ 30 s, 56℃ 30 s、72℃ 1 min, 35个循环; 再72℃延伸10 min。PCR产物经10%非变性聚丙烯酰胺凝胶电泳, 0.1%硝酸银染色10 min, 去离子水漂洗2次, 1.5%氢氧化钠和0.2%甲醛显色后, 观察并照相。
利用NTI vector 11.0软件对初步定位区间内93-11和日本晴的DNA序列进行比对, 在差异位点两侧利用Primer Premier5.0 软件设计引物, 开发新的Indel标记。引物的合成、PCR反应和电泳分析同上。
定位群体中, 具有 esl5带型的单株记为B, 具有日本晴带型的单株记为A, 具有日本晴/ esl5 F1杂合带型的单株记为H。根据公式[( H+2 A)/2 n]×100计算遗传距离并构建连锁图谱, 其中 H表示定位群体中出现杂合体带型单株的数量, A表示出现正常株带
型的单株数, n表示用于定位的隐性群体总株数。
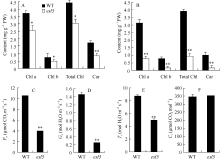
野生型缙恢10号自然生理衰老前叶片一直保持绿色, esl 5的叶片在苗期呈绿色, 分蘖期逐渐发育成黄绿色, 孕穗期开始叶尖黄化衰老, 逐渐扩展至整个叶上部, 一直持续到成熟。 esl5的抽穗期与野生型相比延迟了14 d左右, 野生型处于开花状态时, esl5才刚进入抽穗期, 整个生育期延长了20 d左右(图1)。与野生型相比, 分蘖期 esl5的叶绿素a和b的含量显著下降、类胡萝卜素含量极显著下降; 抽穗期叶绿素a、叶绿素b和类胡萝卜素的含量均极显著下降, 净光合速率、气孔导度和蒸腾速率也极显著下降, 胞间CO2浓度则无差异(图2)。农艺性状分析表明, esl5的株高略低于野生型, 但差异不显著, 有效穗显著降低, 穗粒数、实粒数和结实率极显著降低, 尤其是结实率, 仅为野生型的44.57%; esl5的千粒重为30 g, 极显著高于野生型的26.5 g, esl5的千粒重增加是由籽粒宽和籽粒厚极显著增加造成的(表1, 图1-E, F)。
| 表1 野生型(WT)和 esl5农艺性状分析 Table 1 Agronomic trait of the wild type (WT) and the esl5 |
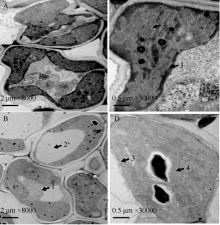
野生型缙恢10号剑叶的细胞呈卵圆形, 细胞膜紧贴细胞壁, 内含叶绿体、线粒体、高尔基体、核糖体、内质网等细胞器(图3-A); 叶绿体由叶绿体膜、类囊体和基质构成, 基质排列规则、致密(图3-B)。与野生型相比, esl5的细胞形态没有太大变化, 细胞膜严重破坏, 液泡变大, 线粒体、高尔基体、核糖体等细胞器部分或完全降解(图3-C); 叶绿体膜变薄、破裂, 基质片层松散、呈线性、排列不规则(图3-D)。
丙二醛和可溶性蛋白是植物衰老的重要生理指标, 与野生型相比, esl5的丙二醛和可溶性蛋白含量分别下降了32.00%和39.83%, 均达极显著差异水平(图4-A, B), 进一步表明 esl5是一个叶片早衰突变体。超氧阴离子(O2-)、羟基自由基(·OH)和H2O2等活性氧(reactive oxygen species, ROS)在生物体内过量累积, 可诱发氧化应激反应, 引起细胞内膜脂过氧化以及蛋白/DNA的损伤等, 导致器官甚至机体的死亡[ 24]。
 | 图4 抽穗期野生型(WT)和突变体 esl5的生理特性Fig. 4 Physiological characteristics of the wild type (WT) and esl5 at heading stage |
esl5中的O2-含量极显著下降, 仅为野生型的35.0%, H2O2和·OH的含量则极显著升高, 其中, 突变体·OH的含量为95.95 U mg-1 prot, 与野生型的58.698 U mg-1prot相比, 升高了1.63倍。 esl5中POD的活性为48.864 OD470 min-1g-1FW, 与野生型的33.325 OD470 min-1g-1FW相比, 升高了46.63%, 达 到极显著差异水平; esl5的SOD和CAT酶活性分别下降了41.42%和25.73%, 与野生型相比也达到极显著差异水平(图4)。推测ROS积累导致过氧化损伤可能是造成 esl5早衰的主要原因。
突变体 esl5和日本晴杂交组合的F1植株叶色浓绿, 无早衰表型; F2群体中, 苗期植株呈正常的绿色, 分蘖后期叶色逐渐分化为绿色和黄绿两类, 绿色植株的叶色一直保持到成熟, 黄绿色植株则在抽穗期叶片黄化早衰, 与突变体 esl5的表型类似。3356株F2群体中, 正常型2546株, 突变型810株, χ2测验符合3∶1的分离比(χ2= 1.34, χ20.05= 3.84), 表明 esl5受1对隐性核基因调控。
均匀分布于水稻12条染色体上的480对SSR引物, 112对在日本晴和 esl5间呈现多态性, 利用这112对引物进一步分析正常基因池和突变基因池, 发现, 位于第3染色体上的SSR标记RM6959和RM3400在基因池之间也表现多态性, 暗示可能的连锁关系。利用70株典型F2隐性单株进行验证, 初步将 ESL5定位在SSR标记RM6959和RM3400之间, 遗传距离分别为4.29 cM和3.57 cM (图5)。在初步定位的基础上, 进一步合成新的SSR引物并开发设计Indel标记, 利用亲本间呈现多态性的标记进行精细定位。结果发现, 在810株F2隐性单株中, Indel标记Indel03-1和Indel03-2分别有2个和3个交换株, 且交换单株不同, 标记的引物序列见表2。因此, 最终将 ESL5定位在标记Indel03-1和Indel03-2之间物理距离约83.4 kb的范围内, 位于BAC克隆AC087220.9上(图5)。在定位区间内, 检测到11个注释基因, 其中, 3个编码转座子蛋白, 3个编码表达蛋白, 2个编码F-box蛋白, 其他分别编码蛋白磷酸酶2C、重金属相关蛋白以及LTV1蛋白。
| 表2 新开发的Indel标记 Table 2 Newly designed Indel markers |
植物衰老通常表现叶片黄化、叶绿体降解、光合色素和可溶性蛋白含量下降等特性。苗期突变体与野生型无明显差异, 分蘖期, esl5的叶色呈淡绿色, 抽穗期叶尖开始黄化衰老, 然后扩展至整个叶片中上部。 esl5黄化部位的光合色素和可溶性蛋白含量均极显著下降, 细胞结构异常, 主要表现为细胞膜破裂、细胞器溶解或部分溶解、叶绿体基质片层疏松、排列不规则等。
esl5是一个新型淡叶早衰突变体, 与已报道的水稻自然早衰突变体明显不同。在水稻中, 已鉴定的自然早衰突变体除叶片衰老外, 多伴随斑点、不育等性状, 衰老时期各有异同。 psl1苗期叶片即黄化衰老[ 9]; pgl2抽穗前倒四叶开始衰老, 抽穗时倒三叶开始衰老, 穗完全抽出后, 倒二叶开始变黄衰老, 到灌浆期结束时剑叶完全衰老死亡[ 10]; psl3是一个显性苗期早衰突变体[ 11]; pse(t)抽穗期首先在老叶上出现褐色斑点, 接着整个叶片黄化衰老[ 12]; es-t苗期叶片即出现黄化衰老, 并伴有铁锈色斑点[ 13]; esl2在孕穗期叶片中上部开始出现黄化早衰[ 14]; esl3全生育期内叶片均出现褐化枯死现象[ 15]。 Lad分蘖后期表现叶尖卷曲枯死[ 16], sms1除叶片早衰外, 还表现雄性不育[ 17]。
与野生型相比, esl5的O2-含量极显著降低, ·OH和H2O2含量则极显著升高。O2-、·OH和H2O2是植物体内ROS的主要形式, 是线粒体、叶绿体和过氧化物酶体等新陈代谢的次生产物, ROS通常被认为是一种有毒的化学物质, 也是重要的信号传导分子[ 25, 26]。其中, ·OH是一种非选择性氧化剂, 也是氧化性最强的ROS自由基, 可引发不饱和脂肪酸发生脂质过氧化, 核酸断裂、蛋白质和多糖分解, 膜结构损伤及功能丧失。近来发现, ROS不足能导致小鼠精子的不育, 推测生物体内ROS可能存在一种动态的平衡, 过高过低都会对细胞造成损伤[ 27, 28]。SOD是O2-的主要清除因子, 可通过歧化反应将O2-转化为H2O2, 再进一步被CAT等分解成没有毒害的H2O和O2[ 29, 30]。推测SOD、CAT等酶活性的降低, 致使 esl5产生的·OH和H2O2不能及时清除, 造成ROS含量失衡, 导致 esl5叶片的衰老。
本研究中, ESL5被定位在第3染色体83.4 kb的物理范围内, 包含11个注释基因, 均没有进行功能研究。生物信息学分析发现11个注释基因中, 2个编码F-box蛋白, 1个编码蛋白磷酸酶2C (PP2C)。PP2C是蛋白磷酸酶的一个分支, 蛋白磷酸酶是蛋白质可逆磷酸化调节机制中的关键酶[ 31]。 AtNAP是一个NAC转录因子, 其表达上调促进叶片衰老, 下调则延迟衰老[ 32]。 SAG113编码一个PP2C, 是AtNAP的直接靶蛋白, 通过调控ABA介导的气孔运动和水分流失调控叶片衰老[ 33, 34]。F-box蛋白是植物体内一个大的蛋白家族, 参与乙烯、生长素、赤霉素、茉莉酸等激素的信号传导途径, 涉及花器官发育、光形态建成、胁迫反应等生物学过程[ 35]。例如, ORE9即编码一个F-Box蛋白, 通过泛素依赖的蛋白质水解调控衰老相关蛋白, 从而延长拟南芥的叶片衰老[ 36]。但F-box或PP2C是否是 ESL5的候选基因, 尚需进一步研究。
esl5是一个新型淡叶早衰突变体, 苗期叶片正常, 分蘖后期变成黄绿色, 孕穗期叶尖开始黄化衰老, 衰老部位细胞膜降解、细胞器部分或完全解体, 叶绿体基质疏松、排列不规则, 光合色素和光合速率极显著下降。与野生型相比, esl5的O2-含量、SOD和CAT的活性极显著降低, ·OH和H2O2含量则极显著升高, 保护酶活性降低导致ROS平衡失调可能是导致 esl5早衰的主要原因。 esl5受隐性核基因调控, 基因定位在第3染色体上83.4 kb的物理范围内, 包含11个注释基因。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|