第一作者联系方式: E-mail:wenjzjus@163.com
菜籽饼是重要的饲料蛋白质来源, 氨基酸组成与饲料营养品质有着密切关系, 其中丝氨酸、胱氨酸和酪氨酸为多数动物的半必需氨基酸。本研究利用甘蓝型油菜双单倍体(DH)群体分别与双亲Tapidor和Ningyou 7回交构建的2套BC1F1群体, 采用新创建的双子叶作物种子品质性状遗传体系QTL定位软件和作图方法, 对油菜籽丝氨酸、胱氨酸和酪氨酸含量进行了种子胚和母体植株2套遗传体系的QTL定位分析。结果表明, 在A1、A4、A7、A8、A9、C2、C3和C9染色体上检测到5个丝氨酸含量QTL、2个胱氨酸含量QTL和5个酪氨酸含量QTL, 分别解释59.34%、29.66%和59.26%的表型变异。其中5个QTL属于主效QTL, 均能解释10%以上的表型变异。全部QTL均具极显著的胚和母体加性主效应, 其中3个QTL具显著或极显著的环境互作效应。在A4染色体上发现1个QTL簇, 该区域存在3个控制丝氨酸、胱氨酸和酪氨酸含量的QTL。一些重要QTL以及与之紧密连锁的分子标记在今后图位克隆和分子标记辅助选择育种中具有重要的利用价值。
Rapeseed meal is an important feed protein source, and the amino acid composition has a close relationship with the processing quality of feed, of which serine, cystine and tyrosine are the semi-essential amino acids for most animals. By using newly developed two-genetic-system QTL mapping software and method for analyzing seed quality traits of dicotyledonous plants, two backcross populations from a set of doubled haploid (DH) lines derived from an elite hybrid cross between Tapidor and Ningyou 7 were used to detect the QTLs simultaneously located in the amphidiploid embryo and maternal plant nuclear genomes for the semi-essential amino acid contents of rapeseed across environments. The results showed that five QTLs for serine content, two QTLs for cystine content and five QTLs for tyrosine content were identified, which were subsequently mapped on chromosomes A1, A4, A7, A8, A9, C2, C3, or C9 and could respectively explain 59.34%, 29.66%, and 59.26% of phenotypic variation in total. Five QTLs were major effect QTLs which could explain more than 10% of phenotypic variation for each. All of these QTLs had both notable embryo and maternal additive main effects, among which three QTLs were also found to have significant QE interaction effects. One QTL cluster on chromosome A4 was discovered to contain three QTLs related to serine, cystine and tyrosine contents. Some important QTLs and the tightly linked markers will have an important application value in the later map-based cloning and marker-assisted selection.
甘蓝型油菜(Brassica napus L.)是我国种植面积最广的油菜类型, 其油菜籽饼粕中含有35%~45%的粗蛋白, 属于优质蛋白资源。氨基酸作为构成蛋白质分子的基本单位, 对生命活动起着重要的作用。其中, 丝氨酸、胱氨酸和酪氨酸通常被认为是大多数动物的半必需氨基酸, 影响着其机体的正常生理功能。在油菜品质育种中, 提高油菜籽中这3种半必需氨基酸的含量有利于平衡氨基酸的组成, 增加油菜籽的营养价值。作物种子的许多重要品质性状都属于数量性状, 具有复杂的遗传表现。研究已发现种子中氨基酸含量主要表现为多基因控制的数量性状, 而且还会受到环境条件的影响[1, 2, 3, 4]。多种QTL (quantitative trait locus)定位方法和定位模型[5, 6, 7]可为定位控制复杂数量性状遗传的QTL提供有效工具。至今, 已有一些关于水稻[8]、大豆[9]、小麦[10]、棉花[11]和油菜[12]等作物氨基酸含量的QTL定位信息, 但在油菜籽半必需氨基酸含量方面的QTL定位尚未见报道。目前已有研究表明, 油菜籽品质性状的表现会同时受到种子胚核基因组和母体植株核基因组等不同遗传体系基因主效应和环境互作效应的影响[12, 13, 14, 15]。基于混合线性模型方法, Yang等[16]提出了可以用于各种试验群体的全QTL模型和定位策略, 将复杂性状的多基因遗传体系剖解为QTL主效应及其与环境因子的互作效应, 并开发出相应的计算机软件(QTLNetwork), 使同时确定位于种子胚和母体植株2套遗传体系染色体上的QTL成为可能, 并已成功应用于水稻、棉花和油菜等作物品质性状的2套遗传体系QTL定位[8, 11, 12, 17, 18], 但是, 目前尚未见到有关油菜籽半必需氨基酸含量2套遗传体系QTL定位的报道。
本研究拟利用包括环境互作效应在内的多遗传体系QTL作图方法和相应的定位软件, 对油菜籽丝氨酸、胱氨酸和酪氨酸含量进行种子胚和母体植株2套遗传体系的QTL的同时定位, 旨在明确不同环境条件下控制这3种半必需氨基酸含量表现的QTL在2套遗传体系基因组上的分布差异及其相应的遗传效应, 为今后进行分子标记辅助选择和主效基因的克隆提供一定的科学依据。
202个双单倍体(doubled haploid, DH)群体(TN DH)由华中农业大学构建[19]。该群体衍生于Tapidor × Ningyou 7, 其父本Ningyou 7 (宁油7号)为中国半冬性油菜品种, 母本Tapidor为欧洲冬油菜品种。
分别于2011年和2012年10月初, 将202个DH群体株系和双亲材料播种于浙江大学实验农场, 40 d后移栽。随机区组设计, 2次重复。各小区行株数为4× 8, 行株距为25 cm× 25 cm。开花时, 利用DH群体作为母本分别与亲本Tapidor (P1)和Ningyou 7 (P2)进行双向回交获得BC1F1 1和BC1F1 2群体, 由于天气、杂交和田间管理等原因, 本试验在2012年春均获得了191份双向回交BC1F1种子, 2013年春分别获得了177份BC1F11和181份BC1F1 2杂交种子。根据定位软件的要求, 采用2年都有双向回交种子的177份BC1F11和181份BC1F1 2作为QTL定位群体。成熟时收获双亲和回交种子用于测定油菜籽丝氨酸、胱氨酸和酪氨酸含量。
对每个样品分别取约3 g完整的籽粒, 置内径为3.6 cm的圆形杯中, 利用FOSS-5000型近红外光谱分析仪(FOSS NIRSystems, 丹麦)扫描收集光谱, 波长范围为1100~2498 nm。各样品重复扫描2次后取平均值, 转化为lg (l/R)。采用Chen等[20]确定的定标方法和定标方程分析样品光谱, 获得油菜籽丝氨酸、胱氨酸和酪氨酸含量数据。用SAS 9.1 (SAS Institute, Cary, North Carolina, USA)软件对各性状数据进行描述性统计分析和相关分析, 获得平均值、标准差、最大(小)值、偏度、峰度以及性状间的相关系数。
所用遗传图谱由华中农业大学Shi等[21]构建, 该定位图谱含有19个遗传连锁群(A1~A10, C1~C9), 共有786个分子标记(RFLPs、AFLP、Ms-AFLP、SSRs、STS、SNP、SSCP和CAPS), 覆盖基因组大小为2117.2 cM, 标记间平均距离为2.7 cM。利用新发展的双子叶作物种子品质性状多遗传体系QTL定位软件包QTLNetwork-CL-2.0-Seed [16], 以LOD值大于等于3.0作为QTL存在的阈值, 步长为1 cM进行染色体连锁群扫描, 对2个不同环境下收获的油菜籽丝氨酸、胱氨酸和酪氨酸含量同时进行胚和母体植株两套核基因组的QTL定位, 并分析包括胚加性效应、胚显性效应和母体加性效应在内的QTL主效应以及QTL× 环境(QE)互作效应。QTL命名原则遵循McCouch等[22]提出的命名方法。
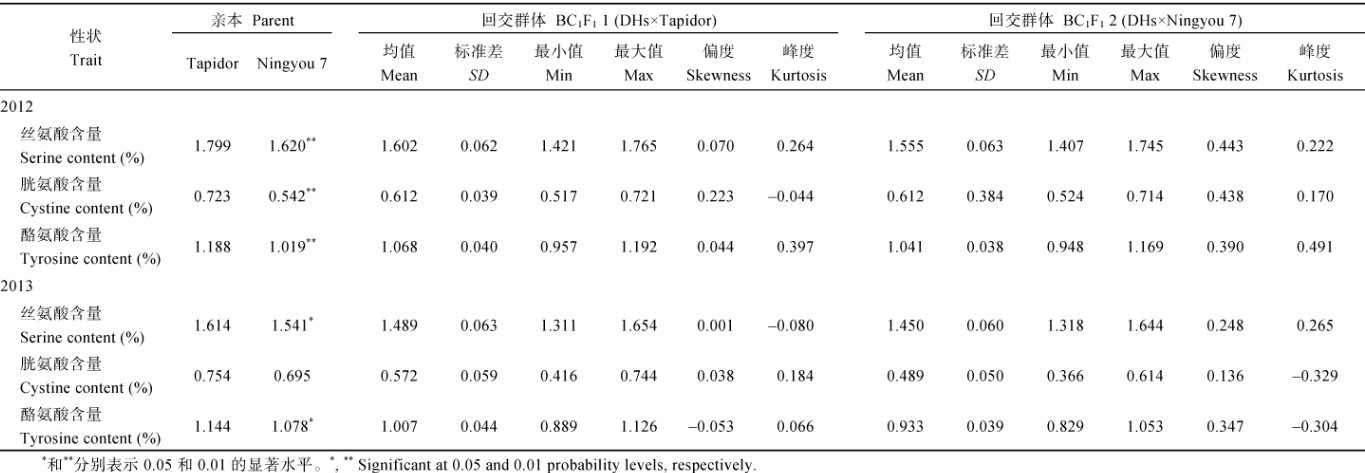
表1表明, 除2013年双亲的胱氨酸含量差异未达显著水平外, 2年试验中Tapidor亲本的3种氨基酸含量均显著或极显著高于Ningyou 7。在回交群体中, 2012年2个BC1F1群体的丝氨酸含量和2013年2个回交群体的3种氨基酸含量均低于双亲, 而2012年2个回交群体的胱氨酸和酪氨酸含量则居双亲之间。2个BC1F1群体中3种半必需氨基酸含量在不同环境的表型分布图中均呈现单峰连续变异, 其偏度和峰度绝对值均小于1, 符合正态分布, 说明这些性状为多基因控制的数量性状。此外, 回交后代还表现出单向或双向的超亲分离, 同一性状在不同环境条件下的表现也有所不同, 说明油菜籽半必需氨基酸含量的表现会在一定程度上受到环境因素的影响。
| 表 1 2012年和2013年亲本和回交群体油菜籽的半必需氨基酸含量 Table 1 Semi-essential amino acid contents of parents and the backeross populations of rapeseed DHs in 2012 and 2013 |
油菜籽丝氨酸与胱氨酸(r = 0.718* * )、丝氨酸与酪氨酸(r = 0.892* * )以及胱氨酸与酪氨酸含量(r = 0.907* * )之间的正相关已达到极显著水平, 且相关系数均较大, 说明这些半必需氨基酸的含量之间存在着明显的相关性。在油菜籽品质育种中, 能够同时改良这3种重要的半必需氨基酸含量。
共检测到12个控制油菜籽丝氨酸、胱氨酸或酪氨酸含量表现的QTL (表2)。这些QTL均具有极显著的胚和母体加性主效应, 其中qCysC-4-1、qCysC-8-2和qTyrC-12-3具有明显的QTL环境互作效应, qSerC-9-4、qSerC-12-5、qCysC-4-1、qTyrC-13-4和qTyrC-19-5是控制相关性状表现的主效QTL, 均可解释10%以上的表型变异[23]。
| 表2 油菜籽丝氨酸、胱氨酸和酪氨酸含量的QTL定位和遗传效应值 Table 2 QTL positions and genetic effects for serine, cystine and tyrosine contents of rapeseed |
2.3.1 丝氨酸含量 5个控制油菜籽丝氨酸含量的QTL分别被定位于A1、A4、A7、A9和C2连锁群(表2和图1), 共解释59.34%的表型变异。其中, 位于A9连锁群pW123aH~pW123bE区间的qSerC-9-4和位于C2连锁群em18me6-220~Na12C03区间的qSerC-12-5为主效QTL, 分别解释20.21%和37.22%的表型变异; 而qSerC-1-1 (R2=1.22%)、qSerC-4-2 (R2=0.20%)和qSerC-7-3 (R2=0.49%)则是控制丝氨酸含量表现的微效QTL。在QTL效应的表达上, 所有的QTL均具有极显著的胚和母体加性主效应, 说明种子胚和母体植株核基因组上的QTL表达对丝氨酸含量的表现均具有重要作用。其中qSerC-1-1、qSerC-7-3和qSerC-9-4具有起增效作用的正向极显著胚加性主效应和起减效作用的负向极显著母体加性主效应; 而qSerC-12-5具有起减效作用的负向胚加性主效应和起增效作用的正向母体加性主效应; qSerC-4-2负向的极显著胚和母体加性主效应都对丝氨酸含量起减效作用。未发现达到显著水平的胚显性主效应以及环境互作效应, 说明胚显性主效应对丝氨酸含量的表现作用不大, 且环境条件的变化对QTL表达的影响也较小。
 | 图1 油菜籽丝氨酸、胱氨酸和酪氨酸含量的QTL在染色体上的位置及其遗传效应Fig. 1 Positions (cM) and the genetic effects of QTLs for serine, cystine, and tyrosine contents in the chromosomes of rapeseed |
2.3.2 胱氨酸含量 在A4和A8染色体上发现了2个胱氨酸含量QTL, 共可解释29.66%的表型变异(表2和图1)。位于A4染色体HS-k02-2~HBr094间的qCysC-4-1的贡献率达到28.76%, 为控制油菜籽胱氨酸含量表现的主效QTL, 其达到极显著水平的正向胚加性主效应对胱氨酸含量起增效作用, 而极显著的负向母体加性主效应则起减效作用。位于A8染色体HR-S4-295和HR-C002-A8分子标记之间的qCysC-8-2只解释0.90%的表型变异, 属于微效QTL, 其极显著的胚加性主效应具有减效作用, 而极显著的母体加性主效应则具有增效作用。对这2个QTL都可检测到极显著的胚和母体加性主效应以及明显的环境互作效应, 未发现达到显著水平的胚显性主效应, 说明位于胚和母体植株核基因组上QTL的表达对胱氨酸含量的表现均有很重要的作用, 且易受环境条件变化的影响, 其表达所产生的胚显性主效应未显著影响油菜籽胱氨酸含量的表现。
2.3.3 酪氨酸含量 5个控制酪氨酸含量的QTL分别定位于A4、A7、C2、C3和C9染色体上, 能够解释59.26%的表型变异(表2和图1)。全部QTL所表达的胚和母体加性主效应均达极显著水平, 表明位于胚和母体植株这2套不同核基因组上的5个QTL均能显著影响油菜籽酪氨酸含量的表现。此外, 本试验未发现上述5个QTL具有显著的胚显性主效应, 说明胚显性主效应对酪氨酸含量的影响也不明显。其中, 位于C3染色体139.9 cM的qTyrC-13-4和位于C9染色体54.0 cM的qTyrC-19-5是控制酪氨酸含量表现的主效QTL, 可分别解释23.97%和33.76%的表型变异。qTyrC-13-4的极显著正向胚加性主效应对酪氨酸含量起增效作用, 而其极显著的负向母体加性主效应则起减效作用; qTyrC-19-5的极显著母体加性主效应具有增效作用, 而极显著负向的胚加性主效应则具有减效作用。qTyrC-4-1、qTyrC-7-2和qTyrC-12-3的贡献率分别为0.97%、0.17%和0.39%, 属于微效QTL。由于在qTyrC-12-3上还检测到显著的QTL环境互作效应(AeE1= -0.016* * , AmE1 = 0.015* * , AeE2 = 0.016* * , AmE2 = -0.016* * ), 说明该QTL的表达容易受到环境条件的影响。
2.3.4 QTL共定位分析 本试验两套遗传体系QTL定位分析的结果也发现在染色体上存在QTL成簇分布的现象。位于A4染色体HS-k02-2~HBr094区间的qSerC-4-2和qCysC-4-1, 以及位于HBr094~ CNU256区间的qTyrC-4-1均共定位于A4染色体HS-k02-2~CNU256区间内, 说明该QTL簇与半必需氨基酸性状的表现也有着密切关系。
多数的油菜籽品质性状都属于典型的数量性状。利用分子标记对控制油菜籽品质性状表现的QTL进行定位, 可将复杂的数量性状分解成简单的孟德尔数量性状位点(QTL)[24, 25], 有利于利用分子标记辅助选择技术进行更为有效的遗传改良。基于种子胚核基因组一套遗传体系, 目前已有一些关于油菜籽含油量、脂肪酸组分和蛋白质含量等品质性状QTL定位的报道, 并取得了明显的进展。利用芥菜型油菜的AFLP图谱, Subhadra等[26]共检测到控制油分、芥酸、二十碳烯酸、亚油酸、亚麻酸和棕榈酸含量的14个QTL; Mahmood等[27]利用RFLP遗传图谱发现6个控制含油量和5个控制蛋白质含量的QTL; 梅德圣等[28]采用复合区间作图法, 定位出与油分、蛋白质和硫苷含量相关的QTL 8个; 通过构建分子标记遗传图谱, Zhang等[29]获得棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸、二十碳烯酸和芥酸含量相关的QTL共22个。但作为生长在母体植株上的种子, 是雌雄配子受精后发育而成的新个体, 含有全部的遗传信息, 其生长发育所需的营养物质需要来自母体植株; 周围的生长环境(土壤、气候和田间管理等)在一定程度上也会影响种子的发育状况。基因型× 环境互作效应是除了遗传主效应之外的一部分可遗传的基因效应, 环境条件的变化会导致油菜品质性状基因表达方式或程度的不同, 因此需要在不同环境条件下进行甘蓝型油菜籽品质性状的QTL定位研究, 并采用包括基因型× 环境互作效应在内的QTL定位遗传模型及作图方法, 才能更好地分析控制油菜品质性状表现的QTL主效应和相应的QE效应。由于以前的一些研究已经表明油菜籽品质性状的表现除受制于种子胚自身核基因外, 还会受到母体植株核基因以及基因型与环境互作的影响[4, 12, 13, 14, 15], 因此, 很有必要同时考虑种子胚和母体植株不同遗传体系的QTL主效应以及QE效应对油菜籽品质性状的影响。
油菜籽丝氨酸、胱氨酸和酪氨酸含量等半必需氨基酸是重要的营养品质性状, 具有复杂的遗传基础。利用Yang等[16]基于胚和母体植株2套遗传体系的QTL定位方法, 可更好地深入了解油菜籽半必需氨基酸含量的遗传规律。本研究发现的12个QTL同时位于种子胚和母体植株2套不同的核基因组上, 且具有极显著的胚和母体加性主效应, 部分QTL还具有显著或极显著的环境互作效应, 因此在油菜籽品质性状的QTL定位以及遗传效应分析中确实有必要同时考虑种子胚和母体植株两套基因组中QTL信息以及环境变化对目标性状的影响。本试验中新发现的5个控制油菜籽丝氨酸、胱氨酸和酪氨酸含量表现的主效QTL (R2=20.21%~37.22%)以及与之紧密连锁的分子标记, 在今后的QTL精细定位和油菜籽品质改良的分子标记辅助选择中可能发挥重要作用。本试验中还发现控制胱氨酸或酪氨酸含量表现的3个QTL具有明显的QE效应, 说明环境条件的变化对一些油菜籽品质性状的表现有着不可忽视的作用, 在油菜籽品质育种中需加以重视。此外, 以前在油菜籽其他品质性状的研究中发现过QTL成簇分布的现象[26, 29, 30], 本研究也发现控制丝氨酸、胱氨酸和酪氨酸含量的qSerC-4-2、qCysC-4-1和qTyrC-4-1集中分布于同一区域, 说明这几个QTL可能表现为紧密连锁或具有一因多效的作用。其中qCysC-4-1为主效QTL, 在氨基酸的代谢途径中可能起着更为重要的作用, 与该位点紧密连锁的分子标记, 即HBr094、CNU256和HS-k02-2, 在分子标记辅助选择育种中可以加以利用, 在今后主效基因的图位克隆中也具有潜在作用。
对油菜籽丝氨酸、胱氨酸和酪氨酸3种半必需氨基酸含量进行胚和母体植株2套遗传体系QTL的同时定位, 检测到12个QTL。其中, 5个与丝氨酸含量相关的QTL (其中有2个主效QTL)均具有极显著的胚和母体加性主效应, 但未检测到显著的胚显性主效应和环境互作效应; 2个与胱氨酸含量相关的QTL (1个主效QTL), 均具有显著的胚和母体加性主效应以及环境互作效应, 但未检测到显著的胚显性主效应; 5个与酪氨酸含量相关的QTL (2个主效QTL)也具有极显著的胚和母体加性主效应, 其中1个QTL还具有极显著的环境互作效应, 但5个QTL均未发现具有明显的胚显性主效应。在染色体上存在着QTL成簇分布的现象。上述结果说明甘蓝型油菜籽半必需氨基酸含量的表现会同时受到种子胚和母体植株两套不同遗传体系核基因组QTL表达效应的影响。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|