第一作者联系方式: E-mail: zhm@jaas.ac.cn
维生素E (VE)具有提高人体免疫力、抗癌、预防心血管疾病等保健作用, 从大豆中提取的VE安全性更高。本研究采用高效液相色谱技术(HPLC)检测大豆BIEX群体(Essex×ZDD2315)维生素E的α-生育酚、γ-生育酚和δ-生育酚含量。应用QTLNetwork 2.1软件分别检测到8个和12对控制大豆维生素E及组分含量的加性和互作QTL。α-生育酚含量加性和互作QTL累计贡献值分别为8.68% (2个)和15.57% (4对), γ-生育酚含量加性和互作QTL累计贡献值分别为8.59% (2个)和11.57% (2对), δ-生育酚含量加性和互作QTL累计贡献值分别为5.44% (1个)和17.61% (3对), 维生素E总含量的加性和互作QTL累计贡献值分别为11.39% (3个)和9.48% (3对)。未检测到维生素E及组分含量和环境互作的QTL。未定位到的微效QTL累计贡献值为66.16%~75.32%, 说明未定位到的微效基因的变异占2/3以上。各性状的遗传构成中, 未检测出的微效QTL份额最大, 加性QTL和互作QTL贡献相差不大。在育种中应考虑常规方法聚合微效QTL与标记辅助方法聚合主要QTL相结合。
Vitamin E has effects on human immunity, anti-cancer and prevention of cardiovascular disease. Vitamin E from soybean has the advantages of higher security and higher human body absorption rate. The objective of the present study was to map the additive, additive × additive (epistasis), additive × year and epistasis × year QTLs for vitamin E and relative tocopherol contents with the RIL population BIEX (Essex×ZDD2315) using HPLC (high performance liquid chromatography) method and software QTLNetwork 2.1. Eight additive QTLs and twelve additive × additive (epistasis) QTLs were detected for vitamin E and relative tocopherol contents. The contributions to the phenotypic variances of additive QTL and epistatic QTL pairs were 8.68% (two QTLs) and 15.57% (four pairs) for α-tocopherol, 8.59% (two QTL) and 11.57% (two pairs) for γ-tocopherol, 5.44% (one QTL) and 17.61% (three pairs) for δ-tocopherol and 11.39% (three QTL) and 9.48% (three pairs) for total vitamin E contents, respectively. Those of additive and epistatic QTLs by year interaction were not found. The accumulated contribution of the unmapped minor QTLs was 66.16%-75.32%, indicating the variance of unmapped minor QTLs accounting for more than two thirds. In genetic composition, undetected minor QTLs accounted for a considerably large part additive QTLs and epistatic QTLs were nearly equal in α-tocopherol, γ-tocopherol, δ-tocopherol and total vitamin E contents. Accordingly, in breeding for vitamin E contents, the strategy of pyramiding multiple QTLs, both additive and epistatic, by using marker-assisted selection combined with accumulating minor effect QTLs through conversional procedures should be considered.
维生素E(VE)是脂溶性维生素, 主要由α 、β 、γ 、δ 型生育酚及其相应的三烯生育酚8种同系物组成。维生素E参与生物体内多种代谢途径, 不仅参与信号转导、基因表达调控、抗低温胁迫, 而且还具有提高机体免疫力、抗不育、抗癌及预防心血管疾病的作用[1, 2, 3, 4, 5]。在天然存在的4种生育酚中, α -生育酚的生物活性最高且被人体优先吸收和利用, α -生育酚大多存在于植物绿色组织中, 而γ -生育酚大多在种子中发现, 它是大豆油中的一种天然抗氧化剂[6], 可用来保持油脂的风味、延长油脂的储藏时间以及保证种子长期储藏后的种子活力。人体所需维生素E 70%来源于植物油, 它是良好天然维生素E来源。近年来, 天然维生素E年需求增长10%, 而实际年产量难以满足市场需求, 生产厂家主要集中在美国、日本、德国等发达国家, 中国国内产量有限。因此, 在有限的大豆种植面积下, 选育富含高维生素E的大豆品种, 尤其是富含高α -生育酚的大豆品种是满足大豆维生素E市场需求的必要途径[7, 8]。本研究解析了大豆籽粒维生素E含量的遗传控制基础, 可为选育高维生素E的大豆品种提供参考。
目前国内外研究大豆维生素E组分含量的遗传机制比较少。李卫东等[9]的研究表明, 大豆种子中VE含量受环境影响较大, 受多个基因控制。Dwiyanti等[10]用SSR标记分析了F2和F3群体中α -生育酚含量, 发现K连锁群对大豆种子α -生育酚含量有重要影响。由于维生素E检测的费用比较高, 相关的QTL定位不是很多。Li等[11]利用大豆RIL群体在3个环境发现在Dlb连锁群上同时控制α -、γ -、δ -生育酚的QTL, 在2个环境发现在N、A2和L连锁群上同时控制α -、γ -、δ -生育酚的QTL。定位大豆籽粒维生素E含量的QTL, 发掘紧密连锁的分子标记, 是解析大豆维生素E含量的遗传基础, 利用分子标记育种选育高维生素E含量大豆新品种的重要前提。本研究利用一个黄淮海产区夏大豆重组自交系群体(RIL)进行大豆种子维生素E含量的遗传分析, 检测α -、γ -、δ -生育酚和维生素E总含量的QTL, 以期为黄淮海产区大豆籽粒高维生素E或高α -生育酚含量的大豆品种选育奠定遗传学基础。
供试材料为河南省农业科学院经济作物研究所配制的Essex× ZDD2315杂交组合。包含208个家系的重组自交家系群体BIEX (F2:7-12), 即每一F2单株衍生成F7家系, 每一F7家系再选株建成家系, 至2008年是F13代。亲本Essex和ZDD2315分别来自美国南方和我国黄淮海地区。于2008年和2009年夏季在江苏省农业科学院六合基地种植试验群体及亲本, 采用随机区组设计, 3次重复, 2行区, 行长4 m。田间管理同一般大田生产。
维生素E测定方法参照GB/T5009.82-2003, 并略作改进, 改进的关键步骤是以正己烷代替乙醚, 提高了提取效果; 提取次数增加一次。从每个家系选取10.00~15.00 g籽粒饱满大小一致的大豆籽粒, 经样品研磨(FOSS, Knifetec 1095) 60 s粉碎, 称取2.5 g粉碎后的豆粉样品, 加入30 mL无水乙醇混匀, 再加10%抗坏血酸溶液5 mL和氢氧化钾溶液10 mL恒温水浴皂化30 min; 然后, 用100 mL正己烷分3次提取皂化液, 弃去水层; 最后, 将正己烷提取液通过无水硫酸钠, 过滤到旋转蒸发瓶中旋转近干, 用氮气吹干残留液后, 用2.5 mL甲醇溶解, 过0.45 µ m滤膜, 4℃冰箱保存备用。
利用高效液相色谱技术(HPLC), 采用外标法对生育酚各异构体进行定量分析。色谱柱为DIKMA公司产品, 色谱柱填料为symmetry, 钻石C18, 5 μ m, 柱规格为250.0 mm × 4.6 mm; 荧光检测器激发波长290 nm, 发射波长330 nm; 流动相为甲醇, 流速1.5 mL min-1; 柱温40℃; 进样量20 μ L; 检测时间10 min。以α -生育酚、γ -生育酚、δ -生育酚峰面积代入回归方程进行定量分析。由于β -生育酚在大豆籽粒中的含量很低, 忽略不计。维生素E总含量为α -、γ -、δ -生育酚值之和。
用SAS 8.01描述统计及方差分析。遗传率h2=σ g2/[σ g2+(σ ge2/n)+(σ 2/rn)], 其中σ g2为遗传方差, σ ge2为基因型× 年份(环境)方差, σ 2为误差方差, r为重复数, n为年份数; 遗传变异系数GCV(%)=σ g/μ × 100。其中σ g为遗传方差的标准差, μ 为群体平均数, 均由试验数据估计。
利用Mapmaker/Exp 3.0构建连锁图谱, 24个连锁群包括198个SSR标记, 覆盖2179 cM, 平均图距为11.0 cM。经与Song等[12]整合的图谱相比对, 标记排序相对一致。但O、D1b、N和F这4个连锁群由于大的gap分出小连锁群, 标记引物信息、标记试验过程及作图过程见参考文献[13]。
QTL定位主软件为QTLNetwork 2.1[14]。该软件是基于混合线性模型的复合区间作图方法, 遗传模型中包括加性、显性、上位性和环境互作等各种效应。利用回归分析对基因组进行一维扫描探测加性QTL以及二维扫描探测上位性, 采用基于Henderson方法III的F检验。用基于Gibbs抽样的Bayesian方法估计遗传效应。采用Piepho和Gauch[15]提出的标记成对选择方法(marker pair selection)选择复合区间作图中背景标记。本研究中将全基因组扫描的显著性水准设置为0.05, QTL检测的阈值以排列组合1000次结果为准[16], 将检测到的所有QTL以及它们之间的上位性互作整合到一个全QTL模型中估计遗传效应。
为核对定位效果, 本研究同时还利用WinQTLCart 2.5的复合区间作图(CIM)[17]和QTL IciMapping 2.0的复合区间作图(ICIM)[18]定位软件比较QTL定位结果。前者的遗传模型中包含加性和显性效应。后者的遗传模型中包括加性、显性和上位性效应。CIM法扫描时, 采用模型6 (标准模型), 在每个被测标记区间两侧设置10 cM的窗口(Window), 同时设置该窗口之外的5个标记作为余因子, 步移速度为2 cM, 向前回归法。对每个性状分别进行1000次排列测验(permutation test), 以确定每个性状的LOD阈值(显著水准0.05)。利用QTL IciMapping 2.0软件MET模块中ICIM法进行上位性QTL定位, 常用LOD值为2.0, 由于本研究包含2个环境, 再结合定位结果, 故选取LOD值为4.0, 超过阈值就认为存在QTL。
参考Chantret等的方法[19, 20, 21, 22]判断相同QTL, 并采取更为严格的条件, 即在置信区间相互重叠的基础上, 增加2个QTL位置不超过5 cM, 两侧标记至少有一个相同的条件, 这样的QTL看作同一个QTL。
表1列出了BIEX群体中维生素E组分的表型变异情况。α -生育酚亲本平均差为10.41 μ g g-1; γ -生育酚的亲本平均差为80.55 μ g g-1; δ -生育酚亲本平均差为13.98; 维生素E总含量亲本平均差为104.94 μ g g-1。维生素E及组分含量分布都呈数量性状的连续分布特点, 遗传变异系数从γ -生育酚的15.72%到δ -生育酚的27.08%, 同一性状不同年份间遗传变异系数接近。维生素E总含量两年遗传率96.18%, 3种组分2年综合的遗传率在89.21%~ 96.67%之间。所有性状均有较大幅度超亲分离, 表明亲本间位点互补。表2列出了2年联合方差分析结果。除了α -生育酚和δ -生育酚含量间表现差异不显著外, 其他生育酚在组分间均存在极显著差异 (P< 0.01), 年份和家系× 年份的互作方差未达显著水平, 即维生素E含量的表达受环境影响的程度较低。
| 表1 BIEX群体大豆种子维生素E含量表型变异 Table 1 Phenotypic variation of vitamin E contents of soybean seed in BIEX population |
| 表2 BIEX群体大豆种子维生素E含量方差分析 Table 2 Analysis of variance of vitamin E contents in two years in BIEX population |
如表3所示, 不同环境间α -生育酚与γ -生育酚和VE总含量之间都呈极显著相关性, 且相关系数均小于0.50, α -生育酚与δ -生育酚含量之间不显著相关, 这可能与它们在大豆籽粒中含量都比较少有关; γ -、δ -生育酚和VE总含量的相关系数均表现为γ -生育酚较高(0.98和0.83)、δ -生育酚较低(0.60和0.49), 这与它们在大豆籽粒中含量规律表现一致。
| 表3 大豆种子维生素E及相关生育酚含量的相关性分析 Table 3 Correlation analysis of vitamin E and correlated tocopherol contents in soybean seeds |
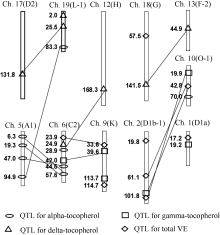
以QTLNetwork 2.1的定位结果为主, 共在6个连锁群上检测到维生素E及组分含量的8个加性QTL, 解释率2.40%~6.18%, QTL贡献值均小于10%, 这些检测到的QTL均在WinQTLCart 2.5中检测到(表4)。4种性状累计表型变异解释率依次为8.58%、7.98%、5.49%和11.49%。其中2个QTL在2年同时被WinQTL Cart 2.5和QTL IciMapping 2.0检测到(表4和图1)。
| 表4 BIEX群体中以 MCIM 法检测出的大豆籽粒维生素E含量的加性QTL Table 4 Additive QTL of vitamin E contents of soybean seed detected by MCIM in the BIEX population |
QTLNetwork2.1检测到了12对上位性QTL, 它们所占份额较小。同时各个性状还有许多未检测出来的微效QTL, 表型变异解释率从1.34%到7.79%。4种性状累计表型变异解释率依次为16.11%、12.14%、18.24%和8.02% (表5)。
| 表5 BIEX群体中以MCIM法检测出的大豆籽粒维生素E含量的互作QTL对 Table 5 Epistatic QTL pairs of VE contents of soybean seed detected by MCIM in the BIEX population |
3类QTL中, 各性状上位性互作QTL具有与加性QTL相近的贡献份额, 而未检测到与环境互作的QTL (表6和图2)。以下将分别对维生素E及组分含量各个性状的QTL作分析。
2.3.1 α -生育酚含量 在O-1和C2连锁群上各发现1个控制α -生育酚含量的加性QTL (表4和图1), 表型变异解释率分别为2.40%和6.18%, 累计8.58%。其中, 位于O-1连锁群的QTL加性效应为-1.08, 增加α -生育酚含量的等位基因来自ZDD2315; 而位于C2连锁群的QTL加性效应为1.78, 增加α -生育酚含量的等位基因来自Essex。qα 17-1可以同时被WinQTLCart 2.5和QTL IciMapping 2.0连续2年检测到。检测到4对显著互作的上位性QTL, 累计有16.11%的贡献值, 略大于加性QTL的累计贡献值。这说明, 在α -生育酚的遗传体系中, 加性和上位性QTL起重要作用。鉴于加性和上位性QTL贡献的总和只占24.69%, 而总遗传率为96.67%, 说明遗传变异中有约2/3以上为微效基因的变异(表6和图2)。
2.3.2 γ -生育酚含量 在K和D1a连锁群上发现2个控制γ -生育酚含量的加性QTL, 表型变异解释率为3.64%和4.34%, 总计解释7.98%的表型变异, 单个QTL效应都不大。2个QTL的加性效应均为负值, 增效基因均来自父本ZDD2315, qγ 20-1和qγ 24-1可以被WinQTLCart 2.5检测到。检测到了2对显著互作的上位性QTL, 累计表型变异解释率12.14%。说明在γ -生育酚的遗传体系中, 加性QTL和上位性QTL占有同样重要的地位。鉴于加性和上位性QTL贡献的总和只占20.12%, 而总遗传率为92.59%, 说明该性状遗传变异中有3/4以上为微效基因的变异(表6和图2)。
2.3.3 δ -生育酚含量 发现1个控制δ -生育酚含量的加性QTL和3对上位性的QTL, 加性QTL解释5.49%的表型变异, 3对上位性QTL对表型变异解释率为6.19%、4.85%和7.20%, 累计表型变异解释率18.24%。这说明加性和上位性效应对δ -生育酚的遗传起重要作用。加性QTL效应为负值, 说明增效基因来自ZDD2315, 可以同时被WinQTLCart 2.5和QTL IciMapping 2.0连续2年检测到。鉴于加性和上位性QTL贡献总和只占23.73%, 而总遗传率为89.21%, 说明该性状遗传变异中有2/3以上为微效基因的变异(表6和图2)。
2.3.4 维生素E总含量的QTL定位结果 在3个连锁群(G、K和D1a)上检测到了3个控制维生素E总含量的加性QTL, 总共解释了11.49%的表型变异, 范围从2.80%到5.63%。qTVE20-1和qTVE24-1的加性效应是负的, 增效基因来自ZDD2315; qTVE10-1加性效应是正的, 增效基因来自Essex。qTVE24-1、qTVE10-1和qTVE20-1可以同时被WinQTLCart 2.5检测到。检测到了3对显著互作的上位性QTL, 总计表型变异解释率8.02%, 略小于加性QTL的累计贡献值。这表明, 在维生素E总含量的遗传中, 加性QTL和上位性QTL占有同样重要的地位。维生素E总含量的加性和上位性QTL贡献总和占19.51%, 总遗传率为88.87%, 说明该性状遗传变异中有3/4以上为微效基因的变异(表6和图2)。
| 表6 QTL 及其互作对大豆种子维生素E含量表型变异的贡献 Table 6 Contributions of QTLs and their interactions to phenotypic variation for VE contents of soybean seed (%) |
2.3.5 维生素E及组分含量遗传体系的特点和性状间共享的标记 以上QTL结果表明, 维生素E及组分含量遗传体系中加性QTL和上位性QTL同样重要, 并且单个加性和上位性QTL的贡献均不大, γ -生育酚和δ -生育酚含量加性增效QTL均来自亲本ZDD2315, α -生育酚和维生素E总含量均有双亲增效位点互补, 微效基因贡献均在2/3以上。
本研究检测到的共享标记有: (1)控制δ -生育酚含量的加性和上位性位点qδ 14-1和δ -Toc-e1共享标记Sat_320和Satt313; (2)控制γ -生育酚和维生素E总含量的位点qγ 20-1和qTVE20-1共享标记Satt617和Satt001, 位点qγ 24-1和qTVE24-1共享标记Sat_346和Satt436。相关分析表明, γ -生育酚和维生素E总含量不同年份的相关系数为0.83和0.98, 上述共享的位点和标记可能是两性状相关的遗传基础。
大豆BIEX群体维生素E及α -、γ -、δ -生育酚含量定位的QTL中, 有4个标记在2年3种方法中均被检测到(表4), 包括标记Sat_402、Satt277、Sat_320和Satt313。如与α -生育酚含量相关的位于第6染色体上的标记Sat_402和Satt277, Li等[23]定位到标记Sat_402与叶绿素的合成有关, Satt277被认为与大豆花发育、种子蛋白质含量、油分、荚宽、荚成熟度、种子重量有关[24, 25], 说明在大豆营养生长和种子发育各个阶段, 可以通过有效措施调控α -生育酚的合成与积累。另外, Li等[11]检测到与α -生育酚含量相关的标记Satt376也位于第6染色体, Satt376 (GmComposite 2003_M, 97.83 cM)与Sat_402 (GmComposite 2003_M, 103.33 cM)相距5.50 cM。标记Satt376还被Han等[26]定位到与大豆单粒重相关, 并且定位区间为Satt376~Satt277, 与本文定位到控制α -生育酚含量的QTL区间Sat_402~Satt277有重叠, 表明Sat_402~Satt277标记区间对大豆单粒重和α -生育酚合成具有重要作用。另外, 与δ -生育酚含量相关位于第19染色体上的标记Sat_320和Satt313, 前人研究证明Satt313标记与种子含油量和耐铝胁迫相关[27, 28], 而这个标记未见报道与维生素E组分相关, 这可能是由于遗传背景不同所致; Sat_320标记未见报道与δ -生育酚含量相关, 它可能是控制δ -生育酚含量的新QTL, 其作用有待进一步研究证实。标记Sat_320 (GmComposite2003_M, 32.36 cM)Satt313 (GmComposite2003_M, 34.54 cM)相距2.18 cM。经Soybase网站检索Sat_320~Satt313区间内所公布的基因, 包含锌指蛋白 ZIP 转录因子(Glyma19.G099000), 可能与维生素E合成和调控有关; 该区间同时还包含有K+、Cl-、Ca2+调控基因(Glyma19.G098800、Glyma19.G098100和Glyma19.G 098900)以及抗逆境基因(Glyma19.G098200), 这些离子对干旱、盐渍化及其渗透胁迫的调节具有重要的作用, 说明该标记区间与维生素E组分和大豆逆境密切相关。所以, 本文发掘到的Sat_402~Satt277与Sat_320~Satt313标记区间及其标记在大豆品质育种和抗逆育种中具有重要作用。
第9和第1染色体上的标记区间Satt617~ Satt001和Sat_346~Satt436都与γ -生育酚含量和维生素E总含量相关, 均可以被WinQTLCart 2.5检测到, 其加性效应为负值, 说明这4个QTL对γ -生育酚和维生素E总含量起负向作用, 等位基因来源于低含量亲本ZDD2315。维生素E生物合成途径中5个关键酶大致可以分为两类, 即以提高维生素E含量为主要作用的酶, 包括HPPD和HPT; 以改变维生素E组成为主要作用的酶, 包括MPBQMT、TC和γ -TMT。催化γ -异构体转化成α -异构体的酶是合成途径的最后一个关键酶γ -TMT[29]。本研究中定位到的控制γ -生育酚含量的QTL与大豆γ -TMT基因Glyma12g01690[30]不在同一个染色体, 而与尿黑酸叶绿基转移酶HPT (GenBank登录号为DQ231061)基因[31]位于相同染色体(Gm09: 18 579 763~18 585 148), 但与Satt617标记(Gm09: 31 816 370~31 816 414)相距较远。这2个标记区间及标记尚未见报道与维生素E含量相关, 说明本文定位到的这4个QTL (qγ 20-1、qγ 24-1、qTVE20-1和qTVE24-1)可能是控制维生素E含量的新QTL。本研究还定位到qα 3-1和qTVE10-1与前人[10, 11]研究不同, 它们也可能是维生素E及组分含量的新位点, 其作用有待进一步研究证实。
本研究维生素E及组分在内的4种性状一共检测到8个加性QTL和12对上位性QTL。由相关分析可知, α -生育酚和γ -生育酚含量、维生素E总含量存在着极显著正相关(P< 0.001), γ -生育酚与VE总含量存在着极显著正相关(P< 0.001), δ -生育酚和γ -生育酚含量存在着极显著正相关(P< 0.001)。从QTL间的连锁关系可以看出这种相关的遗传基础。(1) α -生育酚和γ -生育酚含量: O-1连锁群上检测到控制α -生育酚含量的加性QTL qα 3-1与控制γ -生育酚含量的上位性QTL γ -Toc-e1, 1位于同一连锁群的不同区间, 加性效应一正一负, 这表明在O-1连锁群这2个区段可能存在同时降低α -生育酚含量和提高γ -生育酚含量的主效QTL和上位性QTL。(2) α -生育酚和维生素E总含量: 控制α -生育酚含量的加性QTL qα 17-1与控制维生素E总含量的上位性QTL TVE-e3, 1位于C2连锁群的同一区间, 加性效应相反。而位于O-1连锁群上控制α -生育酚含量的加性QTLqα 3-1与控制维生素E总含量的上位性QTL (TVE-e1, 1和TVE-e2, 1)定位区间不同, 加性效应有正有负。这表明在C2和O-1连锁群可能存在同时调控α -生育酚和维生素E总含量的主效QTL和互作QTL。(3) γ -生育酚和维生素E总含量: 控制γ -生育酚含量的加性QTL qγ 20-1与控制维生素E总含量的上位性QTL TVE-e3, 2位于K连锁群的不同区间, 均表现负向效应, 这表明在K连锁群这2个区段可能存在同时降低γ -生育酚和维生素E总含量的主效QTL和上位性QTL。(4) δ -生育酚和γ -生育酚含量: 控制δ -生育酚含量的上位性QTL (δ -Toc-e3, 2)和控制γ -生育酚含量的上位性QTL (γ -Toc-e2, 1)位于C2连锁群的不同区间, 均表现负向效应。这表明这2个区段可能存在同时降低δ -生育酚和γ -生育酚含量的互作QTL。QTL的定位结果与性状的表型相关一致性较好, 说明了性状相关的遗传基础可能来源于控制数量性状位点的QTL间的连锁。此外, δ -生育酚和维生素E总含量存在极显著的正相关(P< 0.001), 但是在加性QTL和互作QTL中没有检测到相关QTL间的连锁, 这说明可能还有许多没有检测到的微效QTL在起作用。
所检测到的8个加性QTL中, 加性QTL qα 17-1和qδ 14-1与互作QTLδ -Toc-e3, 2、TVE-e3, 1和δ -Toc-e1, 2在同一区间。此外, 其他加性QTL均未参与互作, 互作大多是非加性QTL之间的互作。这说明控制维生素E及组分含量的一些QTL是独立作用的, 不受其他QTL的影响, 而另一些QTL是和其他QTL一起存在时才有效应。
维生素E含有3种主要生育酚, 所以在遗传上维生素E总含量与其组分之间可能会有联系。Li等[11]利用F2:7群体合丰25× Bayfield对维生素E及组分含量进行定位, 在3个地区均检测到Dlb连锁群上同时控制维生素E及组分生育酚含量相关的QTL, 2个地区在N、A2和L连锁群上均检测到控制维生素E及组分生育酚含量相关的QTL。本研究利用Essex× ZDD2315 (F2:7~12)群体对维生素E及组分含量进行定位, α -生育酚和γ -生育酚含量各检测到2个加性QTL, 4对和2对上位性QTL, 其中O-1连锁群上有1个加性QTL和上位性QTL (即前文提到的qα 3-1和γ -Toc-e1, 1)与α -生育酚和γ -生育酚含量相关, 二者效应相反; C2连锁群上控制α -生育酚的加性QTL (qα 17-1)与维生素E总含量的上位性QTL (TVE-e3, 1)均位于同一区间, 但二者效应相反。本研究表明, 在维生素E组分调控体系中控制各组分的基因可能不同。在育种实践中, 需要提高α -生育酚含量或维生素E总含量, 而O-1和C2连锁群上检测到的QTL分别在2个性状中的效应是相反的, 且涉及了上位性, 在实际利用中有一定难度。
维生素E及组分生育酚含量表型变异和遗传变异的组成情况见表6和图2。本研究检测到4个性状的加性和上位性所占遗传变异的比例均只有1/4~1/3, 说明维生素E及其生育酚组分之间还存在大量微效位点。另外, 所有加性和上位性均未检测到显著的环境互作, 这可能是因为加性、上位性与环境互作效应较小而不易检出。大豆维生素E与年份方差未达显著水平, 这与李灵娟[32]研究甘蓝DH群体在多环境下总生育酚的合成量不随生长环境变化而稳定表达相似。
作为一个育种者, 我们希望得到效应大的QTL用于标记辅助选择, 但本文检测到的单个加性QTL和互作QTL的贡献率均小于10%。因此, 如何转移和聚合包括微效基因在内的多基因对育种者来说将是一个挑战。
利用QTLNetwork 2.1结合WinQTLCart 2.5和QTL IciMapping 2.0软件共检测到8个和12对控制大豆维生素E及组分生育酚含量的加性和互作QTL。微效基因的方差是遗传方差扣除加性和上位性方差后的剩余部分, 其中α -生育酚含量加性、互作QTL和未定位到QTL的微效基因累计贡献值分别为8.68% (2个)、15.57% (4对)和72.42%, 未检测到的微效基因变异约占遗传变异的3/4。γ -生育酚、δ -生育酚和维生素E总含量的加性QTL累计贡献值分别为8.59% (2)、5.44% (1)和11.39% (3); 互作QTL累计贡献值分别为11.57% (2)、17.61% (3)和9.48% (3); 未定位到的QTL累计贡献值72.43%、66.16%和75.32%, 说明未定位到的微效基因的变异约占2/3以上。各性状的遗传构成中, 未检测出的微效QTL份额最大, 加性QTL和互作QTL贡献相差不大。对这种遗传组成性状的育种要考虑在常规方法聚合微效QTL基础上, 结合标记辅助方法聚合主要QTL。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|