第一作者联系方式: E-mail:xujunqiang101@163.com
为研究SPT和HEC及其相互作用对甘蓝雌蕊发育的影响, 以结球甘蓝自交不亲和系E1为材料, 提取雌蕊总RNA, 根据拟南芥中
To explore interaction of SPT and HECs in cabbage pistil development, we took stigma of self-incompatibility line E1 to obtain total RNA for first-strain cDNA synthesis, and cloned
植物雌蕊是种子生产和传播的复杂器官, 它由心皮、柱头及花柱、胚珠和子房组成。在受精过程中,花粉粒在柱头萌发并向下生长通过柱头和传输束伸向胚珠。传输束细胞分泌一种复杂的富含酸性多糖和促进花粉管生长的细胞外基质(ECM), 控制细胞死亡发育的过程, 传输束分化失败将导致花粉管生长受限及生育能力降低[ 1, 2, 3]。研究提出了引导花粉管从柱头到传输束并穿出传输束向胚珠的许多化学梯度或信号分子机制[ 4, 5, 6]。
雌蕊发育对植物繁殖至关重要, 该过程可能受到高度调控。包括 SPATULA( S PT) 、 STYLISH1( STY1) 、 STYLISH2( STY2)和 ETTIN( ETT)等许多基因在柱头、花柱、隔膜和传输束中的鉴定。 SPT编码在隔膜和柱头发育早期表达的bHLH转录因子。bHLH蛋白以二聚体的形式结合到DNA识别位点, 大部分bHLH蛋白识别E-box (CANNTG)或G-box (CACGTG)[ 7]。SPT功能缺失导致隔膜和顶端心皮融合缺陷、传输束丧失以及柱头组织发育减少[ 8, 9]。 STY1和 STY2编码在花柱发育中行使功能的环指蛋白[ 10, 11]。 SPT突变体在 sty1突变体上游, 表明 SPT和 STY作用于相同的路径[ 11]。编码生长素应答因子(ARF)的 ETT基因抑制 SPT表达结构域。 ett突变体中的传输束组织在雌蕊外侧发育, 从 ett突变体中消除 SPT功能来补救突变缺陷[ 9]。SPT最初在拟南芥心皮器官发生上确定, 能影响雌蕊形态[ 12], 且SPT是心皮边际及衍生组织发育和增殖必需的[ 9, 10, 11, 12]。此外, 拟南芥SPT在子叶[ 13]、叶片[ 14]、雌蕊[ 9, 12, 15]、果实[ 16, 17]、萌发的种子[ 18]和根[ 19]不同器官行使其功能。SPT功能突变导致子叶增大、下胚轴增长及叶片增大, 而超表达导致器官变小[ 13, 20, 21]、细胞数目或细胞大小的变化表明SPT调控细胞分化和细胞增殖过程。
Gremski等[ 22]在拟南芥中报道的 HECATE1 ( HEC1)、 HECATE2( HEC2)和 HECATE3( HEC3)是在雌蕊发育过程中发挥重要作用3个基因, 它们编码具有重叠功能的bHLH转录因子。 HEC缺失导致传输束、隔膜和柱头缺陷及生殖能力降低, hec1突变体中生殖能力降低, 包括花粉管畸形或减少。 HEC基因超表达导致异常柱头组织的产生和获得性功能表型, 表明它们是生长素信号途径组件。 hec1突变体中柱头和花柱都明显发育异常, 柱头明显变小。在酵母双杂系统中HEC蛋白与SPT可能形成异源二聚体, 表明这些蛋白很可能在控制发育中相互作用[ 15, 22]。Gremski等[ 22]对拟南芥研究表明, SSPT和HEC之间可能相互作用。 SPT比 HEC基因在雌蕊发育阶段表达要早, 所以, SPT是 HEC基因表达上游调控因子的这种可能性是存在的, 但SPT蛋白并不是HEC表达所必需的。
目前, 拟南芥 SPT和 HEC基因的研究有了一定的进展, 但在芸薹属作物上相对较少。本研究通过结球甘蓝中 SPT和 HEC1基因的克隆、表达分析、体外相互作用检测及酵母双杂交检测, 拟探索2个bHLH转录因子相互作用机制, 揭示甘蓝雌蕊发育过程。
结球甘蓝自交不亲和系E1由重庆市蔬菜学重点实验室提供。在RXZ型智能人工气候箱中播种, 幼苗在20℃ 16 h光照/18℃ 8 h黑暗的条件下生长, 成苗后移至试验田, 经过冬天低温春化。2013年3月取盛花期自交不亲和系材料于-80℃冻存, 用于RNA提取。
使用TRIzol法提取甘蓝雌蕊总RNA, 根据拟南芥 SPT(NM_119857.2)和 HEC1(NP_201507.1)基因序列设计PCR扩增引物SPT-F/SPT-R和HEC1-F/HEC1-R (表1)用于cDNA序列的扩增, RT-PCR扩增体系为: ddH2O 15.4 μL, 10×PCR缓冲液2.5 μL, 2 mmol L-1 dNTPs 2.5 μL, 25 mmol L-1 MgSO4 1.6 μL, 上下游引物各1 μL, KOD DNA聚合酶0.5 μL, 模板DNA 0.5 μL。
PCR扩增参数为94℃ 3 min; 94℃ 30 s, 54℃ 30 s, 72℃ 30 s; 38个循环。回收目的片段, 分别连接到pEASY-Bluntsimple克隆载体, 转化 E. coliJM109感受态细胞, 经蓝白斑筛选后, 挑取阳性克隆酶切鉴定并测序, 分别命名为pB-SPT和pB-HEC1。
分别采取结球甘蓝根、茎、叶、花蕾、花药、雌蕊和果荚样本, 提取总RNA, 反转录cDNA。采用Livak Method (2-ΔΔCt)在C1000 Thermal Cycler (Bio- Rad)上进行实时荧光定量RT-PCR。以 β-Actin和 Tublin为内参基因(表1, Actin-F/Actin-R、Tub-F/Tub- R), SPT和 HEC1基因表达分析引物为Spt-F/Spt-R、Hec1-F/Hec1-R (表1), 使用SsoFastEvaGreen Supermix (Bio-Rad)配制反应体系, 扩增条件为95℃ 2 min; 95℃ 5 s, 60℃ 30 s, 39循环; 72℃ 30 s。每个取样点设3个技术重复, 3个生物学重复。
提取pB-SPT和pB-HEC1质粒, pB-SPT和pCold I 载体质粒经 Nde I/ EcoR I双酶切后连接, pGEX-4T-1和pB-HEC1共同使用 EcoR I/ Xho I双酶切后连接, 将重组质粒转化大肠杆菌JM109。提取重组质粒并命名为pCold I-SPT和pGEX-HEC1, 分别双酶切鉴定后送华大基因公司测序验证。
| 表1 试验中使用的引物序列 Table 1 Primers used in this experiment |
将重组质粒pCold I-SPT和pGEX-HEC1分别转化表达菌株 E. coliRosetta (DE3)。挑取单菌落, 接种于5 mL含有50 μg mL-1氨苄青霉素的LB液体培养基, 37℃振荡培养过夜。次日, 1∶100扩大培养过夜培养物按至OD600为0.4~0.6时将pCold I-SPT置15℃放置30 min, 加入终浓度为0.5 mmol L-1的IPTG, 分别于15℃和30℃振荡培养过夜。收集菌体, 并以超声波破碎, 按Mag Extractor-GST-tag-和Mag Extractor-His-tag-蛋白纯化试剂盒说明纯化其体外表达的重组蛋白产物。将纯化得到的GST标签的融合蛋白pGEX-HEC1加入吸附有pCold I-SPT的Ni-NTA柱中, 于4℃避光孵育2 h, 用10倍柱体积的MCAC缓冲液清洗, 用2倍柱体积的洗脱液(MCAC缓冲液含250 mmol L-1咪唑)洗脱, 最后经SDS-PAGE电泳并分析结果。
1.5.1 SPT与HEC1相互作用的酵母载体构建
用引物对SPT-FY/SPT-RY从pB-SPT载体上扩增 SPT的完整ORF序列; 引物对H1-FY/H1-RY从pB-HEC1扩增 HEC1的完整ORF序列。上下游分别引入 Nde I、 EcoR I酶切位点。
用 Nde I和 EcoR I分别对扩增产物 SPT和 HEC1克隆载体质粒及酵母表达质粒pGBKT7、pGADT7进行双酶切; 将 SPT片段与pGBKT7连接, 转化 E. coliJM109感受态细胞, 涂于LB平板上(含Kan+抗性); HEC1片段与pGADT7连接, 转化 E. coliJM109感受态细胞, 涂于LB平板上(含Amp+抗性)。同时, 连接互换载体。37℃培养过夜, 筛选阳性重组子, 并进行菌液PCR和酶切鉴定, 将含有插入目的片段的阳性克隆送华大基因公司测序。将序列正确的重组质粒分别命名为pGBKT7-SPT、pGADT7-HEC1及pGBKT7-HEC1、pGADT7-SPT。
1.5.2 SPT与HEC1酵母表达质粒毒性检测和自激活检测 根据Matchmaker Gold Yeast Two-Hybrid System User Manual, 利用LiAc法制备酵母Y2HGold和Y187感受态细胞。用PEG/LiAc法将pGBKT7空载体和重组诱饵载体pGBKT7-SPT同时转化Y2HGold酵母感受态细胞, 30℃培养3~5 d, 观察其在SD/-Trp筛选平板上的生长情况。同样的方法将pGADT7空载体和重组AD质粒pGADT7- HEC1转化Y187感受态细胞, 观察其在SD/-Leu平板上的生长情况。其他重组质粒按上述方法进行毒性检测。
用PEG/LiAc法将pGBKT7-SPT转化Y2HGold酵母感受态细胞, 分别铺于SD/-Trp、SD/-Trp/X-α- gal、SD/-Trp/X-α-gal/AbA平板上; 将pGADT7- HEC1转化Y187感受态细胞, 分别涂于SD/-Leu、SD/-Leu/X-α-gal平板上, 30℃孵育3~5 d, 观察Y2HGold [pGBKT7-SPT]、Y187 [pGADT7-HEC1]在选择平板上的生长情况。同时设Y2HGold [pGBKT7- Lam] × Y187 [pGADT7-T](阴性对照)组和Y2HGold [pGBKT7-p53] × Y187 [pGADT7-T](阳性对照)组。其他重组质粒按上述方法进行自激活检测。
1.5.3 SPT与HEC1蛋白相互作用检测 分别挑取SD/-Trp、SD/-Leu平板上的单菌落, 将含有不同基因片段的Y2HGold转化菌落与含有不同基因的Y187转化菌落两两组合, 同时接种于2 × YPDA液体(500 μL)培养基中, 30℃振荡培养18~20 h, 在显微镜下检测Y2HGold与Y187形成二倍体的情况; 并设Y2HGold [pGBKT7-Lam] × Y187 [pGADT7-T] (阴性对照)组和Y2HGold [pGBKT7-p53] × Y187 [pGADT7-T] (阳性对照)组。然后将融合菌液涂布到SD/-Trp-Leu、SD/-Trp-Leu/X-α-gal/AbA平板上, 30℃培养; 最后将平板上的蓝色克隆画线至SD/-Trp-Leu-Ade-His/X- α-gal/AbA板, 观察其生长情况。
提取雌蕊总RNA反转录成cDNA, 克隆到 SPT基因cDNA序列, 其全长1085 bp, 开放阅读框1062 bp, GC含量54.37%, 根据其cDNA序列推导得到SPT蛋白共353个氨基酸残基, 预测分子量为37.67 kD, 等电点为6.83。 HEC1基因cDNA序列, 完整开放阅读框696 bp, 编码231个氨基酸残基, 预测分子量为 25.26 kD, 等电点为10.23。
通过SignalP分析(http://genome.cbs.dtu.dk/services/SignalP-2.0/), 该蛋白不含信号肽; TargetP (http://genome.cbs.dtu.dk/services/TargetP/)及PSORT软件预测亚细胞定位表明, SPT蛋白位于细胞核中的可能性最大, 在其他部位可能性较小, 说明SPT蛋白是一种核蛋白。基因结构在线预测分析(http://smart. embl-heidelberg.de/)表明, SPT蛋白具有bHLH家族结构域(图1), bHLH结构域位于173~221位氨基酸处, 两亲性螺旋位于(DEISLFLRHII) 34~44位氨基酸, 酸性结构域(ETDGYDCESEEGVE)位于139~ 152位氨基酸处, 2个核定位信号(KRCR、KRRR)分别位于169~172和182~184处[ 23]。跨膜域分析表明(http://genome.cbs.dtu.dk/services/TMHMM/), 该蛋白不含跨膜区, 且位于膜外。HEC1蛋白也具有bHLH家族结构域, 第122位为丙氨酸(图1), HLH结构域位于127~170位氨基酸处, 不含核定位信号和信号肽。预测蛋白质的相互作用(http://string. embl.de/)发现SPT蛋白能与ALC、IND、RLG2、HEC1、HEC2、HEC3等共10个蛋白存在不同程度的相互作用, 其中与IND蛋白相互作用的预测值最高, 为0.872, 与HEC1蛋白的相互作用预测值为0.843。
经NCBI氨基酸序列比对, SPT属于转录因子超家族。序列分析结果显示SPT具有动植物转录因子特有的bHLH结构域。从NCBI数据库检索到部分与SPT氨基酸序列同源性较高的高等植物蛋白家族氨基酸序列, 用ClustalX2比对, MEGA5软件构建系统发生树(图2)。系统发生树表明结球甘蓝SPT与拟南芥AtSPT (NM_119857)和AlSPT (XP_002866965)位于相同进化支上, 与上述两者的同源性最高。而BoHEC1与拟南芥AtHEC1(NP_201507)的同源性最高(图2), 与AtHEC2的同源性也很高。
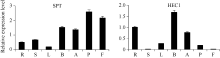
由图3可知, 结球甘蓝 SPT和 HEC1基因在植株的多个器官中均表达, 但表达量不尽相同。 SPT在果实和雌蕊中的表达量最高, 叶片中的表达量最低, 其他组织中的表达量相当, 说明SPT在甘蓝的各个组织器官中均有不同的作用。 HEC1在各个器官中的表达量差异较大, 在根和花蕾中最高且相近, 在雌蕊中较低, 而在果实和茎中极低。说明两基因在雌蕊发育中均起一定的调控作用。
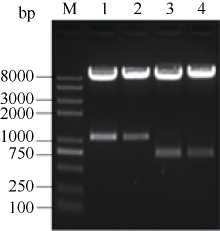
2.5.1 SPT与HEC1原核表达构建 得到的表达质粒pCold I-SPT和pGEX-HEC1, 经双酶切分别得到1060 bp和700 bp左右条带(图4), 测序结果表明, 插入pCold I和pGEX-4T-1载体的位点和方向完全正确。
 | 图4 重组质粒pCold I-SPT和pGEX-HEC1双酶切检测A: pCold I-SPT双酶切; B: pGEX-HEC1双酶切。Fig. 4 Digestion of pCold I-SPT and pGEX-HEC1A: pCold I-SPT digested; B : pGEX-HEC1 digested. |
2.5.2 重组蛋白的诱导表达及相互作用检测
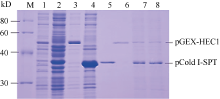
图5的SDS-PAGE结果显示, 有pCold I-SPT和pGEX-HEC1重组蛋白表达的特异带出现, 分别表达出37 kD和50 kD左右的融合蛋白, 蛋白质相对分子量均与预期值相当。表明表达质粒pCold I-SPT和pGEX-HEC1构建正确, 且融合蛋白在大肠杆菌中正确表达。采用TOYOBO Mag Extractor-His-tag-和Mag Extractor-GST-tag-蛋白纯化试剂盒分别纯化体外表达的两融合蛋白pCold I-SPT (图5, 泳道5)和pGEX-HEC1 (图5, 泳道6)。由图5 (泳道7~8)结果可以看出, 两融合蛋白形成异源二聚体, 说明两者能够在体外进行相互作用。
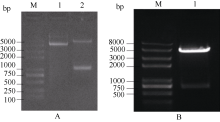
2.6.1 SPT与HEC1酵母载体的构建 图6表明, 通过SPT-FY/RY和H1-FY/RY引物对分别从克隆载体上克隆得到SPT和HEC1片段, 将各片段分别插入酵母载体相应酶切位点。图7表明, 重组质粒pGBKT7-SPT、pGADT7-HEC1和pGBKT7-HEC1、pGADT7-SPT的酶切检测结果与预期一致, 将测序正确的质粒通过化学转化法转入相应酵母菌株。
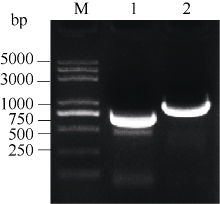 | 图6 SPT和 HEC1基因酵母载体片段的扩增泳道1和2分别为 SPT和 HEC1扩增。Fig. 6 PCR products of SPT and HEC1 genesLanes 1 and 2 are amplification of SPT and HEC1, respectively. |
2.6.2 融合蛋白的毒性检测与自激活检测 酵母Y187 (pGADT7-SPT)和Y187 (pGADT7-HEC1)在单缺培养基SD/-Leu上与对照酵母Y187 (pGADT7), 在画单线培养3 d后观察发现各酵母菌间菌落大小相似, 可知重组质粒对酵母Y187没有毒性; 而酵母Y2HGold (pGBKT7-SPT)和Y2HGold (pGBKT7- HEC1)与对照Y2HGold (pGBKT7)在单缺培养基SD/-Trp上单克隆菌落大小相似, 重组质粒Y2HGold (pGBKT7-CaM12)对酵母Y2HGold无毒性。
在SD/-Leu和SD/-Leu/X-α-gal固体培养基上, Y187 (pGADT7-SPT)和Y187 (pGADT7-HEC1)都能长出白色菌落, 但在SD/-Leu/X-α-gal/AbA和SD/- Leu/-Trp培养基上不能生长。在SD/-Trp和SD/-Trp/ X-α-gal培养基上, Y2HGold (pGBKT7-SPT)和Y2HGold (pGBKT7-HEC1)能长出白色菌落, 但在SD/-Leu/- Trp和SD/-Trp/X-α-gal/AbA培养基上都不能生长。而阳性对照Y187 (pGADT7-T)×Y2HGold (pGBKT7-53)在SD/-Leu/X-α-gal/AbA和SD/-Trp/X-α-gal/AbA培养基上菌落呈蓝色。在SD/-Leu/X-α-gal和SD/-Trp/ X-α-gal培养基上阴性对照Y187 (pGADT7-T) × Y2HGold (pGBKT7-Lam)都有白色菌落, 而阴性对照在SD/-Leu/X-α-gal/AbA和SD/-Trp/X-α-gal/AbA培养基上都不能生长(表2)。说明连接至酵母载体的基因片段在酵母表达载体和对应的酵母菌株中均不能自主激活 MEL1和 AUR1-C报告基因, 无自身转录激活活性。
2.6.3 SPT HEC1的酵母相互作用 将Y2HGold (pGBKT7-SPT)、Y2HGold (pGBKT7)、Y187 (pGADT7)、Y187 (pGADT7-HEC1)、Y187 (pGADT7-SPT)和Y2 HGold (pGBKT7-HEC1)按照表2的组合依次融合为二倍体酵母。5~11号二倍体酵母在SD/-Leu/-Trp, 但除阳性对照以外仅有9号与10号组合在SD/-Ade/- His/-Leu/-Trp和SD/-Ade/-His/-Leu/-Trp/X-α-gal/ AbA上能够生长并成蓝色(图8)。由此可推测, 二倍体酵母9号与10号的报告基因HIS3、AUR1-C、和ADE2均被激活, 说明在酵母二倍体中, SPT能与HEC1发生相互作用。
拟南芥bHLH蛋白大都可能从与动植物中Group BbHLH共同的祖先进化而来, 且basic域含保守的谷氨酸[ 24, 25], 它位于bHLH识别序列与DNA结合。SPT含有该关键的谷氨酸(图1), 而HEC在该处以丙氨酸代替[ 22]。缺少该谷氨酸的动物Group-C与Group-B bHLH蛋白用不同的识别位点结合DNA[ 26, 27]。
| 表2 酵母中SPT与HEC1相互作用分析 Table 2 Analysis of interaction between SPT and HEC1 |
本研究从结球甘蓝雌蕊中克隆得到 SPT基因, 编码353个氨基酸, 比 AtSPT的373个少20个, 但N端含有典型保守的bHLH结构域, 在SPT氨基酸序列第181位含有保守的谷氨酸。同时从甘蓝中克隆得到 HEC1基因, 同样属于bHLH家族, 编码231个氨基酸, 拟南芥中 HEC1、 HEC2和 HEC3分别编码242、232和225氨基酸[ 22], 与AtHEC1氨基酸序列比对, C端高度保守性, 而N端的保守性较差, 在88~93、190~193位氨基酸处分别缺少6个和3个氨基酸, 由于不包含于bHLH结构域中, 对基因功能可能没有影响, 这种C端不保守序列可能形成了物种间的多样性。
SPT基因在植物各组织中广泛表达[ 8]。SPT在萼片中没有表达, 但在花瓣和雄蕊中有较弱表达。另外, SPT也在顶端分生组织、幼叶、托叶、茎、维管组织及侧根中表达。Gremski等[ 22]研究表明, HEC1基因在隔膜、传输束和柱头中表达。本研究中SPT在各种组织中均表达, 且在雌蕊中表达量很高; SPT在幼叶中表达量高, 可以控制幼叶的大小[ 28], 而本研究的叶片中表达较低, 可能是 SPT在成熟叶中的作用没有在幼叶中那样明显, 同样 HEC1在柱头中也表达, 说明其可能参与雌蕊发育调控过程。
Heisler[ 9]提出, SPT在雌蕊发育的早期表达且比 HEC早, 因此SPT可能是HEC表达的上游调控子。Gremski等[ 22]研究指出, 在 spt-2等位基因植株中HEC仍能够表达, 说明不需要SPT的激活作用, 于是提出两者可能形成异源二聚体, 且验证了其在拟南芥中的相互作用, 而HEC之间不能形成同源或异源二聚体。为研究甘蓝SPT和HEC1的相互作用, 构建了两基因的原核表达载体, 经过蛋白纯化, 通过Pull-down试验初步检测了两基因可能存在相互作用。同时本研究构建了两基因的酵母表达载体, 通过酵母双杂交试验验证了相互作用的可能性, 运用酵母双杂交技术对SPT-HEC1之间相互作用的检测发现, 同时转化SPT-HEC1的酵母在加入AbA和X-α-gal的四缺培养基中能够正常生长, 证明它能够同时激活下游4种报告基因表达, 表明SPT与HEC1之间存在相互作用。该结果进一步支持了Gremski等[ 22]提出的拟南芥SPT和HEC之间可能存在相互作用的观点。
SPT和HEC相互作用调控雌蕊器官的发育, 它们都可能是生长素调控的靶基因, HEC和SPT形成异源二聚体, 很可能是生长素调控的靶蛋白, 从而参与生长素调控途径或生长素极性运输[ 9, 12, 22]。ETT/ ARF3在子房中可能通过介导生长素水平抑制SPT/HEC的活性, 控制子房大小[ 9, 29, 30, 31]。SPT在发育过程中的表达比HEC更广泛, 且包含了两者的表达区域[ 9], SPT和HEC调控某些特定的发育过程, SPT还可以与其他bHLH蛋白调控某些发育过程。SPT直接或间接调节生长素运输, SPT功能及器官特定功能的起源的确切机制需要进一步研究, 而目前对HEC家族的报道较少, 对其在生物体内的功能研究还要进一步深化。本研究克隆了甘蓝 HEC1基因, 并初步验证了HEC1与SPT的互作, SPT与HEC家族其他成员HEC2、HEC3的在甘蓝中的相互作用, 及其对甘蓝发育调控的功能验证仍需试验研究。
克隆得到甘蓝 SPT和 HEC1基因完整开放阅读框, 两蛋白均属于bHLH蛋白家族。 SPT和 HEC1基因均在雌蕊中表达, 调控雌蕊发育过程; SPT和HEC1蛋白能够相互作用, 可能形成异源二聚体共同调控雌蕊发育。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|