细胞自噬是一种保守的真核生物细胞内物质分解和循环利用机制, 在植物生长、发育和逆境响应等过程中均扮演了重要角色。自噬相关蛋白ATG10是参与自噬小体形成的关键因子之一。利用同源克隆方法, 从经白粉病菌诱导48 h的小麦材料92R137/扬麦1587中克隆了
Autophagy, a conserved eukaryotic cellular process functioning in material decomposition and nutrient recycling, is deeply involved in plant growth, development, and response to stress. ATG10 is one of the key factors required in autophagosome formation. In this study, we identified three members (
泛素-蛋白酶体途径和细胞自噬(autophagy)途径是真核细胞中2种主要的蛋白质降解机制。前者选择性地快速降解泛素标记的短寿命蛋白; 后者通常非特异性地降解长寿命的蛋白质、蛋白质聚集物乃至细胞器, 负责饥饿状态下的细胞内物质分解和循环利用。细胞自噬主要有巨自噬、微自噬和分子伴侣介导自噬3种形式。在巨自噬过程中, 批量细胞质成分或细胞器被包裹进入双层膜结构的自噬小体(autophagosome), 随着自噬小体外膜与液泡膜(动物细胞为溶酶体)的融合, 内膜及包裹的物质(自噬小泡, autophagic body)进入液泡腔被分解; 微自噬是细胞质物质直接被液泡膜吞陷从而降解的过程; 分子伴侣介导的细胞自噬只存在于哺乳动物细胞中, 其对降解底物有一定的选择性, 识别过程也需要分子伴侣Hsc70的协助[ 1, 2, 3]。在3种自噬形式中, 巨自噬(下文称细胞自噬)是细胞内最普遍的一种自噬形式。对自噬过程分子机制的了解最初来对自酵母突变体的研究[ 4, 5]。目前, 从酵母中已经鉴定了32个重要自噬相关基因(autophagy-related gene, ATG)[ 1, 2]。这些 ATG基因的编码产物参与了自噬信号的感知、前自噬小体膜的起始和延伸、自噬小体的成熟以及与液泡的融合等过程[ 6]。模式生物基因组序列的比较分析发现, 高等植物和动物中广泛存在酵母 ATG的同源基因[ 1, 2]。近年来, 高等生物自噬机制的深入研究证明了细胞自噬过程在真核生物中的保守性[ 7]。
目前, 细胞自噬分子机制尚未完全解开, 其中2个类泛素连接系统较为清楚[ 8]。ATG8和ATG12是连接系统中的2个标签蛋白。ATG8前体的C端经具有半胱氨酸蛋白酶活性的ATG4酶切后暴露出保守的甘氨酸残基; ATG12翻译完成后即为具有C末端保守甘氨酸残基的成熟形式。连接过程的第一步是ATG8和ATG12的末端甘氨酸连接于具有类泛素活化酶(E1)活性的ATG7半胱氨酸上(硫酯键), 此过程依赖ATP提供能量。然后ATG8和ATG12分别被转移到具有类泛素接合酶(E2)活性的ATG3或ATG10上。最后ATG8与脂类物质磷脂酰乙醇胺(PE)相连形成ATG8-PE; ATG12则与ATG5连接。ATG12-ATG5连接物进一步与ATG16相互作用, 并经ATG16寡聚化形成包含4个ATG12-ATG5·ATG16的复合物[ 9]。此复合物可能作为类泛素连接酶(E3)指导ATG8-PE连接物形成的最后一步反应[ 10, 11]。
ATG10指导ATG12-ATG5连结物形成的最后一步反应, 因此是自噬过程的关键因子之一。到目前为止, 植物上有关 ATG10基因的鉴定及其在自噬过程中的功能研究主要集中在模式物种拟南芥[ 12, 13, 14]和水稻上[ 15]。拟南芥 atg10突变体不能正常形成ATG12-ATG5连接物[ 12], 拟南芥和水稻上的 ATG10突变均严重影响自噬小体的积累[ 12, 15], 表明ATG10在植物细胞自噬中的关键作用及在真核生物中的功能保守性。与其他重要 ATG基因突变体类似, 拟南芥和水稻的 atg10突变体表现出典型的自噬缺陷表型, 如发育迟缓、结实量下降、加速衰老和对N源/C源缺乏、高盐和氧化胁迫等逆境环境的敏感性增强[ 12, 13, 14, 15]。细胞自噬在植物先天性免疫反应中也扮演了重要角色[ 16, 17]。就 ATG10基因而言, 该基因参与的自噬过程正调控拟南芥对腐生真菌 Alternaria brassicicola的抗性[ 13, 14], 相反负调控对半活体寄生细菌病原 Pseudomonas syringae[ 14]和活体寄生白粉病真菌病原 Golovinomyces cichoracearum的抗性[ 18]。细胞自噬调控植物免疫反应的过程还与病原侵染诱导的细胞死亡及激素信号途径密切相关[ 2]。
细胞自噬参与了植物多种生理和逆境响应过程, 与农作物重要农艺性状密切相关, 因此急需在重要农作物上开展细胞自噬分子机制及生理功能研究。本研究鉴定了3个小麦 ATG10基因, 分析了其编码蛋白的结构域、与其他物种蛋白序列的进化关系, 以及基因序列特征, 并初步证实了所克隆的 TaATG10基因表达特性和功能, 为探索小麦ATG10及其参与的自噬过程与小麦响应白粉菌侵染的免疫反应之间的关系奠定基础。
携带广谱抗白粉病基因 Pm21的小麦材料92R137/扬麦1587用于 ATG10基因的克隆。92R137/扬麦1587及其感白粉病近等基因系扬麦158、携带小种专一性抗白粉病基因 Pm3f的小麦材料Mich. Amber/Chancellor8及其感白粉病近等基因系Chancellor用于小麦 ATG10基因的表达分析。将小麦种子播于含有混合黑土、蛭石和珍珠岩的盆钵中, 置光照培养箱中生长。生长条件为22℃(白天)/18℃(黑夜)和16 h光照/8 h黑暗。
北方地区流行的白粉菌E09菌株保存繁殖于感病材料苏麦3号上。2个抗病小麦材料对E09菌株表现免疫; 扬麦158和Chancellor对该菌株表现感病。
以拟南芥和水稻的ATG10蛋白质序列作为输入序列, 使用tBLASTN搜索GenBank的dbEST数据库获得编码ATG10的小麦EST。使用Vector NTI Advance 11.5对获得的EST进行拼接。如有必要, 以拼接所得contig作为输入序列通过BLASTN查找两端新的EST进行电子延伸, 以获得覆盖全长ORF的contig。根据contig序列设计引物对TaATG10a-F (5°-CAGCATCTCCGTTTCCAAAT-3°) / TaATG10a-R (5°-CCCATTTCACTCACCCAAAT-3°)和TaATG 10b-F (5°-GGATACTTGACTGCCTCGTTGGT-3°) / TaATG10b- R (5°-AAGCAAAATAAGAGGTGGACACT-3°)用于小麦 ATG10基因全长ORF的RT-PCR扩增。
当92R137/扬麦1587长至二叶期时, 采用人工抖落法高密度接种白粉菌分生孢子作为胁迫处理诱导自噬相关基因的表达。接种白粉菌48 h后取叶片用于RNA提取和基因克隆。使用TRIzol法提取小麦叶片的总RNA。使用Quantscript RT试剂盒(天根)并参照手册合成cDNA的第1链。以cDNA第1链作为模板, 使用高保真的pfu DNA聚合酶扩增小麦 ATG10基因, 扩增程序为94℃预变性4 min; 94℃变性30 s, 55℃退火30s, 72℃延伸90 s, 循环34次; 72℃延伸10 min。将扩增片段3°端加A后克隆到载体pGEM-T Easy (Promega)上。重组克隆送北京六合华大基因公司测序。克隆到的小麦 ATG10基因序列提交到GenBank。
使用SMART (http://smart.embl-heidelberg.de/)预测蛋白质保守的结构域。使用ClustalX 2.1进行cDNA和蛋白质序列的多序列比对。使用Neighbor- joining法在MEGA 4.0中构建进化树, 并对进化树进行重复抽样1000次的bootstrap检验。以克隆到的小麦 ATG10基因cDNA序列作为输入序列, 在小麦基因组草图contig数据库(cerealsdb,http://www.cerealsdb.uk.net)中进行BLAST比对查询和拼接, 获得 ATG10基因的基因组序列。通过比对cDNA和基因组序列(Splign, NCBI)获得基因组序列的外显子-内含子组织结构(基因模型)信息。
提取小麦全套缺体-四体材料DNA作为模板, 设计基因特异性引物分别扩增 TaATG10a、 TaA TG1010b和 TaATG1010c基因。扩增 TaATG10a基因的引物对为10aF (5°-GAGCATGATACCTTGG TTCAGAGC-3°) / 10aR (5°-AACAACTGAAGTGAG TGAGGAGGAA-3°), 扩增 TaATG10b基因的引物对为10bF (5°-GATACCTCGGTTCAGAGCTCTAG GG-3°) / 10bR (5°-CCCACCAGCCTGAAGACCTTG AA-3°), 扩增 TaATG10c基因的引物对为10cF (5°-GATTCTTGCCCGCCTTGTTG-3°) / 10cR (5°-CA TCATCAGGGACAGGGTCG-3°)。扩增产物经8%的PAGE和银染, 根据扩增片段有无鉴定基因的染色体定位。
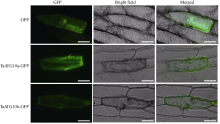
设计5°端添加了 KpnI位点的上游引物和添加了 BamH I位点的下游引物GFP10aF (5°-GGGGTACCAT GGGGGGCTCCTCCGTG-3°) / GFP10aR (5°-CGGGATCC TGAACTGCAATAAAGCTT-3°)和GFP10bF (5°-GGGG TACCATGGGGAGCTCCTCCGCG-3°) / GFP10bR (5°-CG GGATCCTGAACTGCAATAAAGCTT-3°), 使用pfu DNA聚合酶分别扩增获得 TaATG10a和 Ta ATG10b基因全长ORF的 Kpn I- BamH I片段。将扩增片段酶切后连接到表达载体pHBT-sGFP-NOS的 GFP基因上游。该载体上, TaATG10- GFP融合基因由串联的35S启动子和玉米 C4ppdkZm1基因启动子驱动。参考Scott 等[ 19]的方法, 使用基因枪将构建载体质粒导入洋葱表皮细胞。转化后24 h, 使用荧光显微镜(DM5000B, Leica)观察GFP荧光。
设计合成两端添加 NotI识别位点的PCR引物对10aNOTI-F (5°-ATAAGAATGCGGCCGCATGGG GGGCTCCTCCGTGTG-3°) / 10aNOTI-R (5°-ATAAG AATGCGGCCGCCTATGAACTGCAATAAAGC-3°)和10bNO TI-F (5°-ATAAGAATGCGGC CGCATGGG GAGCTCCTCCGCGTG) / 10bNOTI-R (5°-ATAAGA ATGCGGCCGCCTATGAACTGCAATAAAGCT-3°), 使用pfu DNA聚合酶从T载体上分别扩增2个已克隆的小麦 ATG10基因的全长ORF。扩增片段经 NotI酶切后插入酵母表达载体pFL61上的PGK启动子下游 NotI位点处。通过测序鉴定目标基因的正确插入方向(起始密码子紧邻启动子)。野生型酵母菌株BY4741和突变体菌株ATG10Δ (BY4741, atg10Δ:: kanMX, MATa; his3Δ1; leu2Δ0; met15Δ0; ura3Δ0) 购于Open Biosystems (Thermo Scientific)。用醋酸锂法[ 20]将重组表达载体转化到酵母ATG10Δ菌株中。利用SC-Ura固体培养基筛选转化成功的阳性细胞。
酵母功能互补实验参照Fujiki等[ 21]描述的方法, 挑取SC-Ura固体培养基上生长的酵母单菌落接种到SC液体培养基中, 于30℃下过夜振荡培养; 离心收集对数生长期(OD600为1.0左右)的酵母细胞, 用生理盐水洗涤2次; 加入含有终浓度1 mmol L-1 PMSF的YNB培养基(只含有0.67%酵母氮源, 无氨基酸、硫酸铵和葡萄糖)后继续振荡培养5 h。在微分干涉显微镜(DM5000B, Leica)下观察酵母细胞液泡内自噬小泡的积累。
小麦二叶期, 采用人工抖落法高密度接种新鲜白粉菌孢子, 或喷施4种外源激素进行诱导处理。激素浓度为水杨酸 (SA) 2 mmol L-1、茉莉酸甲酯(Me-JA) 1 mmol L-1、乙烯利(有效成分为乙烯) 200 μmol L-1和脱落酸(ABA) 100 μmol L-1, 喷施前均加入0.05% Tween-20, 以喷施0.05% Tween-20做对照。分别于白粉菌接种后0、6、10、16、24、36 h或激素处理后0、3、6、12、24 h取叶片提取RNA, 反转录合成cDNA。
根据 TaATG10序列设计特异引物, 其中引物对q10a-F (5°-AGAGGGGTTCGTAGCTCTTG-3°) / q10a-R (5°-TCTGCACCATCATCAGGGAC-3°)用于扩增 TaATG10a片段(96 bp), 引物对q10b-F (5°-CCAAG TGGAGGGGGATTGAT-3°) / q10b-R (5°-TCCTTCG AGGGCTACAAACC-3°)用于扩增 TaATG10b片段(107 bp), 引物对q10-F (5°-CCAAGTGGAGGGGGATT GAT-3°) / q10-R (5°-TCCTTCGAGGGCTACAAACC-3°)同时扩增 TaATG10a和 TaATG10b的保守片段 (172 bp)。采用SYBR green法和RealMaster Mix试剂盒(天根)在IQ5 (Biorad)上进行定量PCR扩增、信号检测和溶解曲线分析。每个样品设3次重复。以小麦 Tubulin (U76558)为内参基因, 其扩增引物序列为Tubulin F: 5°-GTGGAACTGGCTCTGGC-3°; Tubulin R: 5°-CGCTCAATGTCAAGGGA-3°, 预期扩增片段为234 bp。采用2-ΔΔCt法[ 22]计算相对表达量。
构建酵母表达载体时, 将扩增得到的 TaATG10b基因的 Not I- Not I片段克隆到原核表达载体pET30a的 Not I位点处, 测序鉴定正确插入方向(起始密码子紧邻T7启动子)的重组表达载体pET-ATG10b。采用热激法将表达载体导入大肠杆菌BL21 (DE3)。经1 mmol L-1 IPTG诱导表达后, 使用Ni-Agarose His标签蛋白纯化试剂盒(康为世纪, 北京)在非变性条件下纯化获得His(6)-TaATG10b重组蛋白。
利用拟南芥和水稻ATG10的同源序列设计引物, 从小麦中克隆了3个 ATG10基因( TaATG10a、 TaATG10b和 TaATG10c), 其中 TaATG10a (GenBank登录号为KF294817)和 TaATG10b(GenBank登录号为KF294818)为从白粉菌侵染诱导的抗病小麦材料92R137/扬麦1587 cDNA中经RT-PCR扩增得到的cDNA克隆, TaATG10c由EST拼接而来。 TaATG10a的ORF全长648 bp, 编码215个氨基酸; TaATG10b和 TaATG10c的ORF全长均为651 bp, 编码216个氨基酸。
利用中国春缺体-四体材料, 经特异引物PCR扩增进行 TaATG10染色体定位, 结果3个 ATG10基因均被定位于第2部分同源群染色体上。其中 TaATG10a被定位于2A染色体上; TaATG10b被定位于2D染色体上, TaATG10c被定位于2B染色体上(图1)。通过与中国春草图序列[ 23]、A组染色体祖先物种 Triticum uratu和D组染色体祖先物种 Aegilops tauschii基因组序列[ 24, 25]进行BLAST比对, 发现位于2D染色体上的一个 TaATG10同源位点的scaffold1072序列( Ae. tauschii基因组序列)与 TaATG10a和 TaATG10b在匹配区段内的相似性分别为77%和80%。
TaATG10a和TaATG10c缺失了TaATG10b第82位的Asp; 而TaATG10a和TaATG10b也缺失了TaATG10c第34位的Asp (图2-A)。3个基因核酸序列和氨基酸序列的相似性分别为94.3%~95.8%和94.0%~95.0%。3个小麦ATG10都含有1个保守的Autophagy_act_C结构域(autophagocytosis associated protein, active-site domain, Pfam: PF03987), 其位置是TaATG10a的102~170残基, TaATG10b和TaATG10c的103~171残基(图2-A)。在ATG12-ATG5连接物的形成步骤中, 经ATG7活化后的ATG12通过硫酯键连接到ATG10上, 该硫酯键是在ATG12的末端甘氨酸与ATG10的一个保守的半胱氨酸之间形成[ 2, 8]。3个小麦ATG10都含有ATG12结合位点的保守半胱氨酸残基, 分别是TaATG10a的Cys169及TaATG10b和TaATG10c的Cys170 (图2-A)。这个半胱氨酸在所有的真核生物ATG10中都非常保守[ 26]。
3个TaATG10与其他植物ATG10的相似性分别为60% (拟南芥)、73%~75% (玉米)和76%~78% (水稻)。小麦ATG10与酵母和小鼠的ATG10相似性分别只有30%~31%和40%~41%。双子叶植物和单子叶植物的ATG10位于2个进化支上; 部分植物具有2个或多个ATG10拷贝, 在进化树上种内ATG10聚类在距离最近的末端分支上(图2-B)。推测ATG10基因的扩增事件可能发生在各物种形成之后。
RT-PCR分析结果显示, 除编码正常功能蛋白的mRNA外, TaATG10a和 TaATG10b还可转录形成中间连续缺失53 bp的短mRNA, 且该短mRNA分子与正常的长mRNA分子序列仅相差上述53 bp, 表明它们可能是同一基因不同剪接模型(splice variant, SV)的产物。将cDNA序列与基因组序列比较, 建立了 TaATG10a和 TaATG10b基因的外显子-内含子结构模型(图3)。 TaATG10a和 TaATG10b具有相似的6外显子-5内含子结构。SV1剪接方式产生编码正常功能蛋白的mRNA。在SV2剪接方式中, 内含子3扩展到外显子4的前53 bp。SV2剪接方式产生的mRNA编码由于翻译提前终止导致的C端截短的TaATG10 isoform, 且C端缺失的部分包括了重要的ATG12结合位点半胱氨酸(图3)。
TaATG10a-GFP和TaATG10b-GFP的荧光信号在洋葱表皮细胞中均弥散分布于整个细胞质, 与对照GFP差异不大(图4)。
为了验证小麦 ATG10在物种间功能上的保守性, 构建了小麦 TaATG10a和 TaATG10b的酵母表达载体(pFL-TaATG10a和pFL-TaATG10b)并导入到相应基因突变的酵母(ATG10Δ)细胞中。在营养缺陷和蛋白酶抑制剂PMSF处理条件下, 自噬小泡在野生型酵母BY4741的液泡中大量积累, 而在ATG10Δ突变型的酵母液泡中很少观察到。表达 TaATG10a或 TaATG10b的ATG10Δ酵母部分恢复了自噬功能, 液泡中的自噬小泡数量显著增加(图5)。这一结果说明本研究克隆的2个 TaATG10基因是酵母 ATG10的功能性同源基因。
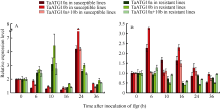
2.6.1 白粉菌诱导表达 在 Pm21 (广谱抗性)近等基因系中, TaATG10a和 TaATG10b都表现白粉菌诱导的上调表达, 但抗、感反应的表达模式不同。抗病反应中2个基因在接种白粉菌后0~10 h和16~ 24 h呈2次显著诱导表达, 而感病反应中2个基因只在接种后16~24 h有诱导表达特征; 接种后0~16 h, 2个基因在感病反应中呈现显著的表达抑制, 而在抗病反应中呈相反趋势(图6-A)。
在 Pm3f(小种专化抗性)近等基因系中, TaATG10a和 TaATG10b的表达特征与在 Pm21近等基因系中有明显差别。接种6 h后, 2个基因在抗病系中的表达均受抑制, 而在感病系(Chancellor)中却表现2次诱导上调表达(接种后0~6 h和10~16 h); 同时检测2个基因表达水平( TaATG 10a+ TaATG10b)也获得类似结果(图6-B)。
白粉菌的诱导表达现象说明ATG10蛋白及其参与的自噬过程与小麦抗白粉病反应密切相关。但是对 ATG10基因表达的调节在抗、感反应之间, 在不同类型的抗病反应和不同遗传背景的感病反应之间均存在差异。
2.6.2 外源激素诱导表达 利用 Pm21近等基因系分析 TaATG10a、 TaATG10b响应外源激素诱导的相对表达量, 发现不同激素处理后抗感材料呈现不同的表达模式(图7)。外源乙烯处理后, 抗、感材料中2个基因首先表现短时间(处理后0~3 h)受抑制, 而后在感病材料上呈上调表达, 至12 h达到峰值, 而在抗病材料则呈持续下调表达。SA处理后, 2个基因的 表达模式与乙烯处理类似, 在感病材料上表现激活作用, 而在抗病材料中表现抑制作用。Me-JA处理后, 抗、感材料中2个基因均为下调表达, 但在抗病材料中下调时间更早、持续时间更长, 说明Me-JA对 TaATG10a和 TaATG10b的表达抑制作用在抗病系中更突出。外源ABA处理后, 在感病材料中2个基因的表达受抑制, 而在抗病材料上首先表现为被抑制(接种后0~6 h), 此后明显变为被激活。同时检测2个基因表达水平, 也获得了类似的结果。
利用构建的 TaATG10b原核表达载体, 将该基因导入大肠杆菌, 经IPTG诱导表达和Ni柱亲和层析过程获得了纯化蛋白(图8)。该蛋白的分子量为24.26 kD, 再加上克隆到载体上后引入的N端标签分子量6.8 kD, 结果与理论值(~31 kD)相符, 表明本试验获得了纯度较高的原核表达产物, 可以满足抗体制备要求。
细胞自噬在植物生长、发育、衰老和逆境胁迫响应等过程中均扮演了重要角色。ATG10作为参与自噬小体形成的核心因子之一, 指导ATG12-ATG5连接物形成的最后一步反应[ 6, 8]。已在拟南芥[ 12]和水稻[ 15]中分别鉴定了1个和2个 ATG10基因。突变体分析表明, 植物ATG10与酵母ATG10同样都在自噬小体形成过程中不可或缺[ 12, 15]。本研究在小麦上鉴定了3个 ATG10基因, 三者序列高度相似, 在进化树上被聚类在相邻的末端分支上。染色体定位结果也表明3个 Ta ATG10均定位于小麦第2部分同源群染色体2A ( TaATG10a)、2B ( TaATG10c)和2D ( TaATG10b)上。3个小麦 ATG10基因的表达产物都含有保守的Autophagy_act_C结构域和ATG12结合位点半胱氨酸残基。亚细胞定位显示 TaATG10a和 TaATG10b的编码蛋白定位于细胞质, 这与已报道的酵母ATG10和水稻ATG10b的细胞质定位结果[ 12, 15]一致。拟南芥的 ATG4[ 27]、 ATG6[ 21]和 ATG8[ 28]和烟草的 ATG6[ 29]能够互补酵母相应基因突变株的自噬功能。本研究发现小麦 TaATG10a和 TaATG10b也能够互补酵母 ATG10基因突变株的自噬功能, 进一步说明这2个基因是酵母 A TG10的功能性同源基因。 TaATG10a和 TaATG10b具有类似的2种可变剪接模式, SV1剪接模型产生编码正常功能蛋白的mRNA, SV2剪接模型产生的mRNA编码C端截短的可能无功能的isoform。2种可变剪接方式的存在可能是小麦 ATG10基因表达调控的一种方式。
动物细胞自噬与免疫过程密切相关, 这种细胞自噬参与的清除入侵细病原菌、寄生虫和病毒的过程被称为Xenophagy[ 30]。病原侵染也能够诱导植物 ATG10基因及其他 ATG基因的上调表达, 进而激活细胞自噬活性。植物细胞自噬与先天性免疫的关系已经在多种拟南芥-病原系统中得到证实, 并成为近年来植物细胞自噬功能的研究热点[ 2, 16, 17]。如拟南芥 atg10突变体对腐生真菌 A. brassicicola的感病性增强[ 13], 但对半活体寄生细菌病原 P. syringae和活体寄生白粉病真菌病原 G. cichoracearum的抗性提高[ 14, 18]。为了揭示 ATG10基因与小麦响应白粉菌侵染的关系, 本研究系统分析了2个抗病反应和2个感病反应在白粉菌侵染早期对小麦 ATG10基因表达的调控情况。在接种白粉菌后36 h内, TaATG10a和 TaATG10b在 Pm21介导的抗病反应中分别在0~10 h和16~24 h呈现2次上调表达, 这与感病近等基因系扬麦158上的先抑制后诱导表达模式明显不同。接种后0~16 h是小麦表皮细胞通过接触而识别入侵白粉菌, 并诱导一系列抗病反应抵抗白粉菌入侵的关键时期。这一时期 TaATG10基因在抗、感2种反应中呈现迥异的表达模式, 说明在接种白粉菌后发生较早的一次 ATG10基因激活对 Pm21介导的抗病反应至关重要。而较晚(接种后16~24 h)出现一次的诱导表达, 2个 TaATG10基因在感病反应(扬麦158和Chancellor)中的诱导表达程度明显高于抗病反应中, 其原因可能是接种16 h后感病反应中有更多的白粉菌孢子成功侵入小麦表皮细胞, 随后进入吸器发育和建立寄生关系阶段, 因而这一时期激活的防卫反应以及相关的自噬过程在感病反应中表现更为明显。
出乎意料的是, Pm3f介导的小种专一性抗病反应并没有诱导2个 TaATG10基因的表达, 相反抑制了基因表达。其原因可能包括以下几个方面: (1)不同 ATG10家族成员功能有所不同, TaATG10c或其他可能存在而没有得到鉴定的小麦 ATG10参与了小麦对白粉菌侵染的响应。(2)在某些抗病反应类型或某些植物-病原菌系统中, ATG10的表达程度与自噬活性并不一致。Shin等[ 15]发现, 尽管甲基紫精(methyl viologen, MV)处理能够诱导水稻细胞自噬的激活, 但是表达分析却发现MV处理导致 ATG10基因在叶片中的表达量下降。(3)尽管都是参与自噬过程的关键因子, 但 ATG10与其他 ATG基因在植物免疫反应中的作用可能有所不同。Lenz等[ 14]发现, 拟南芥 atg5或 atg10突变体均对腐生真菌 A. brassicicola的侵染诱导呈现坏死斑扩展现象, 但是在 atg5突变体上还同时观察到菌丝增强生长, 而在 atg10突变体上未观察到。(4)不同类型抗病基因介导的抗病反应与细胞自噬的关系有所不同。Hofius等[ 31]发现, 在TIR-NB-LRR类抗病基因( RPS4)介导的拟南芥抗 P. syringae反应中, 过敏性细胞死亡的执行依赖于正常的细胞自噬活性; 而CC-NB-LRR类抗病基因( RPS2)介导的过敏性细胞死亡却不依赖于细胞自噬功能。 Pm21和 Pm3f介导的抗白粉病反应也都具有过敏性细胞死亡的特征[ 32, 33]。 Pm21介导的包括过敏性细胞死亡在内的抗病机制可能是自噬依赖性的, 而 Pm3f介导的抗病反应与细胞自噬活性的关系可能不大。
SA信号通路参与了植物对活体寄生病原的免疫反应; 而JA/乙烯信号通路参与了植物对腐生病原的免疫反应[ 34, 35]。除广泛研究的SA和JA/乙烯信号途径外, ABA也是植物响应病原侵染的重要调控因子[ 36]。大麦[ 37]和拟南芥[ 38]的抗白粉病反应均依赖于ABA信号途径。SA及其类似物能够激活拟南芥细胞自噬[ 39]。细胞自噬调控植物免疫反应及病原侵染诱导的细胞死亡也与激素信号途径密切相关[ 2]。本研究中, 外源乙烯和SA处理能够在感白粉病材料扬麦158上激活 TaATG10基因的表达, 而在抗白粉病近等基因系92R137/扬麦1587上抑制 TaATG10基因的表达; ABA则具有与乙烯/SA相反的作用。因此, 我们推测乙烯和SA信号通路与感白粉病反应中TaATG10参与的自噬活性调控有关, 而ABA信号通路则与抗白粉病反应中TaATG10参与的自噬活性调控有关。这3种植物激素在抗、感材料上对 TaATG10表达的不同调控模式可能与抗、感表型密切相关。Me-JA对抗、感材料的 TaATG10基因具有相似的抑制作用, 表明JA信号通路可能负调控TaATG10参与的细胞自噬活性, 而且与抗、感表型无关。
克隆了3个小麦 ATG10基因, 它们是酵母 ATG10的功能性同源基因。 TaATG10a和 TaATG10b基因的编码蛋白被定位于细胞质中。小麦对白粉菌侵染的免疫反应涉及对 TaATG10及其参与的自噬过程的调控, 调控模式因抗、感反应, 广谱或小种专化抗病类型, 以及小麦遗传背景而异。植物外源激素对 TaATG10表达的调控模式也在抗、感材料中有明显差异, 可能是导致抗、感表型差异的原因之一。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|