发掘新的广谱稻瘟病抗性基因是培育抗性品种及控制病害的有效途径。迄今已有63个抗稻瘟病位点的77个主效基因被分子定位, 并有22个基因被克隆。这些基因分布于除第3染色体外的其他11条水稻染色体上, 并具有成簇分布的特性(http://www. ricedate.cn/gene/, 国家水稻数据中心基因数据库)。其中, 第6染色体短臂近着丝粒的附近分布有 Pi2 、 Pi9 、 Pi22 、 Pi25 、 Pi26 、 Pi40 、 Pi42 、 Pi50、Piz 、 Piz-t 等至少10个抗性基因, 这些基因在抗病基因簇内呈等位或紧密连锁关系, 并有研究结果显示其抗谱存在明显差异[1,2,3,4,5,6,7]。但这种差异大多是在不同遗传背景下获得的初步鉴定结果, 缺乏在同一遗传背景下(如近等基因系水平上)的验证。 Pigm 是从持久抗稻瘟病品种谷梅4号中鉴定的一个新的广谱稻瘟病抗性基因, 定位及等位性测验结果显示其可能与第6染色体的 Pi2 和 Pi9 等位或连锁[8]。 Pi1 是源自利比亚粳型品种“LAC23”的广谱稻瘟病抗性基因, 定位在第11染色体上MGR4766标记1.3 cM处, 现已经被成功克隆[9,10], 并有研究显示其与 Pi2 有良好的互补效应[11,12,13]。本研究构建了4个轮回亲本背景下 Pigm 、 Pi2 的系列近等基因系, 进而比较其抗谱差异, 并分析其与 Pi1 的互作效应, 从而为稻瘟病抗性育种提供参考。
Pi1 和 Pi2 基因的供体亲本为W1, 是以金23B为轮回亲本导入 Pi1 和 Pi2 基因的中间材料[9]。 Pigm 的供体亲本为谷梅4号。受体轮回亲本包括2个光温敏核不育系广占63S、97S, 及2个中籼稻恢复系R084和R609, 均由本项目组保存或培育而成。
结合http://www.gramene.org/网站上分子标记的信息和3个抗性基因的定位或克隆信息, 采用Primer Premier 5.0软件发展分子标记设计引物, 引物由TaKaRa公司负责合成, 用1%~3%的琼脂糖电泳筛选多态性的分子标记。最后针对不同供体, 筛选获得与4个轮回亲本均有良好多态性的标记AP22、ZJ58.7及RM224, 用于后续的标记辅助选择。具体信息列于表1。
| 表1 筛选的分子标记信息 Table 1 Marker information for MAS |
参照卢扬江等[14]的方法提取水稻全基因组DNA。20 μL PCR反应体系, 包括MgCl2 (25 mmol L-1) 2.0 μL, buffer (×10) 2.0 μL, 引物(上下游引物, 3.084 mmol L-1) 1.5 μL, dNTP (10 mmol L-1) 0.4 μL, Taq DNA聚合酶(5 U μL-1) 0.2 μL, 模板DNA 2.0 μL; ddH2O 11.9 μL。PCR条件为94℃预变性5 min; 94℃变性50 s, 55℃复性50 s, 72℃延伸1 min, 36个循环; 72℃充分延伸10 min。将PCR产物上样于含溴化乙锭的3%琼脂糖凝胶, 电泳分离后于BIORAD凝胶成像仪下拍摄并观察读数。供体亲本带型、受体亲本带型和双带分别赋值1、3和2, 缺带赋值0。
结合http://www.gramene.org/网站上公布的水稻SSR分子标记的信息和本实验室开发的标记, 采用目标基因区间以外相对均匀分布的132个分子标记, 针对供、受体双亲进行多态性筛选, 在2个亲本之间具有多态性的标记确定为用于背景回复率检测的中选标记, 要求每条染色体至少获得3个以上的多态性标记且分布相对均匀。参照Hospital等[15]的方法计算株系背景回复率, Gg = ( L + Xg )/2 L , 其中, Gg 为在 g 代的遗传背景回复率; Xg 为在回交 g 代表现为轮回亲本带型的分子标记数量; L 为检测的分子标记总数量。
从广东、江苏、海南、浙江和湖北5省重发病区田间采集自然发生的稻瘟病病穗, 参考周益军等的方法[16]培养病菌, 单孢分离后在PDA培养基上培养5~7 d, 转于产孢培养基上培养5~7 d, 用无菌水洗去培养基表面菌丝后于黑光灯下照射培养72 h (培养温度均为26℃)。筛选获得204个产孢量大的单孢菌株, 洗脱稻瘟菌孢子, 调节浓度至2×105个 mL-1, 作为鉴定所用的接种体。
1.6.1 苗瘟鉴定与评价 将各株系种子浸种催芽后播于塑料秧盘内, 2次重复, 利用上述培养的204个菌株孢子悬浮液, 待秧苗长至三至四叶期时移至玻璃箱内喷雾接种, 于26~28℃下黑暗保湿24 h (相对湿度>95%), 然后将秧盘移至可控温室内, 26~28℃、相对湿度>95%的高湿环境下生长。7~10 d后调查病情, 依据国家农业行业标准(水稻稻瘟病鉴定技术规范)记载病情, 以发病最重的稻株作为该品种的抗性级别, 每个重复中只要有2株以上感病即记为感(S), 低于2株记为抗(R)。抗性频率=(接种后表现抗的菌株数/接种的总菌株数) × 100%; 抗谱重叠度=(具有相同抗性表型的菌株数/接种的总菌株数) × 100%。
1.6.2 穗瘟鉴定与评价 试验于江苏里下河地区农业科学研究所万福基地进行, 5月10日播种各试验材料, 苗床育苗30 d后于6月10日移栽, 单本栽插, 每区5行, 每行12株, 株行距13.3 cm × 25.0 cm, 2次重复, 常规水肥管理。孕穗期选用来自广东、湖北、海南、浙江和江苏的5个代表性的强毒力菌株GD18-3 (B1, 致病率65.6%)、ES9-5-1 (B15, 致病率75.0%)、hn1-1 (C1, 致病率59.4%)、ZJ13-4 (A15, 致病率63.3%)和XH8-4-4 (G1, 致病率37.5%), 扩大培养后等比例混合5个菌株的孢子液。选择每个株系的第2行, 用注射器将接种液注入稻苞内, 每穗注射1 mL, 每重复接种10穗, 并对接种的稻穗作好标记。穗瘟鉴定评价标准参见罗楚平等[17]的方法。
1.6.3 病圃自然诱发鉴定 自然诱发鉴定病圃建于武陵山区湖北省恩施的两河地区, 常年3月至9月份相对湿度超过90%, 非常适宜稻瘟病的发生。3月25日播种试验材料, 5月上旬移栽, 每个株系栽插100穴, 2次重复。齐穗后30 d调查每个株系的穗发病情况, 按照国家稻瘟病测报调查规范(GB/T 15790-2009)划分抗感类型和病级。
对用于田间穗颈瘟人工接种鉴定的试验材料, 同时进行基本农艺性状考察。调查记录各试验小区的播始历期和株高。成熟时, 每重复取中间第3、第4两行各8株共16株, 考察有效穗数、每穗粒数、结实率、千粒重、单株产量等性状。
以广占63S、97S、R084和R609为母本, 与供体亲本W1、谷梅4号分别杂交获得F1, 然后以广占63S、97S、R084和R609分别为轮回亲本连续回交, 从BC1F1世代开始分别利用目标基因 Pi2 、 Pigm 紧密连锁标记AP22、ZJ58.7检测基因型, 选择标记为杂合带型且农艺性状与轮回亲本接近的单株回交, 经过连续4次回交获得BC4F1代后(江苏扬州、海南一年两季加代)自交, 利用单个鉴别菌株对BC4F2群体接种鉴定, 发现AP22、ZJ58.7的选择效率高达93%以上, 与前人研究结果一致[12]。BC4F2分离世代选择标记为纯合抗性基因型且农艺性状优良的单株(图1-A), 针对每个轮回亲本的单个目标基因, 分别获得优良单株10个以上。
将BC4F3世代种植成株系, 进行以下三方面选择: (1)遗传背景回复率, 针对广占63S、97S、R084和R609等4个轮回亲本与供体亲本, 利用132个SSR标记进行多态性分析, 筛选发现W1与4个亲本间的多态性标记个数依次为47、46、49、50, 谷梅4号与4个亲本间的多态性标记个数依次为44、47、52、53, 且均匀分布于水稻12条染色体上(每条染色体上均有3个以上的多态性标记), 利用这些多态性标记对每个株系进行遗传背景回复率检测, 选择背景回复率>95%的株系; (2)目标基因选择的准确性, 为避免分子标记与目标基因之间由于交换重组等导致的假阳性选择, 对每个株系收获的种子, 利用不同地区分离的15个代表性强毒力菌株开展苗瘟接种鉴定, 选择抗性频率较轮回亲本显著提高的株系(图1-B, C, D), 确保目标基因被准确选择; (3)农艺性状, 在群体水平上选择与轮回亲本最为相似的株系。最后, 综合上述三方面选择情况, 针对每个轮回亲本的单个目标基因, 确定一个株系用于后续的抗谱分析。
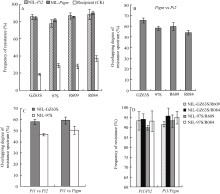
2.2.1 Pigm 与 Pi2 的抗谱差异 不同地区分离的204个稻瘟病菌株的苗期接种结果显示, 携带 Pigm 与 Pi2 基因的近等基因系, 在不同遗传背景的情况下表现基本相似的抗性频率(图2-A), 而与其各自的轮回亲本(对照)相比, 抗性频率显著提高, 均超过70%, 表明 Pigm 与 Pi2 均是抗谱较广的稻瘟病抗性基因。
Pigm 与 Pi2 的抗谱重叠程度, 在不同遗传背景下介于54.4%~65.7%之间(图2-B), 表明两者虽然均有较宽的抗谱, 但抗谱差异较大, 虽然可能为等位或紧密连锁基因, 但在进化上已表现出明显分化。
2.2.2 Pigm 、 Pi2 与 Pi1 的互作效应 有研究表明 Pi2 与另一广谱稻瘟病抗性基因 Pi1 具有良好的互补效应[11,12,13]。对广占63S、97S与W1杂交的后代, 针对 Pi1 基因, 通过上述同样流程, 构建广占63S、97S为轮回亲本的携带 Pi1 的近等基因系, 携带目标基因株系的抗性频率分别为62.79%和60.26%, 表现出相对较宽的抗谱。对 Pigm 、 Pi2 分别与 Pi1 的抗谱比较显示, 广占63S背景下, Pigm 和 Pi1 的抗谱重叠度是59.49%, Pi2 和 Pi1 是58.23%; 97S背景下, Pigm 和 Pi1 的抗谱重叠度是50.63%, Pi2 和 Pi1 是46.84% (图2-C)。表明 Pigm 与 Pi2 相似, 均与 Pi1 基因之间具有良好的互补性。
利用携带 Pi1 的广占63S、97S的近等基因系作母本, 携带 Pigm 、 Pi2 的R084、R609近等基因系作父本, 配制杂交组合, 同时用相应原轮回亲本配制杂交组合作对照, 研究 Pigm 、 Pi2 分别与 Pi1 的聚合效应。苗瘟人工接种结果显示, 与 Pi2 相似, Pigm 与 Pi1 有良好的聚合效应, 聚合后其抗性频率在不同遗传背景下均达到90%以上(图2-D)。
2.2.3 目标基因的穗瘟抗性及病圃自然诱发鉴定
由于穗瘟对水稻的产量影响更为重要, 而关于苗瘟与穗瘟抗性是否相关, 针对不同基因以及不同的研究材料, 一直有不同的研究结论[18,19,20]。为了解 Pigm 基因的穗瘟抗性效果, 选择不同生态区分离的代表性强毒力菌株, 对不同近等基因系穗瘟人工接种鉴定表明, Pigm 与 Pi2 对穗瘟均有良好的抗性效果, 不同遗传背景下, 均表现中抗(MR)或中感(MS)表型; 而与 Pi1 分别聚合后, 则表现抗(R)或高抗(HR)表型, 而原轮回亲本(组合)均表现高感(HS)表型, 与苗瘟抗性表现明显相关性(表2和图3)。
此外, 为了解上述材料在自然种植、病原菌强胁迫条件下的发病情况, 将其种植于武陵山区湖北恩施两河地区的病圃。该区域雨量丰沛、光照少、田间湿度大, 是我国稻瘟病重发病区, 且国家长江中下游水稻区试稻瘟病病圃鉴定也是设于该地。自然诱发鉴定结果显示(表2), 与穗瘟人工鉴定结果基本一致, 携带 Pigm 、 Pi2 的近等基因系苗瘟和穗瘟表现MR或MS表型, 与 Pi1 分别聚合后, 表现R或HR抗性表型。表明 Pigm 在全生育期均能稳定表达抗性, 具有重要育种价值。
| 表2 不同近等基因系穗瘟人工接种及病圃自然诱发鉴定情况 Table 2 Results of artificial inoculation on heading stage and natural induction in disease nursery for NILs |
对携带 Pigm 、 Pi2 近等基因系农艺性状的考察结果显示(表3), 经过分离世代农艺性状及背景检测的选择, 与4个轮回亲本相比, 各近等基因系基本农艺性状与之相似, 只有少数株系在个别性状上与对照存在差异, 但产量构成性状尤其是单株产量方面没有明显差异, 表明 Pi2 和 Pigm 位点附近基本不存在与产量性状相关的累赘连锁, 通过常规筛选结合分子标记辅助选择可以达到选育广谱抗瘟基因的优良品种的目标。
植物中的抗性基因往往具有成簇分布于特定的染色体区域、共同组成紧密连锁的复合抗病基因座的特性[21,22,23]。水稻中已定位的77个稻瘟病抗性基因, 超过半数以基因簇形式存在, 位于第6染色体短臂的 Pi2 、 Pi9 、 Piz 、 Piz-t 等构成一个复合抗性基因座, 不同种质间在该位点包含有数目不等的NBS-LRR类抗病基因。种质间单元型分析表明, 直系同源基因之间在序列和大小上具有极高的相似性, 而旁系同源基因的序列歧化显著。已克隆的 Pi2 、 Piz-t、Pi9 位点均包含有9个NBS-LRR类抗病基因簇, 但在分子水平上, Pi2 与 Piz-t 为直系同源基因, 8个氨基酸的差异造成了其抗性专化性的差异, 它们是真正的等位基因, 而 Pi9 是 Pi2 、 Piz-t 的旁系同源基因, 是其紧密连锁基因[24,25]。 Pigm 是谷梅4号中新鉴定的稻瘟病抗性基因, 初步的作图分析表明其可能与 Pi2 、 Pi9 等位或连锁[8]。本文构建了广占63S、97S、R609和R084四个遗传背景下 Pigm 、 Pi2 两个基因的系列近等基因系, 苗期接种鉴定结果显示 Pigm 与 Pi2 对不同生态区分离的204个菌株均具有较高的抗性频率(>70%), 而两者抗谱重叠仅为54.4%~65.7%, 且穗瘟人工接种和重发病区病圃的自然诱发鉴定结果与苗期接种趋势基本一致, 表明 Pigm 是一个与 Pi2 抗谱差异明显的、等位或紧密连锁的广谱抗性基因, 对稻瘟病抗性育种具有重要应用价值。
| 表3 近等基因系的基本农艺性状 Table 3 Basic agronomic traits of NILs carrying target genes |
聚合抗性基因是获得广谱抗性的重要途径, 但随着聚合基因数目的增加, 不良性状的连锁累赘也可能增加。杨健源等[26]提出选择目标基因时, 用少数的抗性基因获得广谱抗性是抗稻瘟病育种中必须考虑的问题。已有部分研究表明聚合 Pi1 、 Pi2 基因对我国南方稻区稻瘟病抗性有良好效果[11,12,13], 本文利用携有 Pi1 的不育系, 与携有 Pigm、Pi2 的恢复系配组, 研究 Pi1 与 Pigm 的聚合效应, 发现聚合有 Pi1 / Pigm 和 Pi1 / Pi2 的杂交稻, 其抗性频率均超过90%, 表明利用 Pigm 、 Pi2 与 Pi1 等少数广谱稻瘟病抗性基因进行聚合, 可达到有效改良抗性的目的。
本文针对 Pigm 、 Pi2 构建的近等基因系, 在每一个回交分离世代都选择与轮回亲本最相似的个体进行回交, 最后获得的4个遗传背景下的系列近等基因系, 其产量等基本农艺性状与轮回亲本绝大多数无显著差异, 表明回交过程中表型选择的有效性, 同时也表明 Pigm 、 Pi2 基因位点附近存在较少的与产量性状相关累赘连锁, 较易实现丰产基础上的抗性改良。但需要提及的是, 谷梅4号中 Pigm 附近存在一个与其连锁的迟抽穗期基因, 在自然长日照条件下(如江苏扬州)会显著延迟抽穗; 在自然短日条件下(如海南)表现明显的感光特性而提早抽穗。迟抽穗期基因与 Pigm 的重组率约3%。本文获得系列近等基因系, 均是通过第一个分离回交世代大群体选择、打破这种连锁后而成功构建的, 因而表现出与轮回亲本生育期的基本一致性。水稻第6染色体短臂上分布有 Hd1 等生育期基因, 且拥有不同效应的等位基因型[27]。谷梅4号中与 Pigm 连锁的迟抽穗期基因, 是否是 Hd1 位点的强效应等位基因, 亦或是其他新的生育期基因, 有待后续研究进一步验证。
Pigm 是与 Pi2 抗谱有显著差异的广谱稻瘟病抗性基因, 并与 Pi1 有良好的聚合效应, 对我国水稻稻瘟病抗性改良具有重要应用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|