以拟南芥AVP1为诱饵, 采用膜蛋白酵母双杂交系统筛选拟南芥cDNA文库, 获得一个与AVP1互作的小GTP结合蛋白AtRAB。酵母互作试验表明, AVP1和AtRAB存在互作; 双分子荧光互补实验(BiFC)证明, AVP1和AtRAB能在质膜和细胞核上发生相互作用。野生型拟南芥(WT)、
H+-pyrophosphatase (H+-PPase) is an important proton transporter in plants. It cooperates with H+-ATPase and transport protons in vacuole or extracellular area to maintain a constant H+ gradient, which enables the transport of ions and other components (e.g. amino acids, carbohydrates). In the current research, AVP1 was applied to membrane proteins-based yeast two-hybrid system, and a small GTP-binding protein AtRAB was identified by screening the
氢离子焦磷酸化酶(H+-pyrophosphatase, H+- PPase)是一类不同于H+-ATPase的质子泵[ 1], 也是一种以焦磷酸(pyrophosphate, PPi)为底物的水解酶。焦磷酸化酶 (PPase)一般可以分为可溶性和不溶性两类, 前者主要存在于细胞质及胞液中, 后者主要结合在膜上(H+-PPase), 能够将焦磷酸(PPi)水解为2个Pi并生成能量。H+-PPase存在于植物、少数藻类及光合细菌[ 2]的液泡膜或细胞膜上[ 3, 4, 5, 6, 7], 能够与H+跨膜运输相耦联, 和H+-ATPase协同将胞质中的H+泵入液泡中[ 8], 使液泡和细胞质之间维持一定的H+梯度, 为离子和其他溶质(氨基酸、糖类等)的次级转运提供动力[ 9, 10]。有研究表明, 过表达H+-PPase基因能够提高拟南芥的耐盐性和抗旱性[ 11, 12, 13], 同时可以提高番茄、棉花、苹果等作物耐盐性及抗旱性[ 14, 15, 16, 17, 18]。 H+-PPase基因还能够提高水稻的抗寒性[ 19], 对黄瓜、烟草、小麦的重金属胁迫(如镉和铜)抗性也有重要作用[ 20, 21, 22]。另外, Li等[ 23]还发现 H+-PPase基因参与控制生长素的运输, 影响生长素相关的各种发育过程。 H+-PPase基因还参与苹果酸、可溶性糖的积累[ 24], 养分的有效存储需要有活性的H+-Ppase[ 25]。通过过表达 H+-PPase能够增强单子叶植物和双子叶植物对磷元素的吸收[ 26]。以上报道证明 H+-PPase基因广泛参与植物生长发育、抗逆反应、营养物质吸收、重金属耐性等各方面的过程。在作物抗逆、营养高效利用等遗传改良方面具有重要的应用价值。然而, 目前关于 H+-PPase基因的研究大都集中在基因功能以及生理机制研究方面, 调控机制鲜见报道。因此, 筛选与H+-PPase互作的蛋白并研究其功能对于揭示H+-PPase的作用机制具有重要的理论意义与实际意义。
本研究采用拟南芥氢离子焦磷酸化酶AVP1为诱饵筛选拟南芥cDNA文库, 筛选到一个AVP1互作蛋白小GTP结合蛋白AtRAB。通过比较 AVP1和 AtRAB拟南芥突变体在高盐、低磷、低钾胁迫条件下的表型, 分析 AtRAB对离子吸收的调控, 其结果有助于明确正向调控的抗逆反应及探索调控机制。
1.1.1 研究材料 拟南芥野生型(Columbia)由中国农业科学院作物科学研究所小麦分子育种课题组提供, 拟南芥H+-焦磷酸化酶基因 AVP1突变体 avp1和小GTP结合蛋白 AtRAB突变体 rab购于 Arabidopsis Biological Resource Center (ABRC)。
1.1.2 载体和菌株 克隆载体pZero Back/blunt Vector、大肠杆菌感受态TOP10购于天根生化科技(北京)有限公司。筛库所用表达载体pBT3N、pBT3STE、pPR3N和质粒pOst1-Nubl、pTSU2-APP、pNubG-Fe65及酵母菌株NMY51购于Dualsystems Biotech公司。拟南芥均一化cDNA文库由本实验室采集拟南芥整株包括根、茎、叶、花、果荚等所有组织经各种处理及提取RNA后构建。GFP载体、YFPN、YFPC载体由本实验室保存。
1.1.3 试剂 DNA聚合酶PrimeSTAR HS DNA Polymerase, RT-PCR所用反转录试剂盒购于TaKaRa公司。基因克隆所用反转录试剂盒购于Invitrogen。限制性内切酶、T4连接酶购于Promega。DNA、RNA提取, 质粒提取, 琼脂糖凝胶DNA回收, 荧光定量试剂盒, DNA MarkerIII、D2000等采用天根生化科技(北京)有限公司或QIAGEN的相应产品。纤维素酶和果胶酶采用日本Yakult的产品。其他试剂购于Sigma、Amresco、Fermentas、BD、OXOID等公司, 分析纯试剂为国产。引物合成及DNA测序由北京奥科鼎盛生物科技有限公司承担。
膜蛋白酵母双杂交系统是由经典的酵母双杂交改进而来, 主要用于膜蛋白及胞质蛋白的筛选[ 27]。从拟南芥cDNA中扩增得到拟南芥H+-焦磷酸化酶基因 AVP1(At1g15690)的全长CDS序列, 并连接到pBT3STE载体上作为筛选cDNA文库的诱饵载体, 验证载体的自激活活性后进行筛库。筛库步骤及各种试剂的配制按照Dualsystems Biotech公司的Membrane系统进行(http://www.dualsystems.com/, P01201-P01229/P01301-P01329/P01401-P01429)。以筛库诱饵载体pBT3STE-AVP1转化NMY51酵母感受态细胞, 将拟南芥cDNA文库质粒转入, 将转化产物均匀涂布于SD/-Leu-Trp-His-Ade营养缺陷型培养基(四缺)平板上, 3 d后挑取单克隆摇菌后再重新点于外加X-α-gal的四缺筛选性培养基平板上, 通过观察克隆显蓝情况判断报告基因 LacZ的表达情况。选取显蓝克隆(3个报告基因 His+、Ade+和 LacZ+都表达)进行酵母质粒提取, 将质粒重新转入大肠杆菌TOP10感受态中, 重新提取质粒后再转入酵母, 再点于外加X-α-gal的四缺筛选性培养基平板上, 选取显蓝克隆测序。将所有测序结果用NCBI进行Blast比对。
以Blast序列比对得到一个与AVP1互作的蛋白AtRAB (小GTP结合蛋白, AT5G47200)。克隆 AtRAB全长CDS序列后将其连接到捕获载体pPR3N上, 将捕获载体pPR3N-RAB转化入含有诱饵载体pBT3STE-AVP1的NMY51酵母感受态细胞, 均匀涂布于SD/-Leu-Trp和SD/-Leu-Trp-His-Ade缺陷型培养基平板上, 30℃培养3~4 d。挑取单克隆用相应的SD/-Leu-Trp或SD/-Leu-Trp-His-Ade液体培养基摇菌至OD值 0.6~0.8之间。吸取1 μL菌液点于外加40 mmol L-1 X-α-gal的四缺筛选性培养基平板上, 30℃培养3~4 d, 通过观察是否显蓝来判断报告基因 LacZ+的表达与否。同时做好相应的阴性和阳性对照组。
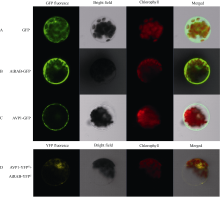
将AVP1及AtRAB全长CDS序列(去除终止密码子)分别构建到GFP载体上融合表达, 构建成35S::AVP1-GFP和35S::AtRAB-GFP载体用与亚细胞定位观察。再将AVP1全长CDS序列构建到YFPN载体上融合表达, 将AtRAB全长CDS序列构建到YFPC载体上融合表达, 构建成35S::AVP1-YFPN和35S::AtRAB-YFPC载体用于体内双分子荧光互补(BiFC)表达载体。用原生质体转化法将对照质粒35S::GFP、35S::AVP1-GFP、35S::AtRAB-GFP分别转化拟南芥叶肉细胞原生质体; 将35S::AVP1-YFPN和35S::AtRAB-YFPC共同转化拟南芥叶肉细胞原生质体。黑暗条件下25℃培养18 h以上后用Zeiss LSM700激光共聚焦显微镜观察载体表达情况。
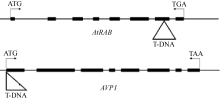
参照Gantlet (http://www.gantlet.org/)上的方法清洗、春化及种植拟南芥种子。得到小苗后取单株拟南芥叶片, 按照植物基因组DNA提取试剂盒的操作说明(天根)提取单株拟南芥叶片DNA。用T-DNA插入突变的检测方法[ 28]对突变体进行纯合鉴定, 通过http://signal.salk.edu/tdnaprimers.2.html设计T-DNA插入突变检测引物(表1)。
以RT-PCR分析得到的纯合突变体及WT的叶片, 按照RNAprep pure植物总RNA提取试剂盒的操作说明(天根, 北京)提取RNA, 按照PrimeScript RT Reagent Kit (Perfect real-time, TaKaRa)的操作说明进行反转录, 合成cDNA第一链, 将反转录后的模板稀释后用作荧光实时定量的模板。
采用SuperReal荧光定量预混试剂(SYBR Green, 天根)进行实时荧光定量PCR, 整个体系的配制应在避光条件下操作。于ABI7500荧光定量PCR仪上进行PCR。Real-time PCR采用三步法PCR扩增反应, PCR的预变性条件设定为95℃, 15 min。PCR采用95℃变性10 s, 60℃退火20 s, 72℃延伸32 s, 在72℃时采集荧光信号。采用RT-PCR方法检测 AtRAB和 AVP1在WT和突变体中的表达情况。
| 表1 相关引物序列 Table 1 Related primer sequences |
将WT、 rab和 avp1的纯合突变体种子消毒和春化处理后, 置培养室培养4~7 d, 在拟南芥长到2片子叶时分别移苗进行NaCl处理, 处理浓度为0 (MS)、50、100、150和200 mmol L-1。分别选取长势均匀一致的小苗转移到含有NaCl的培养基方皿(一次性使用)上, 4株苗为一组, 左边4株WT, 右边4株 avp1或 rab, 竖立, 倾斜3°培养7 d左右, 观察小苗生长状况, 并用WinRHIZO Pro 2012扫根软件配合EPSON Flatbed Scanner EPSON Expression 10000XL扫描仪扫描测量根长、侧根数及根分蘖数。
用1.6的方法对WT、 rab和 avp1的纯合突变体进行低磷和低钾处理。低磷培养基中磷的浓度梯度设为0、10、20、50和100 μmol L-1, MS作对照。低磷培养基配制时参照MS培养基的配方, 通过控制KH2PO4的量来控制低钾培养基中磷的浓度, 其他4种大量元素盐的量同MS。用KH2PO4设置低磷浓度梯度时减少的K+量用KCl来替代, 确保低磷培养基中磷元素以外其他元素都与MS中相同。低钾培养基同样使K+终浓度为这5个浓度梯度, 同时MS对作照。配制低钾培养基时也参照MS培养基的配方, 将大量元素中的KNO3去除, 通过控制KH2PO4的量来控制低钾培养基中K+的终浓度, 此时减少的PO43-的量用(NH4)2HPO4替代, KNO3中缺失NO3-的量用NH4NO3替代, 同时减去添加(NH4)2HPO4时多加入的NH4-的量, 确保低钾培养基中K元素以外其他元素都与MS中相同。
低磷、低钾培养方法同NaCl处理, 观察小苗生长状况, 并用WinRHIZO Pro 2012扫根软件配合扫描仪扫描测量根长、根表面积、侧根数及根分蘖数。
利用膜蛋白酵母双杂交系统筛选均一化拟南芥cDNA文库, 获得一个AVP1的互作蛋白, 经测序和NCBI Blast序列比对, 发现这是一个小GTP结合蛋白 AtRAB。将 AVP1和 AtRAB全长CDS序列克隆到酵母双杂交载体上进行互作验证, 将pPR3N-RAB (带有 AtRAB基因)转化含有诱饵载体pBT3STE- AVP1 (带有 AVP1基因)的NMY51酵母, 分别培养于双缺培养基(SD/-Leu-Trp)和四缺筛选培养基(SD/- Leu-Trp-His-Ade), 经过培养转化pPR3N-RAB和pBT3STE-AVP1的酵母可以在外加X-α-gal的四缺陷型上生长并显蓝, 除阳性对照外其他阴性对照组均不能生长(图1)。这说明AtRAB和AVP1蛋白可以在酵母中互作。
将分别转化有35S::GFP、35S::AVP1-GFP、35S:: AtRAB-GFP的拟南芥原生质体以及共转化有35S:: VP1-YFPN和35S::AtRAB-YFPC的原生质体置激光共聚焦显微镜下观察。发现, 转化有对照质粒35S:: GFP的充斥整个细胞(图2-A), 而AtRAB-GFP定位在细胞膜和细胞核中(图2-B), AVP1-GFP只定位在细胞膜上(图2-C)。而对于共转化有35S::AVP1-YFPN和35S::AtRAB-YFPC的原生质体细胞则能在其细胞膜和细胞核上观察到黄色荧光(图2-D), 这说明AVP1和AtRAB能在细胞膜和细胞核上发生互作。
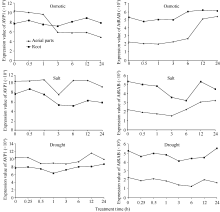
通过查询拟南芥基因表达数据库AtGenExpress Visualization Tool (http://jsp.weigelworld.org/expviz/)分析 AVP1和 AtRAB在胁迫条件下的表达情况。结果发现在渗透处理条件下, AVP1在地上部分的表达逐渐下降, AtRAB的表达则上升明显, 而在根中这2个基因的表达量变化趋势不大, AtRAB略有上升。在盐处理条件下 AVP1在地上部分的表达量在1 h时开始下降, 在3 h时最低, 3 h后重新上升, 在根中的表达量则略有下降; 而 AtRAB在地上部分的表达量下降到3 h后有所上升, 在根中的表达量逐渐下降到6 h时达最低, 其后上升。在干旱胁迫下这2个基因在根中和地上部分的表达量均较稳定, 受干旱诱导表达变化不大(图3)。
取拟南芥突变体的单株叶片, 提取DNA用作PCR检测模板, 用检测T-DNA插入突变的方法鉴定拟南芥纯合突变体(图4)。通过RT-PCR检测获得 rab纯合突变体四株, avp1纯合突变体2株。对所得纯合突变体进行RT-PCR分析显示, 纯合突变体中 AtRAB和 AVP1的表达受到抑制, 基因功能缺失(图5)。
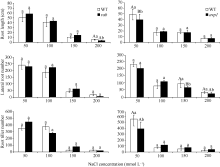
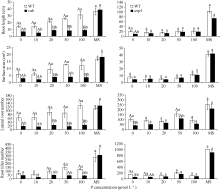
在MS培养基中添加NaCl后, 随着添加浓度的加大, 拟南芥WT和突变体 rab、 avp1都逐渐变小, 而突变体 rab和 avp1的生长特别是根部的生长相对于WT受到更明显的抑制, 突变体 rab与 avp1的表型相似(图6)。根系的扫描结果显示, 在200 mmol L-1NaCl处理条件下, 2个突变体在根长与侧根数方面低于WT, 证明这2个突变体对高盐胁迫的敏感性趋势相似, 但 rab对盐的敏感性相对更强一些。突变体相对于WT敏感性明显增强, 证明这2个基因都是正向参与植物的耐盐反应(图7)。
随着磷浓度的降低, WT和突变体 rab、 avp1的长势也都逐渐减弱, 突变体 rab和 avp1根部的生长相对于WT受到更多的抑制, rab和WT的差异, 达到极显著水平, 而 avp1比WT长势稍差, 差异没有达到显著水平, rab和 avp1的表型相似(图8)。对根系的扫描显示, 在20 μmol L-1、10 μmol L-1和无磷胁迫处理条件下, 2个突变体在根长、侧根数和根分蘖数等方面都低于WT。 avp1的根表面积虽略大于WT, 但差异不显著, 属正常误差范围。证明这2个突变体对低磷胁迫的敏感性相似, 突变体相对于WT敏感性增强, 证明这2个基因都是正向参与植物的耐低磷胁迫的响应(图9)。而随着 K浓度的逐渐降低, WT和突变体 rab、 avp1的长势同样变弱, 但WT的根系没有像低磷处理那样明显缩短, 突变体 rab和 avp1的根系随着钾浓度的降低变化不大, 维持在相似水平(图10)。根系扫描的结果显示, 在100、50和20 μmol L-1低钾处理条件下, 突变体在根长、根表面积、侧根数和根分蘖数等方面都低于WT (图11), 证明这2个基因都正向调控植物耐低钾胁迫的反应。
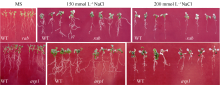 | 图6 不同浓度NaCl处理条件下突变体 rab和 avp1的表型Fig. 6 Phenotypes of rab and avp1 mutants on medium with different concentrations of NaCl |
 | 图8 不同浓度低磷处理条件下突变体 rab和 avp1表型Fig. 8 Phenotypes of rab and avp1 mutants on medium with different concentrations of P |
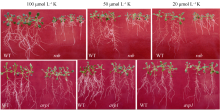 | 图10 不同浓度低钾处理条件下突变体 rab和 avp1的表型Fig. 10 Phenotypes of rab and avp1 mutants on medium with different concentrations of K |
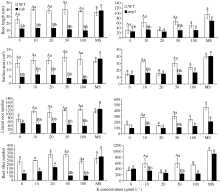 | 图11不同浓度低K处理下突变体 rab和 avp1根长、根表面积、侧根数及根分蘖数的变化 同一处理浓度下标记不同小写字母的表示柱值差异显著(P<0.05); 标记不同大写字母的表示柱值差异极显著( P<0.01)。 Fig. 11 Root length, surface area, lateral root number and root tiller number of rab and avp1 mutants under different concentrations of KThe values in the same concentration marked with different lowercase letters and different capital letters are significantly different at P<0.05 and P<0.01, respectively. |
在真核生物中, 小GTP结合蛋白能够调节多种生理过程, 包括细胞信号转导、细胞增殖、细胞骨
架组织以及细胞内膜运输等[ 29, 30, 31, 32]。小GTP结合蛋白可以进一步分为Ras、Rab、Rho、Arf和Ran 5种, 其中Ras类主要调节细胞的增殖, Rho类主要参与控制细胞骨架的形成, Arf类主要参与膜上各种物质的运输, Ran类主要参与蛋白的运输和RNA的转录[ 33]。本研究证明与AVP1互作的小GTP结合蛋白AtRAB属于Rab类(图1和图2), Rab类小GTP结合蛋白是细胞内膜运输的重要调节者, 可以调节胞吞、胞吐以及细胞内膜的循环利用[ 34]。有报道指出, AtRAB能被超氧自由基阴离子和水杨酸等诱导表达, 且在其转基因植物的液泡和芽中积累大量的Na+, 并能提高转基因植物对盐和渗透胁迫的抗性, 减少盐胁迫下活性氧的积累[ 35]。本研究发现 AtRAB不仅参与植物的耐盐反应, 而且参与植物在低磷、低钾胁迫条件下的反应, 正向调控植物对高盐、低磷和低钾等胁迫的耐性(图6~图11)。
文献报道, H+-PPase可以参与很多生理进程, 它所形成的H+梯度可以被液泡膜上的Na+/K+反向装运蛋白利用, 将Na+泵入液泡, 降低Na+在细胞质中的浓度, 这种离子区域化机制既能维持细胞渗透势, 又能维持细胞离子平衡, 避免一些无机离子(如Na+和C1-等)对细胞代谢的毒害从而提高植物的耐盐性[ 36]。Yang等[ 26]还发现, 过表达H+-PPase能够增强单子叶植物和双子叶植物对磷元素的吸收, 其作用原理是H+-PPase能够使液泡内pH降低, 造成液泡的酸化, 促进生长素IAA的分布, 进而促进植物根系的发育[ 23], 同时促进离子的吸收和转运[ 36, 37]。本研究也证明 AVP1具正向调控植物的耐盐性及耐低磷胁迫和耐低钾胁迫的能力。我们推测 AVP1基因的这些功能都与其可以酸化植物根部细胞的机制相关。
小GTP结合蛋白能够被GTP的结合所激活, 被随后的GTP水解为GDP所抑制, 扮演分子开关的角色[ 38, 39], 在处于活性状态时, Rab类小GTP结合蛋白能够和下游很多执行不同功能的蛋白互作, 控制这些蛋白的活性[ 33]。本研究中亚细胞定位分析证明AVP1和AtRAB都能在细胞膜上表达(图2-B, C), 这与文献报道的VP1的亚细胞定位结果一致[ 4, 5, 6], 双分子荧光互补实验(BiFC)证明AVP1和AtRAB能在细胞核和细胞膜上互作(图2-D)。另外, 本研究观察到AVP1只定位于细胞膜, 与文献报道一致, 但双分子荧光互补却表现出细胞膜和细胞核上的黄色荧光, 推测可能是AVP1和AtRAB在细胞膜上互作后发生了迁移, 有往核中迁移表达的倾向。至于两者是否发生互作后迁移, 还需要更深入研究。对拟南芥野生型(WT)、突变体 rab和 avp1在高盐、低磷及低钾胁迫条件下的比较表明, 这两个突变体的表型相似, 证明 AtRAB和 AVP1处于同一信号途径, 同时正向调控植物的抗逆反应。另有文献报道, AtRAB对植物的尖生细胞伸长是极其重要的, 能够定位于根毛细胞, 并且推测其通过一个参与极化分泌的细胞壁成分来调节膜运输[ 40]。因此, 我们推测AtRAB可能是通过和AVP1互作调节AVP1的活性, 影响植物对离子的吸收(图6、图8和图10)。它们之间的调控机制需要进一步研究。
AVP1和AtRAB能在细胞膜和细胞核上发生直接的相互作用。 AVP1和 AtRAB突变体在高盐、低磷和低钾胁迫条件下表型相似, 证明 AVP1和 AtRAB处于同一信号途径, 同时正向调控植物的抗逆反应。 AVP1和 AtRAB之间的调控机制还需要进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|