为了探索花生属异源多倍体进化理论和种间杂交过程所涉及的遗传机制, 以四倍体栽培种花生与二倍体野生种
To explore the allopolyploidy evolutionism and the genetic mechanism of
多倍化是生物进化中的一种普遍现象, 几乎所有的真核生物及绝大多数被子植物在其进化过程中都经历了一次或数次多倍化过程[ 1, 2], 常见的重要农作物如水稻、棉花、玉米、马铃薯、大豆、甘蔗、小麦、油菜、木薯等都是多倍体[ 3, 4, 5, 6, 7]。通过种间杂交和染色体加倍形成的异源多倍体兼具多倍体和杂种双重优势而具有重要的育种价值, 被广泛应用于植物新品种培育[ 8, 9, 10, 11]。新形成的异源多倍体由于受到杂合和多倍化双重冲击, 会发生快速而广泛的遗传和表观遗传变化, 其分子机制更是近年来科学界研究热点之一[ 12, 13, 14, 15, 16]。因此, 异源多倍体无论是对育种应用研究还是对进化理论研究都极为重要。目前, 对拟南芥[ 14, 17]、小麦属[ 15, 18, 19]、棉花[ 20]、油菜[ 21]、千里光[ 22]、甜瓜属[ 23]等少数植物种类异源多倍体基因表达变化研究表明, 基因表达变化可发生在多倍体形成时或以后几个世代中, 也可伴随整个进化过程, 且各种功能类别的基因在异源多倍化过程中都可能发生表达变化, 但不同植物的异源多倍体基因发生沉默的频率及倾向性、基因激活发生与否及发生的特点及部分同源基因表达水平的变化都因不同物种而异。
栽培花生是通过自然杂交和加倍形成的异源四倍体, 是世界上重要的油料和经济作物之一。花生属( Arachis)由一大批二倍体种和少量四倍体种组成, 国内外关于花生属起源的研究比较多[ 24, 25, 26, 27], 但对其异源多倍化过程中相关分子机制的研究甚少, 仅有Garcia等[ 28]和贺梁琼等[ 29, 30]报道过花生属种间杂交后代的回交各世代和多倍化早期各世代基因组的遗传继承及丢失, 目前尚缺乏该物种多倍化过程中基因表达变化的相关研究。由于不同的物种异源多倍体进化过程中基因表达变化的特点不尽相同, 且新合成的花生属异源多倍体由于其亲缘关系明晰, 是开展相关研究的良好模式系统。
SCoT标记技术是Collard等[ 31]于2009年在水稻上提出的一种根据ATG起始密码子侧翼保守区域设计引物进行单引物扩增反应的新型目标分子标记技术[ 32, 33], 已被成功应用于水稻[ 31]、花生[ 34]、龙眼[ 36]、芒果[ 37, 38]、菠萝[ 35]等植物的遗传多样性分析, 但cDNA-SCoT差异显示技术仅在甘蔗[ 39, 40]上有所报道。本研究以花生属四倍体栽培种仲恺花4号和二倍体野生种 A. doigoi种间杂种F1、早期多倍体世代S0~S3及亲本为试材, 利用cDNA-SCoT技术分析该组合异源多倍化早期各世代的基因表达变化, 从分子角度更好地理解早期各世代间及世代内材料之间的表型不稳定现象, 进一步验证cDNA-SCoT差异显示技术的可行性, 并初步了解花生异源多倍体进化过程中的基因表达变化特点, 为探讨花生属多倍体进化的分子机制提供参考依据, 同时, 也为异源多倍体物种进化理论提供新的证据, 对完善物种进化理论及利用野生花生资源中的优异基因均具有非常重要意义。
花生属四倍体栽培种仲恺花4号和二倍体野生种 A. doigoi(PI 276235)于2007年5月杂交, 获得种间杂种F1及早期异源多倍体世代群体S0~S3, 并于2012年11月13日上午, 选取1株F1、1株S0、3株S1植株(由该S0植株自交1代获得的后代材料S1-1、S1-2、S1-3)、12株S2植株(每个S1植株后代各取4株, 即由S1-1植株自交1代获得的4株S2-1材料、S1-2自交1代获得的4株S2-2材料、S1-3自交1代获得的4株材料S2-3)、13株S3植株(即S1-1自交2代获得的4株后代材料S3-1、S1-2自交2代获得的4株后代材料S3-2、S1-3自交2代获得的5株后代材料S3-3)及双亲共32份材料的顶部健康幼嫩叶。
T载体(pMD18-T)和逆转录酶(M-MLV)购自TaKaRa公司; 逆转录引物Oligo(dT)18购自Invitrogen公司; 工程菌JM-109购自Transgene公司; DEPC水购自上海捷瑞生物工程有限公司; 琼脂糖凝胶回收试剂盒和DNA聚合酶购自生工生物工程(上海)有限公司, 相关引物合成及测序也由该公司完成。
参考熊发前等[ 41]建立的改良两步LiCl沉淀法提取花生RNA, 分别用1.5%琼脂糖凝胶电泳和紫外分光光度计检测RNA纯度和浓度, 并将终浓度调成一致, 按逆转录(M-MLV)操作合成cDNA第1链, 将逆转录引物Oligo(dT)18用DEPC水稀释10倍, -80℃分装保存备用。
cDNA-SCoT PCR体系20 μL, 含ddH2O 15.3 μL、10×PCR buffer (含Mg2+) 2 μL、10 mmol L-1dNTPs 0.5 μL、10倍稀释第1链cDNA 1 μL、10 μmol L-1引物1 μL、5 U μL-1 Taq DNA聚合酶0.2 μL。PCR程序为94℃预变性3 min; 94℃变性30 s, 50℃退火60 s, 72℃延伸90 s, 35个循环; 72℃延伸5 min。扩增产物经1.5%琼脂糖凝胶电泳检测, EB染色显影。
统计条带时仅考虑条带的有无, 不考虑条带的强弱变化, 有条带记为1, 无条带记为0, 建立SCoT引物在32份花生材料中扩增的cDNA片段有无的分
布表。亲本条带的沉默指条带在亲本中出现而在后代材料中不出现, 激活表达指条带在后代材料中出现而在亲本中不出现。本试验中每条引物均进行2次扩增, 只统计在重复扩增中都能稳定出现的条带。
选取250~2000 bp的差异片段(transcript derived fragments, TDFs)回收纯化, 连接到pMD18-T载体上, 转入大肠杆菌JM109感受态细胞中并进行蓝白斑筛选, 经菌液PCR初步检测后将阳性克隆菌液送生工生物(上海)服务有限公司测序, 利用NCBI数据库中的Blast分析软件比对分析测序结果。
采用本课题组已经建立好的改良两步LiCl沉淀法提取的花生幼叶总RNA经琼脂糖凝胶电泳带型完整且清晰, 说明RNA具有较高的纯度和浓度(图1)。RNA经紫外分光光度计检测, OD260/OD280比值在1.79~2.00之间, OD260/OD230比值在2.14~2.30之间, 表明质量较好, 基本无降解, 蛋白质和酚类的污染少, 符合实验要求。逆转录的cDNA第1链在琼脂糖凝胶上呈现均匀弥散状, 大小在200~2000 bp之间(图2), 表明逆转录效果较好, 所获得的cDNA可进行下一步试验。
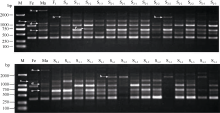
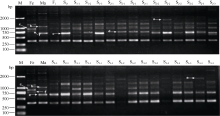
采用cDNA-SCoT技术对亲本和种间杂交异源多倍化早期世代(F1~S3)的基因表达变化进行分析, 发现在花生属人工异源多倍体进化过程中基因表达变化早在F1代即发生, 并在多倍体形成之后的当代及以后几个世代中继续发生着变化(图3)。基因表达变化类型主要包括6种: (1)父本二倍体野生种转录物在种间杂种F1及早期多倍体世代所有材料中沉默(图3); (2)母本四倍体栽培种转录物在种间杂种F1及早期多倍体世代所有材料中沉默(图4); (3)父本二倍体野生种转录物在种间杂种F1及早期多倍体世代部分材料中沉默(图3和图4); (4)母本四倍体栽培种转录物在种间杂种F1及早期多倍体世代部分材料中沉默(图3); (5)双亲转录物都在F1及早期多倍体世代部分材料中沉默(图4); (6)在杂种Fl及早期多倍体世代材料中出现亲本不具有的特异性新转录物(图3和图4)。
基因表达变化发生频率最高的是S1, 变化数为72, 60个亲本转录物丢失, 12个新片段产生, 占扩增总片段数的55.56%和11.11%; 其次是S2, 变化数为62, 48个丢失, 14个新转录物产生, 占总片段数的44.44%和12.96%; 接着是S3, 变化数为61, 占扩增总片段数的57.41%; 最后是F1和S0, 变化数分别为43和36, 分别占扩增总片段数的39.82%和33.33% (表1)。结果表明, 花生属人工异源多倍体进化过程中基因表达发生了快速而剧烈的变化, 变化类型以亲本转录物的沉默为主, 并伴随着大量新转录物的激活表达。
| 表1 花生属人工异源多倍化早期各世代基因表达变化频率 Table 1 Frequency of fragments variation in the early generations during Arachisartificial allopolyploidization |
从46条SCoT引物中筛选出12条扩增结果稳定、条带清晰的引物。通过12条单引物扩增, 获得
108个100~3000 bp之间的cDNA片段, 其中多态性片段80个, 选取其中的35个500~2000 bp的差异片段(transcripts derived fragments, TDFs)进行克隆和序列分析, 最终成功克隆获得了27条差异片段序列, 回收成功率为77.14%, 其中26个TDF和NCBI数据库已登入的基因具有较高的同源性(表2), 按照其功能可分为5类, 即能量与代谢相关基因(8个, 占阳性克隆总数的29.63%)、抗逆相关基因(4个, 占阳性克隆总数的14.82%)、未知功能蛋白(3个, 占阳性克隆总数的11.11%)、信号转导相关基因(2个, 占阳性克隆总数的7.41%)和反转录转座子相关基因(9个, 占阳性克隆总数的33.33%); 有1个TDFs无显著同源的序列信息(占阳性克隆总数的3.70%), 均称其为未知基因。从表2可以看出, 在后代沉默的并来自父本的12条基因片段中, 有4个与提高抗性相关的基因, 2个反转录转座子相关基因, 2个信号转导相关基因, 4个能量与代谢相关基因; 在后代沉默的并来自母本的4条基因片段中, 有2个未知功能蛋白相关基因, 2个能量与代谢相关基因; 在新增的10条基因片段中, 有7个反转录转座子相关基因, 2个能量与代谢相关基因, 1个未知功能蛋白相关基因。
| 表2 花生属种间杂交多倍化过程中TDFs功能预测 Table 2 Function prediction of TDFs in polyploidization of genus Arachis interspecific hybridization |
本试验将cDNA-SCoT差异显示技术应用于花生属人工异源多倍体进化过程中的基因表达变化分析,对不同模板、引物、PCR体系和扩增条件等进行了摸索和优化, 最终有12条SCoT引物能在所有供试花生材料中扩增出集中在200~2000 bp之间、重复性好且清晰的片段, 回收差异片段, 成功率高、假阳性低, 与在甘蔗上的研究结果[ 39, 40]一致, 同时该技术兼具操作简单和成本较低等优点, 说明cDNA-SCoT差异显示技术完全适用于花生属基因表达变化分析, 与cDNA-AFLP技术一样是研究异源多倍体中基因表达变化的有效技术[ 18, 20, 23], 并可以作为其他物种基因差异表达分析技术的有效补充。
在本研究中, 12条SCoT引物在供试材料中共扩增出108个cDNA片段, 杂种F1及早期多倍体世代S0~S3与亲本扩增条带相比, 发生变化的转录物总数为80个, 占扩增总片段数的74.07%。说明在花生属种间杂交早期多倍化过程中, 基因表达表现出强烈的不稳定性, 这与小麦[ 18, 19]、棉花[ 20]、甜瓜属[ 23]、拟南芥[ 41]等作物上所报道的异源多倍化过程中基因表达变化普遍发生、但基因表达变化只是一个小概率事件、多倍体后代能遗传和表达大多数亲本的基因有很大不同。在本研究中基因表达变化频率高达74.07%, 特别是早期多倍体世代S1~S3, 片段变化数分别为72、62和61, 分别占总片段数的66.67%、57.41%和56.48%, 这可能与该组合早期世代通过种间杂交从三倍体到六倍体、六倍体经多倍体进化到最终稳定的四倍体过程中, 基因组受到杂合和多倍化的双重冲击而极端不稳定、从而在早期世代之间和同世代的材料之间发生疯狂分离相关。
在本研究中, 基因表达变化起始于F1代并在多倍体形成当代及以后的自交世代中继续发生, 伴随着整个进化过程, 这与Kashkush等[ 18]报道的小麦异源多倍化过程中基因表达变化起始于F1代并贯穿整个进化过程一致, 而与Zhuang等[ 23]研究发现的甜瓜属多倍体进化中基因表达变化起始于S1代不同。另外, 仲恺花4号× A. doigoi杂交组合的基因表达变化以亲本基因的沉默或消失为主, 且父本二倍体野生种基因沉默或消失的比例要比母本四倍体栽培种大, 并伴随着大量基因的激活表达, 与贺梁琼等[ 29, 30]在利用SSR、SCoT标记分析花生栽培种× A. chacoensis组合异源多倍化早期基因组变化的研究结果类似, 在丢失的亲本条带中以父本条带为主, 同时伴有大量新条带的产生, 这可能与花生属种间杂交异源多倍化进程实际上是一个不断进化以接近四倍体栽培种的过程有关, 因而造成二倍体野生种
花生基因更倾向于丢失或沉默、四倍体栽培种花生基因更倾向表达。因此, 有必要开展进一步的研究以探明异源多倍体中沉默的基因是否具有基因组倾向性以及探讨基因表达变化的相关机制。Adams等[ 20]对棉花异源多倍体的研究表明, 发生变化的基因不具有明显的基因组倾向性; Zhuang等[ 23]对甜瓜属异源多倍体研究表明, 二倍体亲本的基因在异源多倍体中发生沉默的频率存在一定的差异, 母本甜瓜属野生种的基因在异源四倍体中沉默的频率较父本栽培种要高, 说明不同的物种在异源多倍化中基因变化的频率不尽相同。
亲本转录物的丢失是亲本基因片段的丢失或沉默造成的, 基因片段的丢失是不可逆而沉默是可逆的。本研究中有4个亲本转录物在后代所有材料中都丢失, 可能是与基因片段丢失引起的不可逆过程相关; 而另外的62个亲本转录物在后代材料中呈现沉默后又表达, 或表达后又沉默, 是一个动态的过程, 可能是由于基因片段沉默引起的可逆过程引起, 这还有待进一步验证。此外, 杂种F1和S0代片段变化数分别为43个和36个, 杂交引起转录物变化数有43个, 从杂交到染色体加倍仅有7个转录物发生变化, 由基因组加倍引起的变化并不大, 这与千里光[ 43]、油菜[ 21]、玉米[ 44]相关研究中报道的杂交比基因组加倍对基因表达影响更大的结果类似。可以推断异源多倍体进化过程中染色体杂合所带来的冲击比染色体加倍所产生的影响大得多。
彭海等[ 8]指出在异源多倍体中各种类别的基因都有可能发生表达变化, Adams等[ 20]、Comai等[ 42]、Zhuang等[ 23]和Kashkush等[ 18]研究表明与植物生长发育相关和基因组稳定性相关的基因表达模式在异源多倍化进程中会发生变化, 但不同植物间存在着一定的差异, 此外, Kashkush等[ 18]用cDNA-AFLP技术研究人工异源四倍体小麦基因表达变化中发现激活表达的基因全部为逆转座元件, 而Zhuang等[ 23]的甜瓜属相关研究中没有发现激活表达的基因与逆转座子有关。本研究中的26个TDFs和NCBI数据库已登录的基因具有较高的同源性, 包括能量与代谢相关基因、抗逆相关基因、未知功能蛋白、信号转导相关基因和反转录转座子相关基因, 这与其他异源多倍体的研究结果基本一致。另外, 10个激活表达的基因片段中, 有7个是反转录转座子相关基因, 进一步证明种间杂交作为一种基因组胁迫激发转座子的活性[ 45]。花生属种间杂交人工异源多倍化进程中基因丢失或沉默、逆转录转座子激活的调控机制以及逆转录转座子激活在进化中的作用还有待进一步研究。
应用cDNA-SCoT技术分析花生属人工异源多倍体进化早期基因表达变化, 在F1即发生剧烈变化并贯穿早期几个世代, 获得27个差异表达基因片段, 主要包括能量与代谢相关、抗性相关、信号转导及反转录转座子相关基因, 这些差异表达的基因为了解花生属异源多倍体进化过程中的分子机理提供了重要的信息, 对丰富物种进化理论及利用野生花生资源中的抗病、抗逆优异基因进行品种遗传改良也都具有非常重要的意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|