第一作者联系方式: E-mail:jiashuangwei8@126.com,gaoying@caas.cn, Tel: 010-82108751
** 同等贡献
锌指蛋白是一类重要的转录因子家族, 参与植物基因转录调节、发育及胁迫反应等生理过程。我们前期研究发现芥菜诱导型启动子BjC-P的W-box-like-4为其真菌诱导的核心元件, 本研究通过酵母单杂交技术从芥菜cDNA文库中筛选到与W-box-like-4序列特异互作的转录因子基因
** Contributed equally to this work
Zinc-finger proteins, forming an important transcriptional factor family, are involved in gene transcriptional regulation, development and stress-responses in plants. The previous studies revealed that BjC-P is a fungus-inducible promoter from
在植物中, 锌指蛋白(zinc-finger protein, ZFP)形成一类较大的转录因子家族[ 1]。目前已报道了拟南芥、矮牵牛、小麦、棉花、大豆、水稻等植物中的一些锌指蛋白[ 2]。“锌指” “Zinc-finger”特指一类蛋白结构域, 在这个结构域中一个锌原子被半胱氨酸残基和组氨酸残基包围。根据半胱氨酸(C)和组氨酸(H)残基的数目和位置可将锌指蛋白分为C2H2、C2HC、C2HC5、C3HC4、CCCH、C4、C4HC3、C6和C8等类型[ 1, 3, 4, 5]。其中, C2H2 (Cys2/His2)型成员最多, 也是研究最为深入的一类锌指蛋白, 是植物中最重要的转录调节子家族之一[ 6, 7]。如拟南芥有176个C2H2型锌指蛋白, 水稻中有189个C2H2型锌指蛋白成员[ 6, 7]。研究表明该类蛋白在转录调节、发育、病原菌防御以及胁迫反应等关键过程中发挥着重要的作用[ 7, 8, 9, 10, 11]。例如水稻 ZFP182能增强转基因烟草和水稻对盐胁迫的抗性[ 12], 并在ABA诱导的抗氧化防御反应中发挥重要作用[ 11]; 水稻 ZFP245和 ZFP179过表达能够增强超氧化物歧化酶(SOD)和过氧化物酶(POD)在干旱、冷和盐胁迫条件下的活性, 以及增加水稻幼苗对氧胁迫的抗性[ 13, 14]; 马铃薯 StZFP1在晚疫病病原菌( Phytophthora infestans)侵染后表达增强[ 15]。
几丁质酶是一类病原相关蛋白, 参与植物生长发育以及生物与非生物胁迫反应[ 16]。许多几丁质酶过表达转基因植株增强了对细菌和真菌的抵抗性[ 16]。 BjCHI1是目前已知的植物中唯一含2个几丁质结合域(CBD)的几丁质酶基因[ 17]。BjCHI1不仅能抑制真菌病原体( Colletotrichum truncatum, C. acutatum, B otrytis cinerea和 Ascochyta rabiei)的生长, 且能凝聚革兰(氏)阴性菌( Escherichia coli, Ralstonia sol a nacearum和 Pseudomonas aeruginosa)[ 18, 19]。 BjCHI1的转基因烟草和马铃薯的提取物呈现出抗绿色木霉活性, 转基因马铃薯增强了马铃薯对立枯丝核菌侵染的抗性[ 20, 21]。在前期研究中, 我们分离克隆了 BjCHI1基因启动子序列(BjC-P, GenBank登录号为AY714982), 明确了BjC-P的真菌诱导特性并鉴定了真菌诱导核心元件(W-box-like-4)[ 22]。进一步以含有W-box-like-4的125 bp序列为诱饵, 通过酵母单杂交技术筛选芥菜cDNA文库, 获得10多个与诱饵序列结合的蛋白。本研究对其中一个C2H2型锌指蛋白(命名为Bj26)深入分析, 重点研究了Bj26与BjC-P真菌诱导核心元件的特异性互作、亚细胞定位、对BjC-P的激活及 Bj26基因在真菌诱导条件下的表达, 以期为研究C2H2型转录因子在作物抗真菌病原菌的调控机制提供参考依据。
芥菜幼苗经200 µg mL-1的真菌激发子(hexa-N- acetyl-chitohexaose)[ 22]叶面喷洒处理, 处理后12、24、48和72 h取样速冻于液氮中, 用于提取总RNA。本氏烟种子由本实验室保存, 播种于土壤中并于(23±1)℃、每天16 h光照温室中培养, 待第6片叶完全展开时, 第5和第6片叶用于农杆菌介导的基因瞬时表达。酵母单杂交筛选所用菌株为Y1HGold (Clontech公司产品), 由中国农业科学院作物科学研究所毛龙研究员惠赠。
酵母菌株为Y1HGold, 诱饵载体为pAbAi, 捕获载体为pGADT7-SfiI。野生型诱饵片段Bait1为BjC-P含有真菌诱导核心元件序列(GTAGT GACTCAT) 的区段(-700 ~ -621)和与其协同作用的区段(-409 ~ -371)相连而成的片段, 长度为125 bp。突变体诱饵片段为Bait1-m, 其Bait1中真菌诱导核心元件序列(GTAGTGACTCAT)的保守碱基TGAC突变为GCAA, 其他序列与野生型Bait1序列完全一致。Bait1序列为5′-CTCTGCTAGAGA TAGTGTGGCCCAGCTAGTGAGTAGTGACTCATGAGGTAGAGAGAGGGTGGTCCATCATATATCGT GTTGCATGCGCTAGAGAGAGGGTGGTCCAGCTATCGTGTAGAAATATT-3′, Bait1-m序列为5′-CTCT GCTAGAGATAGTGTGGCCCAGCTAGTGAGTAGG CAATCATGAGGTAGAGAGAGGGTGGTCCATCATATATCGTGTTGCATGCGCTAGAGAGAGGGTGGTCCAGCTATCGTGTAGA AATATT-3′。酵母单杂交方法严格按照Clontech公司的实验手册操作(Matchmaker Gold Yeast One-Hybrid Library Screening System User Manual)。前期工作已获得了序列正确的诱饵酵母菌株Y1HGold [pBait1-AbAi]和Y1HGold [pBait1- m-AbAi], 并确定了Y1HGold [pBait1-AbAi]和Y1HGold [pBait1-m-AbAi]抑制自激活的AbA最小浓度分别为550 ng mL-1和300 ng mL-1, 获得了和Bait1序列互作的阳性克隆, 我们将其中一个称之为pGADT7-Bj26。
将酵母单杂交筛选获得的pGADT7-Bj26克隆测序后, 用GENSCAN软件寻找基因的开放阅读框, 预测编码氨基酸序列。用Vector NTI (Ver. 11.5)软件分析Bj26蛋白质的氨基酸序列组成、相对分子质量、等电点等理化性质。用NCBI中的Protein domain、Blast软件分析Bj26的保守结构域和同源性比对, 软件ClustalX 1.81将拟南芥及水稻中与 Bj26 CDS序列具有较高同源性且含有C2H2锌指结构域的基因进行序列相似性比较, 并通过MEGA 6进行进化树分析。
以pGADT7-Bj26质粒为模板, Bj26-F: 5′-CGGG ATCCATGGCGCTCGAGGCTCTCAGTTC-3′, Bj26-R: 5′-GCGTCGACTCAAAAACATTGCAAATCAATG-3′; 扩增 Bj26基因cDNA序列, 将该基因连接到pCAMBIA1307 (pC1307)载体相应的多克隆位点即 B amH I和 SalI位点, 连接产物转化大肠杆菌TOP10感受态细胞(购自康为世纪公司), 经含有卡那霉素的LB (Tryptone10 g L-1, 酵母提取物5 g L-1, NaCl 10 g L-1, 琼脂糖15 g L-1, pH 7.0)培养基筛选, 克隆经PCR及 B am H I、 Sal I鉴定呈阳性后, 送美吉公司测序, 将构建好的载体命名为pC1307-Bj26 (PBj26)。
用 B amH I、 Sal I双酶切载体pCAMBIA1205-GFP (pC1205-GFP)和pC1307-Bj26, 分别胶回收载体pC1205-GFP和 Bj26目标片段, T4 DNA连接酶16℃连接12 h, 转化TOP10, 涂布于含40 µg mL-1的氯霉素(Chl)的LB培养基上。 B am H I、 SalI双酶切鉴定阳性克隆, 将构建好的载体命名为pC1205-GFP-Bj26。
将上述载体pC1205-GFP-Bj26、pC1205-GFP电击转入农杆菌EHA105中, 以PCR鉴定质粒是否成功转入, 引物为Bj26F/R。将含有pC1205-GFP-Bj26、pC1205-GFP质粒的农杆菌株EHA105涂布在含利福平(30 µg mL-1)和氯霉素(40 µg mL-1)的LB培养基上, 28℃培养2 d, 刮取菌体, 用MMA缓冲液(10 mmol L-1 MgCl2, 10 mmol L-1 MES (pH 5.5), 100 µmol L-1 As)悬浮, 调节菌浓度OD600=1.0, 28℃培养箱中孵育3 h。用1 mL去针头的塑料注射器, 从叶片背面将菌液注入生长约6周的本氏烟叶片, 于人工温室培养24 h后, 撕取本氏烟叶片背面表皮, 用荧光显微镜OLYMPUS IX71观察Bj26的表达位置。
将构建好的pC1307-Bj26(PBj26)载体电击转入农杆菌感受态细胞EHA105, 将转化产物涂布在含卡那霉素(50 µg mL-1)和利福平(30 µg mL-1)的LB培养基上, 以PCR鉴定阳性克隆, 引物为Bj26F/R。将获得含阳性质粒PBj26的农杆菌菌株 、含真菌诱导核心元件的启动子质粒p16菌株、含真菌诱导核心元件突变质粒p53菌株[ 22]及含内标载体p57菌株培养在含卡那霉素(50 µg mL-1)和利福平(30 µg mL-1)的LB培养基上, 28℃生长2 d, 用MMA缓冲液悬浮, 调节菌浓度OD600=1.5, 28℃培养箱中孵育3 h。菌液PBj26、内标载体p57菌液及p16菌液或p53菌液按1∶1∶1混合。用1 mL去针头的塑料注射器, 将菌液注入生长约6周的本氏烟叶片中, 48 h后取一片叶样进行GUS组织化学染色, 一旦染色即终止反应, 用梯度酒精脱色。对称的另一片叶样用于蛋白提取液(CCLR, Promega, Madison, WI, USA)提取总蛋白, 离心吸取20 µL蛋白提取液加480 µL GUS反应液(0.1 mol L-1 pH 7.0的磷酸盐缓冲液, 0.5 mol L-1 EDTA pH 8.0, 0.1% Triton X-100, 10 mmol L-1 β巯基乙醇, 0.1% 月桂酰基肌氨酸钠, 1 mmol L-1 4-甲基伞形酮-bete-D-葡萄糖醛酸酐)混合, 迅速吸取反应混合液100 µL加到900 µL反应终止液(200 mmol L-1 Na2CO3)中, 将剩余的反应液放37℃水浴锅中反应, 30 min后取出, 快速吸取100 µL反应液加到900 µL反应终止液中混匀, 用HITACHI F-4600 FLUO-RESCENCE SPECTR OPHOTOMETER仪器测0 min、30 min GUS活性。根据Promega公司Luciferase Assay System的说明, 20 µL蛋白提取液加100 µL荧光素酶反应(Luciferase Assay Reagent, Promega, Madison, WI, USA)混匀, 用TriStar LB 941仪器测LUC活性。
分别取200 µg mL-1真菌激发子处理的芥菜叶片在12、24、48、72 h及对照0 h (未处理)取样, 于液氮中速冻研碎, 采用TIANGEN公司的植物总RNA提取试剂盒提取芥菜总RNA, 并用无RNAase污染的DNAase处理, 去除RNA中基因组DNA的污染。并用TIANGEN公司RNA反转录试剂盒合成cDNA第一链。反转录产物cDNA第一链用作实时定量PCR分析。实时定量PCR运用SYBR Premix Ex Taq试剂盒(TaKaRa)和ABI 7500快速实时定量PCR仪进行, 具体步骤参见试剂盒的使用说明和实时定量PCR仪的操作说明。芥菜持家基因 Actin作为内参基因, 通过其在不同样品间的表达水平对不同样品的PCR产物进行水平校正。对所有样品的实时定量PCR产物都进行溶解曲线分析, 以确保反应产物为一种特异的产物。下面的引物序列用作实时定量PCR: Bj26-F: 5'-TCGAGGCTCTCAGTTCAC-3', Bj26-R: 5'-CAGA CGCTGCACTTGTAG-3'; BjActin-F: 5'-CTTCTTACC GAGGCTCCTCT-3', BjActin-R: 5'-AAGGATCTTCA TGAGGTAATCAGT-3'。
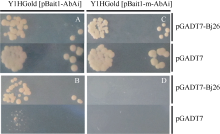
将前期实验获得的pGADT7-Bj26转入Y1Hgold [pBait1-AbAi]和Y1Hgold [pBait1-m-AbAi]酵母菌株, 分别在不含抗生素AbA和含550 ng mL-1 AbA的SD/-Leu缺陷性培养基上培养, 检测它们的生长情况。结果如图1-A和图1-C所示, pGADT7-Bj26和阴性对照质粒pGADT7不论转入野生型酵母菌株还是转入突变体酵母菌株, 在不含抗生素AbA的缺陷性培养基上均能长出健康的克隆, 说明所用酵母及转化没有问题。但在含有550 ng mL-1 AbA缺陷性培养基上只有pGADT7-Bj26质粒且仅在Y1HGold [pBait1-AbAi]野生型酵母菌株中能够长出健康的克隆, 在突变体酵母菌株中不能生长, 阴性对照质粒均不能生长(图1-B和图1-D)。这些结果说明Bj26蛋白与BjC-P真菌诱导核心元件特异互作。
将酵母单杂交获得的pGADT7-Bj26克隆测序后, 用GENSCAN软件对测序结果进行分析, 发现具有一个735 bp的完整阅读框, 编码244个氨基酸, 且该阅读框在pGADT7载体上正确翻译, 其cDNA序列及对应的氨基酸序列见图2, 经NCBI中Blast软件分析表明该序列为新克隆的芥菜cDNA序列。
利用NCBI中Protein Domain软件分析表明Bj26含有2个典型的C2H2结构域(图3-A), 并有2个高度保守的QALGGH氨基酸序列, 即图2下画线所示序列。Vector NTI (Ver. 11.5)软件分析表明Bj26蛋白等电点pI为9.2, 分子量为26.6 kD。用 Bj26的CDS序列在NCBI数据库进行Blast分析, 发现 Bj26与拟南芥与水稻基因序列存在较高的相似性。进一步在拟南芥基因组数据库及水稻基因组数据库进行Blast分析, 然后利用软件ClustalX 1.81将拟南芥及水稻中与 Bj26 CDS序列具有较高同源性且含有C2H2锌指结构域的基因进行序列相似性比较, 并通过MEGA 6进行进化树分析。进化树分析运用最大简约法, 采用Bootstrap法产生随机自检验1000次以验证进化树的可靠性。结果(图3-B)显示 Bj26与拟南芥和水稻C2H2锌指蛋白基因均具有一定的亲缘关系, 与拟南芥的亲缘关系近于水稻, 且属于同一亚类。
以pGADT7-Bj26质粒为模板, 利用引物对Bj26F/R (见实验方法)克隆 Bj26 CDNA序列, 并构建真核表达载体pC1205-GFP-Bj26 (见实验方法)。
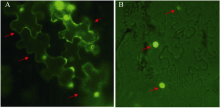
将构建好的真核表达载体pC1205-GFP-Bj26及其空载体pC1205- GFP在本氏烟叶片中瞬时表达, 空载体用作GFP-Bj26亚细胞定位的对照。瞬时表达2 d后, 撕取本氏烟叶片下表皮用OLYMPUS IX71荧光显微镜检测其亚细胞定位, 结果见图4。图中红色箭头指示GFP的发光部位。图4-A显示空载体GFP的亚细胞定位, 其表达于整个本氏烟叶片表皮细胞。图4-B显示GFP-Bj26仅定位于细胞核里, 进一步说明Bj26蛋白是细胞核定位转录因子, 与酵母单杂结果及生物信息学分析结果一致。
为进一步分析Bj26如何介导BjC-P对真菌诱导的响应过程, 我们采用本氏烟瞬时表达系统, 通过GUS染色和荧光定量分析了Bj26对BjC-P启动子的激活作用。由于P16质粒中的BjC-P序列为BjC-P响应真菌诱导的关键区段, 而P53为P16的突变序列, 且是真菌诱导核心元件中的保守碱基TGAC缺失, 因此通过这2个质粒, 能够进一步明确Bj26是否通过和真菌诱导核心元件结合进而激活该启动子活性。
图5-B结果显示, P16和P53单独注射后均没有检测到GUS活性, 但与PBj26共注射后P16的GUS活性明显增强, P53有微弱增强。图5-C也显示了类似的结果。说明Bj26能够通过和BjC-P中的真菌诱导核心元件序列结合进而激活该启动子活性, 但结合特异性不是很严谨。
酵母单杂交及瞬时表达实验证明Bj26能够和BjC-P的真菌诱导核心元件结合并激活该启动子活性, 暗示Bj26可能介导BjC-P真菌诱导响应并参与对植物抗真菌病原菌调控过程, 且受真菌激发子的诱导表达。用200 µg mL-1的真菌激发子处理芥菜幼苗, 保鲜袋保湿12 h, 然后分12、24、48和72 h取叶样, 0 h为芥菜叶片没有处理的对照。选用芥菜持家基因 Actin作为内参(序列见实验方法), 利用qRT-PCR检测 Bj26基因在激发子处理后的RNA表达情况(图6)。结果表明, Bj26基因在真菌激发子诱导后RNA表达量明显增强, 且在诱导后24 h表达量达到最高, 之后又呈现下降趋势。
植物在自然界中不仅遭受各种非生物胁迫, 而且也面临病原菌等生物胁迫。已有研究显示C2H2锌指转录因子也参与植物抗病防御反应调节, 如辣椒 CAZFP1基因, 编码一个C2H2型锌指蛋白, 在野油菜黄单胞菌( Xanthomonas campestris)和炭疽菌( Colletotrichum coccodes)侵染后mRNA表达水平增加[ 23]。马铃薯C2H2型锌指蛋白基因 StZFP1被马铃薯晚疫病( Phytophthora infestans)侵染以及盐、干旱、外源ABA处理后RNA表达增强[ 15]。烟草 ZFT1基因能够被烟草花叶病毒诱导表达, 且能引起过敏性坏死(hypersensitive response, HR)反应[ 24]。拟南芥 STZ基因被黄瓜花叶病毒侵染也能诱导产生过敏反应[ 25]。但是C2H2锌指转录因子在植物抗病防御反应过程中的作用机制尚需进一步研究。
Sakamoto等[ 26]研究发现植物C2H2型锌指蛋白特有的QALGGH结构单元以及2个锌指间隔的长度和序列对于锌指蛋白与靶DNA的结合是重要的。最初研究C2H2锌指蛋白与DNA的识别是矮牵牛中的 ZPT2-2基因, 其含2个C2H2锌指结构, 能够识别含2个AGT特定碱基序列[ 27]。凝胶阻滞分析显示4个拟南芥胁迫响应的C2H2型锌指蛋白基因 AZF1、 AZF2 、 AZF3和 ZAT10/STZ结合到26 bp结构单元中A(G/C)T重复碱基[ 26, 28]。A(G/C)T重复碱基的旁侧序列对于结合也有重要的影响[ 26]。本研究从芥菜cDNA中克隆到的C2H2型锌指蛋白Bj26, 生物信息学表明其含有2个典型的C2H2型锌指结构域, 每个结构域中含有保守的QALGGH序列, 2个QALGGH序列间隔50个氨基酸。通过与拟南芥及水稻C2H2型锌指蛋白CDS序列比对及进化树分析表明Bj26与拟南芥和水稻C2H2锌指蛋白均显示出一定的亲缘关系, 但与拟南芥的亲缘关系近于水稻, 且属于同一亚类。而具有亲缘关系的拟南芥及水稻C2H2型蛋白基因注释显示它们介导各种胁迫反应, 如对真菌激发子Chitin的响应, 对盐、氧化胁迫响应等, 暗示Bj26也极有可能参与到这些胁迫反应。qRT-PCR结果显示 Bj26受到真菌激发子的诱导表达, 此结果更进一步证实上述推论。
本研究通过酵母单杂证明Bj26和真菌诱导核心元件互作, 一旦将真菌诱导核心元件突变就丧失互作性, 说明Bj26和真菌诱导核心元件互作的特异性。但本氏烟瞬时表达实验表明Bj26不仅强烈激活含有真菌诱导核心元件的野生型启动子P16活性, 同时也对真菌诱导核心元件保守序列缺失的启动子P53有弱的激活作用, 暗示Bj26蛋白真菌核心元件特异互作不够严谨。由于Bj26含有2个锌指结构域, 据前人研究报道推测Bj26蛋白至少可以和2个AGT位点结合, 而P16序列中同时含有4个AGT, 1个在真菌诱导核心元件(GTAGTGACTCAT)内部(下画线所示碱基), 2个在核心元件的同一旁侧序列, 中间间隔1个碱基, 另1个离真菌诱导核心元件间隔16个碱基。P53中真菌诱导核心元件(GTAGTGACTCAT)保守序列(TGAC)的缺失, 使得P53中仍然含有2个AGT。Bj26蛋白之所以对P53有弱的激活作用, 可能与其含有的2个AGT有微弱的结合作用有关。
从芥菜中克隆了一个C2H2型锌指蛋白Bj26, 并明确Bj26通过和BjC-P的真菌诱导关键序列互作, 激活BjC-P, 进而介导BjC-P对真菌诱导的响应并参与调控植物抗真菌病原过程。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|







 -1,3-glucanase, designated HbGLU, and a pBI121-derivative that contains cDNAs encoding both BjCHI1 and HbGLU. In vitro fungal bioassays using Trichoderma viride showed that extracts from transgenic potato lines co-expressing BjCHI1 and HbGLU inhibited fungal growth better than extracts from transgenic potato expressing either BjCHI1 or HbGLU, suggesting a synergistic effect. Consistently, in vivo fungal bioassays with soil-borne R. solani on young transgenic potato plants indicated that the co-expressing plants showed healthier root development than untransformed plants or those that expressed either BjCHI1 or HbGLU. Light microscopy and transmission electron microscopy revealed abundant intact R. solani hyphae and monilioid cells in untransformed roots and disintegrated fungus in the BjCHI1-expressing and the BjCHI1 and HbGLU co-expressing plants. Observations of collapsed epidermal cells in the co-expressing potato roots suggest that these proteins effectively degrade the fungal cell wall, producing elicitors that initiate other defense responses causing epidermal cell collapse that ultimately restricts further fungal penetration.
-1,3-glucanase, designated HbGLU, and a pBI121-derivative that contains cDNAs encoding both BjCHI1 and HbGLU. In vitro fungal bioassays using Trichoderma viride showed that extracts from transgenic potato lines co-expressing BjCHI1 and HbGLU inhibited fungal growth better than extracts from transgenic potato expressing either BjCHI1 or HbGLU, suggesting a synergistic effect. Consistently, in vivo fungal bioassays with soil-borne R. solani on young transgenic potato plants indicated that the co-expressing plants showed healthier root development than untransformed plants or those that expressed either BjCHI1 or HbGLU. Light microscopy and transmission electron microscopy revealed abundant intact R. solani hyphae and monilioid cells in untransformed roots and disintegrated fungus in the BjCHI1-expressing and the BjCHI1 and HbGLU co-expressing plants. Observations of collapsed epidermal cells in the co-expressing potato roots suggest that these proteins effectively degrade the fungal cell wall, producing elicitors that initiate other defense responses causing epidermal cell collapse that ultimately restricts further fungal penetration.