稻瘟病是我国水稻主产区的重要病害之一, 其主效抗性基因
Rice blast is one of the important diseases in major rice producing areas in China. The main blast resistance genes
稻瘟病由子囊真菌( Magnaporthe grisea)引起, 是最严重的水稻病害之一, 其危害面积和危害程度较大, 已成为水稻高产稳产的严重阻碍。据统计, 稻瘟病使全球每年损失稻谷产量约占总产量的10%~ 15%, 造成经济损失达数十亿美元[ 1]。实践证明, 培育抗性品种是防治稻瘟病最经济、有效的方法。但由于稻瘟病菌变异性强, 很多抗性品种种植几年就会丧失抗性[ 2]。因此, 利用分子标记辅助选择(marker- assisted selection, MAS)技术将多个具有不同抗谱的稻瘟病抗性基因聚合到同一个品种中, 是培育具有持久抗瘟性品种的有效措施之一[ 3]。
随着分子生物学技术的迅速发展, 迄今已有50多个主效抗稻瘟病基因被精细定位, 其中24个基因被克隆[ 4, 5, 6, 7, 8]。 Pi-ta和 Pi-b是最早被克隆的2个主效抗稻瘟病基因[ 9, 10]。近期, 源于这2个基因及其等位感病位点的功能标记也已被开发出来, 可以快速、准确地从水稻种质资源中鉴定出抗性基因 Pi-ta和 Pi-b[ 11, 12]。李进斌等[ 13]利用抗性基因 Pi-ta和 Pi-b特异性分子标记分析了云南地方稻种的2个基因的分布; 刘华招等[ 14]和时克等[ 15]同样利用这2个特异性分子标记分别对黑龙江省主推的水稻品种和我国水稻主栽品种进行抗性基因 Pi-ta和 Pi-b鉴定分析。前人多侧重于利用标记研究这2个抗性基因在不同水稻品种中的分布, 但很少涉及对标记检测方法的优化, 尤其是同时检测抗性基因 Pi-ta和 Pi-b的多重PCR体系还未见报道。与单一基因分子标记的PCR相比, 多重PCR在一次PCR中就可检测2个或2个以上目标基因, 工作效率显著提高, 成本明显降低[ 16, 17]。因此, 针对特定目标, 开发简单、快捷和有效的多重PCR体系对促进水稻抗病分子育种发展具有重要意义。
本研究通过摸索PCR反应组分和循环参数对多重PCR反应结果的影响, 构建了2套稻瘟病分子标记多重PCR体系。每个体系内的引物之间不存在相互抑制作用和错配, 经检测已知基因型的品种反复验证, 结果稳定准确, 可用于同时筛选鉴定同一PCR反应体系中的2个抗(感)稻瘟病基因, 并利用该体系对336份高世代粳稻品种(系)的相关抗病基因 Pi-ta和 Pi-b及其感病等位基因 pi-ta与 pi-b进行检测, 旨在为 Pi-ta和 Pi-b基因筛选提供快速高效的分子标记辅助选择方法, 从而提高水稻抗稻瘟病育种效率。
在构建抗病基因 Pi-ta和 Pi-b的多重PCR体系(简称为体系I)时选用南粳44、南粳45、武运粳7号、武运粳8号、武运粳21、武粳15、武香粳14、常农粳5号、盐稻9号、扬粳805。在构建感病等位基因 pi-ta与 pi-b的多重PCR体系(体系II)时选用徐稻3号、徐稻4号、徐稻6号、镇稻88、淮稻5号、淮稻9号、连粳4号、连粳5号、连粳6号、连粳7号。分别以公认的抗稻瘟病品种嘉33作为抗病对照, 丽江新团黑谷作为感病对照[ 13, 18], 利用开发的多重PCR体系对336份高世代粳稻新品系所含抗病基因 Pi-ta和 Pi-b进行检测, 与单标记检测结果比较, 验证多重PCR体系的可靠性。在江苏省农业科学院粮食作物研究所试验田种植上述材料。5月10日播种, 6月10日移栽, 每个材料种植8行, 每行40株, 株行距13.2 cm × 26.4 cm, 常规田间管理。
在水稻分蘖盛期采取新鲜幼嫩叶片, 按CTAB方法[ 19], 略有修改, 提取对照品种及供试材料单株基因组DNA。
根据等位基因特异PCR原理, 王忠华等[ 20]利用自身序列设计特异性引物YL155/YL87和YL183/ YL87, 前一对引物能特异扩增出抗病等位基因 Pi-ta的相应序列, 约1042 bp的DNA片段; 后1对引物能特异扩增出感病等位基因 pi-ta的相应序列, 约1042 bp的DNA片段。根据Fjellstrom等[ 21]的序列合成引物 Pi-bdomF/ Pi-bdomR, 能特异扩增出抗病等位基因 Pi-b的相应序列, 约365 bp的DNA片段; 根据刘洋等[ 12]的序列合成引物Lys145F/ Lys145R, 扩增感病等位基因 pi-b的相应序列, 约803 bp的DNA片段。这些引物名称、序列及其扩增片段预期大小见表1。引物均由上海英潍捷基公司合成。
| 表1 用于多重PCR 反应的引物名称、序列及预期片段长度 Table 1 Name, sequences, and expected fragment size of specific primers used for Multiplex PCR |
2套多重PCR反应体系均为20 μL, 包括l × PCR buffer (1.5 mmol L-1 MgCl2)、200 μmol L-1 dNTP、1.25 U TaqDNA聚合酶(南京金斯特生物技术有限公司)、100~150 ng模板DNA和适量引物。扩增反应在Tprofessional热循环仪上进行, 扩增参数为95℃预变性3 min; 然后94℃变性1 min, 55℃复性 1 min, 72℃延伸1 min, 6个循环; 再进行94℃变性1 min, 55℃复性50 s, 72℃延伸30 s, 32个循环; 最后72℃延伸6 min。扩增产物加2 μL加样缓冲液, 取10 μL在含有溴化乙锭的1.5%琼脂糖凝胶上电泳分离, 缓冲体系为1×TAE溶液, 120 V电泳45 min, 紫外灯下观察并照相。为保证结果的稳定性和可靠性, 每份材料重复扩增3次以上。
先以22个已知基因组成的水稻品种DNA为模板, 利用4个基因的特异引物, 分别进行退火温度的梯度PCR, 明确每对引物出现清晰特异扩增条带的退火温度范围; 筛选出具有相同退火温度且扩增条带差异较大的引物, 组合成多重PCR, 进行下步已知基因组成材料的多重PCR检测。在明确构建体系所涉及的4对引物相同的退火温度后, 再按照原有引物、dNTP、DNA聚合酶等用量配制多重PCR体系, 进行PCR扩增和电泳检测。然后结合对照材料扩增的结果, 主要从引物用量、延伸时间和循环数等方面对体系进行调试优化。实验中先加入等浓度的引物量, 根据扩增结果再调整, 增大弱扩增的引物用量, 减少强扩增的引物用量; 在优化延伸时间时, 弱扩增适当延长。最终, 在2套多重PCR体系中, 使每个标记引物在含目标基因(位点)的已知对照材料中扩增出清晰的特异条带, 而在不含目标基因(位点)的已知对照材料中无特异条带出现。现将构建2套多重PCR体系的具体内容分述如下。
2.1.1 Pi-ta和 Pi-b多重PCR体系 本体系涉及 Pi-ta和 Pi-b两个抗病基因位点的标记, 由引物YL155/YL87和Pi-bdomF/Pi-bdomR构成。以已知基因组成的12个水稻品种(系) DNA为模板, 利用 Pi-ta与 Pi-b基因标记对其相应位点基因进行PCR扩增和电泳, 通过反复调整体系中引物间浓度比例、延伸时间和循环数等条件, 不断优化体系, 最终获得20 μL PCR反应体系I含2.0 μL DNA模板(约20 ng μL-1), 2.0 μL 10 × PCR buffer (25 mmol L-1), 2.0 μL d NTPs (2.5 mmol L-1), 引物浓度是10 μmol L-1, 每条引物用量0.8~1.2 μL, 用ddH2O补至20 μL。
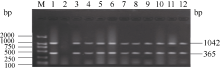
在图1多重PCR体系I检测的12个品种中, 南粳44和南粳45等10份材料同时扩增出了与抗病对照嘉33相同的条带, 分别为1042 bp和365 bp; 而感病对照丽江新团黑谷则无目的条带, 与时克等[ 15]和杨杰[ 22]等单一抗病基因PCR的检测结果完全一致, 表明这些品种都含有抗病基因 Pi-ta和 Pi-b。
2.1.2 感病等位基因 pi-ta与 pi-b多重PCR体系
按照构建多重PCR体系I的方法, 本体系涉及 pi-ta与 pi-b两个感病基因位点的标记, 由引物YL183/ YL87和Lys145F/Lys145R构成。通过不断优化体系, 同样获得了20 μL PCR 反应体系II含2.0 μL DNA模板(约20 ng μL-1), 2.0 μL 10 × PCR buffer (25 mmol L-1), 2.0 μL dNTPs (2.5 mmol L-1), 引物浓度是10 μmol L-1, 每条引物用量0.8~1.2 μL, 用ddH2O补至20 μL。
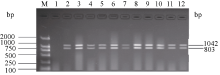
图2为利用感病等位基因 pi-ta与 pi-b多重PCR体系II检测12个已知品种(系)的结果。徐稻3号和徐稻4号等10份材料, 同时扩增出了和感病对照丽江新团黑谷相同的特异条带, 分别为1042 bp和803 bp; 而抗病对照嘉33则未扩增出目的条带, 与杨杰等[ 22]和何重等(待发表)单一感病基因PCR的检测结果完全相同, 表明这些品种都含有感病基因 pi-ta与 pi-b。
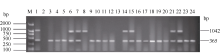
利用已建立的2套多重PCR体系, 对本研究团队自主选育的336份高世代育种材料进行抗病基因 Pi-ta和 Pi-b以及感病等位基因 pi-ta与 pi-b的检测。结果显示, 336份供试材料中, 只含有抗性基因 Pi-ta的品系有119份, 占总量的35.42%, 只含有抗性基因 Pi-b的品系有319份, 占总量的94.94%。有112个品系同时扩增出1042 bp和365 bp两条抗病基因目的条带, 占供试材料的33.33%, 这些品系的目的条带与抗病对照嘉33相同, 说明这些品系均含有抗性基因 Pi-ta和 Pi-b; 10份材料均检测到了与感病对照丽江新团黑谷相同的1042 bp和803 bp感病基因目的条带, 占总数的3.0%, 说明这些品系含有感病基因 pi-ta和 pi-b; 有7个品系同时扩增出1042 bp抗病基因目的条带和803 bp感病基因目的条带, 占总数的2.1%, 说明这些品系含有抗性基因 Pi-ta和感病基因 pi-b; 207个品系同时扩增出1042bp感病基因目的条带和365 bp抗病基因目的条带, 占总数的61.61%, 说明这些品系含有感病基因 pi-ta和抗病基因 Pi-b (表2)。上述检测结果与何重等(待发表)单一感病基因PCR的检测结果完全相同。部分品系检测结果见图3和图4。
从以上分析可以看出, 高世代育种材料中聚合2个抗稻瘟病基因的品系比例较少, 抗性基因 Pi-b的分布频率明显高于抗性基因 Pi-ta的分布频率。
| 表2 抗病基因 Pi-ta和 Pi-b在336份粳稻品系中的分布 Table 2 Distribution of Pi-ta and Pi-bin 336 japonica rice lines |
分子生物学的发展, 极大地推进了稻瘟病抗性遗传研究的进程, 而大量定位的稻瘟病抗性基因为采用MAS 技术开展抗性育种奠定了基础。开发一种高效且不受季节和样品种类限制、能在水稻生长发育早期即可检测其抗性基因组成的方法, 有助于加快水稻抗稻瘟病遗传改良的进度。常规的抗稻瘟病基因型分析, 依赖于抗性鉴定和表型选择, 育种
周期长, 且存在选择效率低、工作量大、操作困难等诸多缺点。分子标记检测样品可以是植株任何部位的组织, 取样不受水稻生长季节和样品种类限制, 操作过程比较简单; 而与单一PCR方法相比, 多重PCR一次可以同时检测多个目标基因, 具有低成本、易操作、高效率等优点, 适合目标位点的分子辅助选择聚合育种。与前人建立的单一PCR检测体系相比, 本研究构建的多重PCR体系涉及更多位点, 特异性和灵敏度较好, 检测效率更高, 更适合抗病基因 Pi-ta和 Pi-b的资源筛选和分子聚合育种。
前人研究表明, Pi-ta和 Pi-b基因在江苏、云南、吉林等地区菌株仍表现较高水平的抗性[ 23, 24, 25, 26]。本研究分子检测结果显示 Pi-ta和 Pi-b在品系中的分布频率存在明显差异, Pi-b的分布频率明显高于 Pi-ta。
分析含 Pi-ta但不含 Pi-b以及不含 Pi-ta只含有 Pi-b这2种基因组合的抗性表现, 发现只含 Pi-b基因的品系, 其感病率明显高于只含 Pi-ta基因品系的感病率, 且稻瘟病菌表现高度的小种专化性。在未来水稻抗稻瘟病育种中, 应当注重改良现有育成品种的抗性基因组成, 使各位点的抗稻瘟病基因尽可能聚合到同一品种中, 选育出抗性优良的水稻新品种。
由于多重PCR实验设计较单一PCR要复杂得多, 技术难度大, 因而在建立多重PCR反应体系时, 必须对其中的主要成分和反应条件进行繁琐的优化[ 27]。根据实践经验, 我们认为采用下面步骤可能会提高构建多重PCR体系的效率。第一, 选择扩增产物差异较大的基因标记来组合多重PCR体系, 这是决定琼脂糖凝胶电泳能否容易、准确分辨结果的保证。第二, 在多重PCR反应中, 退火温度是一个最重要的需要调整的因素。通常依据引物的解链温度选择退火温度, 但有的时候其结果和预期并不一致。最简单的方法就是对每个基因标记的引物采用梯度PCR程序进行单一基因扩增, 确定能够满足每个目标基因扩增的多重PCR的退火温度; 而对没有相同退火温度的多重PCR组建体系, 可以考虑采用touch down扩增程序。第三, 在多重PCR组建体系中对扩增条带较弱的基因增加其引物用量, 而较强的减少用量, 通过不断调整引物的相对用量, 最终达到每个基因标记都能扩增出足够数量的PCR产物。虽然选择基因标记的引物是决定多重PCR成败最关键的因素, 但DNA模板、化学试剂(PCR buffer、Mg2+、 Taq聚合酶和dNTP等)和仪器(PCR仪和电泳仪)等因素也会影响多重PCR的结果。建议初期试用不同公司的试剂和不同型号的PCR仪, 确定多重PCR体系和程序; 当体系和程序基本确定后, 最好固定使用仪器和试剂。建议对每条引物稀释后分装使用, 而不要将多条引物混装保存和使用; 尽量避免反复冻融dNTP等试剂, 使用期间最好保存在4℃。与单个基因标记PCR相比, 多重PCR检测试剂成本明显降低、时间显著缩短。将本研究创建的稻瘟病抗病相关基因多重PCR体系与田间抗性鉴定相结合, 开展水稻抗稻瘟病育种, 必将有效提高水稻抗病性改良的效率。
构建了涉及水稻抗稻瘟病基因 Pi-ta和 Pi-b及其感病基因 pi-ta与 pi-b的分子标记多重PCR体系, 其鉴定结果稳定可靠, 实验成本低廉, 可用于水稻育种亲本评价和杂交后代抗病基因聚合的分子标记辅助选择。利用2套体系分别检测的336份水稻后备品系中, 有112个品系同时携带抗性基因 Pi-ta和 Pi-b; 有7个品系只含有单一抗性基因 Pi-ta; 有207个品系只含有单一抗性基因 Pi-b; 有10个品系同时携带感病基因 pi-ta和 pi-b。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|