第一作者联系方式: E-mail:humolon@163.com, Tel: 025-84390375
在对油菜抗咪唑啉酮类除草剂基因 BnALS1R克隆与功能验证基础上, 为比较抗性基因编码的乙酰乳酸合酶突变体S638N酶学特性及其对ALS类除草剂抗性与野生型的差异, 构建基因原核表达载体, 在大肠杆菌中表达S638N和野生型的重组融合蛋白。SDS-PAGE和Western blot分析表明, S638N和野生型均能表达出约74 kD的特异性重组蛋白。纯化目的蛋白, 在不同温度和pH条件下, 测定S638N和野生型的酶活性。结果显示, 温度和pH对突变酶活性的影响与野生型相同, 表现为先升后降, 在37℃、pH 7.0条件下催化活性均最高。同时, 该突变酶的酶学动力学参数 Km和 Vmax与野生型没有显著差异, 其对3个辅助因子的响应曲线也与野生型类似, 缺少其中任何一个辅助因子均使突变酶S638N基本都没有活性。然而, 突变酶S638N对IMI类除草剂抗性显著高于野生型, 而对Su类除草剂敏感性和野生型相同。因此, 突变酶S638N具有对IMI类除草剂的专一抗性, 但未改变酶学反应特征。
Acetolactate synthase (ALS) catalyses the first step in the synthesis of the branched-chain amino acids and is the target of several classes of herbicides. A BnALS1R gene from herbicide-resistant mutant line M9 in B. napus, was previously isolated and demonstrated to be resistant to the imidazolinone (IMI) herbicides. This research was to reveal the differences of enzymatic characteristics and its resistance to ALS inhibitor herbicides between the mutant S638N and the wild-type enzyme. The BnALS1Rgene was constructed and expressed in Escherichia coli along with the wild-type. The target recombinant proteins with the predicted molecular weight (74 kD) were successively expressed in Escherichia coliand purified by SDS-PAGE. The enzymatic activity of the purified S638N and wild-type was then measured in enzyme reaction systems under different temperatures and pH values. Results showed that the S638N resembled the wild-type in their enzymatic activity, showing maximum activity at 37°C and pH 7.0, and no significant difference in the Km and Vmax between the S638N and wild-type. The activation of the S638N by cofactors (FAD, Mg2+ and thiamine diphosphate) was examined and generated similar results to that of the wild-type. The mutant enzyme was inactive when one of three cofactors was omitted. However, the S638N was more resistant to IMI herbicides than the wild-type in contrast to Su herbicides that inhibited the S638N as well as the wild-type. Therefore, the S638N has resistance specific to IMI herbicides with unalteration of the enzymatic reaction characteristics.
乙酰乳酸合酶(acetolactate synthase, ALS; EC4.1.3.18), 也叫乙酰羟基酸合酶(acetohydroxyacid synthase, AHAS; EC2.2.1.6), 是植物和微生物3种支链氨基酸生物合成过程中的关键酶[1]。如果此酶的活力受到抑制或者丧失, 会导致植物缬氨酸、亮氨酸和异亮氨酸合成受阻, 影响蛋白质合成, 最终导致植物生长受阻、直至死亡[2], 因此以ALS为作用靶标开发了多种类型的高效除草剂[3], 如咪唑啉酮类(imidazolinones, IMI)、磺酰脲类(sulfonylureas, Su)。这些除草剂统称为ALS抑制剂类除草剂或ALS类除草剂, 具有生物活性高、杀草谱广的优点, 由于其作用靶标ALS酶不涉及人和动物, 因此该类除草剂对人和动物具有很高的安全性。但ALS类除草剂属于选择性除草剂, 在杀草的同时, 也会阻碍非选择性作物的氨基酸合成, 从而导致作物生长严重受损甚至死亡, 致使其使用范围受到限制。创制携带ALS突变体的抗性作物可以克服这一难题, 有助于油菜抗除草剂品种的选育。
ALS属于依赖硫胺素焦磷酸(thiamin diphosphate, ThDP)酶的家族, 在植物、真菌以及藻类等体内均已相继被发现[4]。该酶一般由催化亚基和调节亚基构成, 催化亚基分子量约为65 kD, 调节亚基在9~54 kD之间。对于实现ALS的全酶活性, 除了这2个亚基之外, 还依赖于3个必不可少的辅助因子(cofactor)— — ThDP、二价金属离子和黄素腺嘌呤二核苷酸(flavin adenine dinucletide, FAD)[5]。研究发现, ThDP直接参与ALS催化的生化反应, 形成与ALS结合的反应中间体— — 羟乙基-ThDP; 与其他依赖ThDP的酶类似, ALS也需要金属离子诸如Mg2+的辅助; 而FAD对ALS活性所起的具体作用尚不清楚, 因为该辅助因子并不直接参与ALS催化的生化反应[6]。随着研究的不断深入, 人们发现某些特定氨基酸残基突变能引起ALS对抑制剂类除草剂产生抗性[7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17], 其中常见易发生变异的氨基酸残基是Ala122、Pro197、Ala205、Trp574和Ser653 (参照拟南芥ALS位置)。而且, 不同位点的氨基酸残基变异产生不同类型的ALS抑制剂类除草剂抗性。如Ala122和Ser653位点突变仅对IMI产生抗性, 对其他类型的ALS抑制剂不会产生交互抗性; 而Trp574位点变异对IMI和Su均产生抗性。这种突变酶序列差异与除草剂分子之间的相互作用机制相当复杂, 至今还未研究清楚[18]。有些研究还表明, 氨基酸变异引起的ALS突变酶对抑制剂类除草剂产生抗性的同时, 有些ALS突变酶的酶学特性也有所改变。如Ott等[19]报道拟南芥的ALS突变酶M124E催化活性降低了11倍; Bersonasconi等[20]观察到苍耳(cocklebur)的突变酶W552L催化活性降低了5倍; Subramanian等[21]发现棉花的ALS突变酶米氏常数Km相对于野生型增加了4~9倍。另外, Chang等[22]推测ALS突变酶可能会改变对3个辅助因子的亲和性, 特别是对位于除草剂与酶作用中心的辅助因子ThDP, 但至今该推测还未被证实。
目前, 文献报道的油菜抗除草剂ALS突变酶涉及3个氨基酸残基变异, 即Pro197、Trp574和Ser653。BnALS3的Pro197突变产生对Su类除草剂抗性[15]; BnALS1的Ser653突变产生对IMI类除草剂抗性[12]; BnALS3的Trp574突变产生对IMI和Su类除草剂抗性[11]。这些研究主要关注于ALS基因突变位点及其对除草剂表达调控等方面, 至今还没有涉及ALS突变酶的酶学特性及其与除草剂作用机制的研究。同时, 由于植物体内天然的ALS蛋白丰度较低、又极不稳定造成分离纯化困难, 阻碍了对酶学特性的深入研究[23, 24]。前期笔者从抗咪唑啉酮油菜M9中克隆到抗性基因BnALS1R, 序列比对发现, 其编码的油菜ALS1氨基酸序列的第638位丝氨酸(Ser)残基被天冬酰胺酸(Asp)替代(以油菜ALS1氨基酸位置计算)[12], 表达抗性基因的拟南芥转基因植株具备IMI抗性(另文发表), 将抗性基因BnALS1R编码的突变酶命名为S638N。本研究以此为基础, 从M9中克隆到S638N的cDNA序列, 在大肠杆菌原核表达系统中获得S638N的重组蛋白产物, 并应用酶学方法进一步对其酶学特性以及与ALS类除草剂的相互作用机制和野生型进行比较研究, 以期为携带ALS突变酶S638N的抗性油菜M9育种利用奠定理论基础。
油菜抗咪唑啉酮类除草剂突变体M9为浦惠明等[25]在油菜和大豆多年轮作的试验田中发现的天然突变体株系; 敏感性对照材料宁油16为江苏省农业科学院经济作物研究所选育的常规油菜(Brassica napus L.)品种。苗期取油菜嫩叶于液氮中速冻, 保存于-80℃冰箱备用。
咪唑啉酮类除草剂为山东先达化工有限公司生产的5.0%“ 豆施乐” 水剂, 有效成分为咪唑乙烟酸。磺酰脲类除草剂为江苏省激素研究所股份有限公司生产的10%苯磺隆可湿性粉剂。
大肠杆菌E. coliDH5α 由本实验室保存; 限制性内切酶NdeI和EcoR I为NEB (New England Biolabs)公司产品; DNA分子量标准、DNA回收试剂盒、质粒提取试剂盒均购自北京TIANGEN生化科技有限公司; 高保真性DNA聚合酶KOD-Plus及PCR试剂购自东洋纺(上海)生物科技有限公司; PCR产物平末端加A试剂盒和IPTG均购自TaKaRa宝生物工程有限公司(中国大连); 克隆载体pEASY-T1购自北京TransGen生物技术有限公司; 表达载体pCold-II、表达菌株BL21(DE3)、His-Tag蛋白纯化试剂盒均购自南京钟鼎生物技术有限公司; 引物由上海Invitrogen生命技术有限公司合成; ThDP和FAD为Sigma产品; 乙酰甲基甲醇(acetoin)、丙酮酸钠(sodiumpyruvate)为Fluka产品; 其余试剂为国产分析纯。
按RNA试剂盒说明书提取M9和宁油16叶片中总RNA, 用1% (v/w)琼脂糖电泳和分光光度法检测总RNA纯度。参照cDNA合成试剂盒说明书合成cDNA。参照胡茂龙等[12]克隆的油菜ALS1基因序列(登录号GU192448), 利用Primer Premier 5.0设计特异引物ALS1-F: 5° -GAAATTCCATATGGCGGCGGC AACATCGTCTTCT-3° 和ALS1-R: 5° -CGCACTAGT GATCACCAGCTTCATCTCTC-3° (下画线处为酶切位点)。以反转录合成的cDNA为模板, PCR扩增获得抗咪唑啉酮油菜M9中ALS突变酶S638N基因及宁油16中未突变的ALS1基因。PCR体系含模板1 μ L、10× 酶反应缓冲液2 μ L、MgSO4 (25 mmol L-1) 1.2 μ L、dNTP (2 mmol L-1) 2 μ L、引物(10 mmol L-1)各2 μ L、KOD-plus Taq酶(1 U L-1) 0.8 μ L, 加水至20 μ L。反应程序为94℃预变性5 min, 94℃变性30 s, 60℃退火30 s, 72℃延伸2.5 min, 共35个循环。按试剂盒说明书进行PCR产物平末端加A, 经1.2% (v/w)琼脂糖凝胶电泳分离后, 用DNA凝胶回收试剂盒将目的片段回收纯化, 连接于克隆载体pEASY-T1上, 热激转化DH5α 。通过蓝白斑筛选和菌落PCR鉴定, 将阳性克隆送至南京金斯瑞生物科技有限公司测序。
提取经测序正确的重组质粒, 利用Nde I和EcoR I双酶切, 回收目的片段连接于同样经双酶切的pCold II-2质粒上, 热激转化至大肠杆菌DH5α 。选取重组质粒PCR及双酶切鉴定均为阳性的菌液送公司测序, 将测序正确的ALS1突变酶S638N重组质粒命名为pCold-II-S638N, 野生型命名为pCold- II-Wt。
参照胡茂龙等[26]方法进行融合重组蛋白的诱导表达与Western blot鉴定。大量培养经SDS-PAGE电泳检测与Western blot鉴定后含有2个表达载体的BL21 (DE3)菌株, 按His-Tag蛋白纯化试剂盒说明书纯化目的蛋白。Bradford法测定蛋白浓度[27], 最后溶解于Tris-HCl (pH 8.0)分装成1 mg mL-1, 置-80℃冰箱备用。
参照Singh等[28]方法测定ALS酶活性。以丙酮酸钠为底物, 在波长530 nm处测定酶促反应产物乙酰乳酸转化产物3-羟基-2-丁酮(acetoin)的量, 计算ALS酶活性。以单位时间(h)内单位蛋白(mg)生成产物3-羟基-2-丁酮的含量定义为酶活力, 单位为μ mol mg-1 h-1。
对重组酶的酶学性质进行三方面研究: (1)温度和pH值对酶活性的影响。在pH 7.0条件下, 改变酶活性测定反应体系温度或保持37℃恒温, 改变酶活性测定反应体系pH值, 测定重组酶S638N和野生型的酶活性, 比较两者间的差异, 确定最适温度和pH值。(2)米氏常数Km和最大反应速度Vmax测定。配置不同浓度丙酮酸钠的反应液, 在最适温度与最适pH条件下进行酶促反应, 测定ALS酶活力, 计算不同底物浓度下反应初速度, 并绘制ALS酶动力学Lineweaver Burk曲线, 用双倒数法计算得到Km和Vmax。(3)辅助因子(ThDP、FAD、Mg2+)对酶活性的影响。在最适温度和pH值下, 使酶活性反应体系中2个辅助因子达到饱和, 改变第3个辅助因子浓度, 测定ALS酶活力, 比较重组酶S638N和野生型的差异。
按1.5节酶活性测定方法, 在最适温度和pH值下, 使酶活性反应体系中3个辅酶因子全部达到饱和, 同时在反应体系中添加不同浓度的除草剂IMI和Su, 测定ALS酶活力, 比较两类除草剂对突变酶S638N和野生型Wt抑制性差异。
所有处理的设3个重复, 采用Microsoft Excel 2010、SAS、Origin 8.5.1软件分析数据; 除草剂抑制性试验数据采用Seefeldt等[29]描述的Logistic曲线方程(1)进行非线性回归拟合。
y=C +(D - C)/[1+(x / I50)]b(1)
y表示除草剂处理时ALS酶活相对于对照未添加除草剂酶活的百分数(%), x表示在酶活性测定反应中的除草剂浓度, C和D分别表示Logistic曲线最低和最高处的相应酶活性, I50是除草剂半抑制浓度, 即除草剂抑制50%酶活性时所对应的除草剂浓度, b表示在半抑制浓度时渐进曲线的斜率。
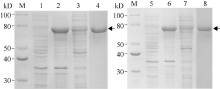
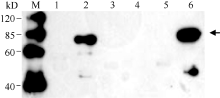
将经测序鉴定正确的重组质粒pCold-II-S638N和pCold-II-Wt分别转化到宿主菌BL21 (DE3)中, 从温度、IPTG (Isopropyl β -D-1-thiogalactopyranoside)浓度、诱导时间等方面对其可溶性表达条件进行筛选和优化, 最终确定ALS重组蛋白的表达条件为15℃, 以1 mmol L-1 IPTG诱导表达12 h。用12%凝胶的SDS-PAGE检测诱导表达情况, 野生型和突变体的ALS重组蛋白均表达出约74 kD的特异性条带(图1), Western blot鉴定结果与理论大小相符(图2)。表达蛋白主要以包涵体的形式存在, 包涵体经体外溶解、复性后, 利用His-Tag蛋白纯化试剂盒纯化表达的融合蛋白, SDS-PAGE电泳分析表明在74 kD处出现明显的特异性条带(图1), 表明重组融合蛋白得到较好的纯化, 分装后进行后续试验。
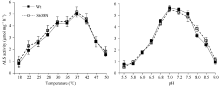
为确定Ser638氨基酸位点突变是否会影响到ALS1对温度的响应, 比较了不同温度条件下突变酶S638N和野生型Wt酶活性的变化差异。由图3可以看出, 在18~37℃范围内, 突变酶S638N和Wt酶活性均随温度的升高而增加。其中, 在18~30℃温度之间, 酶活性增加较快; 在30~37℃温度之间, 酶活性增速放缓。37℃时突变酶S638N和Wt酶活性均达到最大值, 温度进一步高于37℃时, 2个酶活性都随着温度的升高而降低。纵观整个酶活力随温度变化的过程, 突变酶S638N和Wt变化趋势基本一致。因此, 认为Ser638氨基酸位点的突变并没有改变油菜ALS1对温度的响应。
配置不同pH值的酶反应缓冲液进行酶活性测定, 以检测pH值对突变酶S638N酶活性的影响, 确定突变酶S638N酶反应的最适pH值, 比较其与Wt的差异。图3中, 在pH值5.5~9.0之间, 突变酶S638N均具有ALS1活性, 且其活性随pH值变化的趋势与Wt相同, 都表现为先升后降, 在pH 7.0~7.5的范围内, 活性变化不大, 此时活性较高, 表明突变酶S638N酶反应的最适pH值为7.0~7.5之间, 与Wt相同。因此, 油菜ALS1的Ser638氨基酸位点的变异并没有改变ALS1对pH的响应。
在突变酶S638N最佳酶反应温度和pH值条件下, 以不同浓度的底物进行酶促反应, 根据测定结果绘制底物饱和曲线, 计算获得突变酶S638N的酶动力学参数Km=6.64 mmol L-1, 最大反应速度Vmax=5.77 μ mol mg-1 h-1 (表1)。从表1还可以看出, 突变酶S638N与Wt的2个酶动力学参数基本一致。
| 表1 ALS突变酶S638N与Wt酶的Km和Vmax比较 Table 1 Comparison of ALS Km and Vmax between the mutant S638N and Wt |
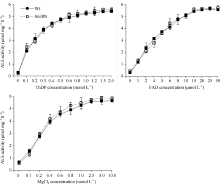
ALS的酶促反应需要3个辅助因子(ThDP、FAD、Mg2+), 通过改变其中一个辅助因子浓度进行酶活性测定, 比较突变酶S638N与野生型Wt对辅助因子的响应。结果发现, 突变酶S638N对3个辅助因子的饱和响应曲线与野生型相同, 缺少任何一个辅助因子S638N基本都没有活性(图4)。随着辅助因子浓度逐渐增加, S638N活性升高, 最终达到饱和。
由于突变酶S638N的供体油菜M9在表型上对IMI类除草剂具有特异抗性, 而对Su类除草剂表现敏感, 所以选用这2类ALS除草剂对体外表达的重组酶S638N和Wt进行酶活抑制性试验, 比较S638N和Wt对除草剂的抗性差异, 结果如图5所示。当把IMI类除草剂“ 豆施乐” 添加到酶促反应中, 突变酶S638N与Wt对IMI的抗性存在显著差异, 随IMI浓度增加二者下降的趋势不同。如当除草剂浓度为10 μ mol L-1时, S638N酶活性为对照(未用除草剂处理)的65%左右, Wt活性是对照的32%左右; 当除草剂浓度达到100 μ mol L-1时, S638N酶活性是对照的50%左右, 而此时Wt活性下降到14%左右。从Logistic曲线方程参数也可以看出(表2), S638N的除草剂半抑制浓度(I50=14.1± 4.9 μ mol L-1)、全抑制浓度(C=22.9± 5.6 μ mol L-1)都显著高于Wt (I50=1.5± 0.3 μ mol L-1、C=5.8± 2.9 μ mol L-1), 即在相同处理浓度下, S638N对IMI的抗性显著高于Wt。当把除草剂换为Su类时, 突变酶S638N与Wt对除草剂的抗性无任何差异(图5), 随Su浓度增加二者下降的趋势基本相同, 即突变酶S638N与Wt对Su类除草剂都无抗性, Logistic曲线方程的4个参数也无任何差异(表2)。
 | 图5 IMI、Su对突变酶S638N、Wt酶活性的体外抑制响应曲线Fig. 5 Inhibition curve of ALS activityin vitro in mutant S638N and Wt affected by the IMI and Su |
| 表2 突变酶S638N和Wt体外抑制浓度响应的Logistic曲线方程参数 Table 2 Logistic response curve estimates for AHAS concentration from the mutant S638N and Wt |
ALS作为世界范围内广泛应用的高效除草剂作用靶标, 其编码的基因在许多植物中得到了分离克隆[7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17]。然而, ALS酶学研究进展缓慢, 主要因分离纯化天然ALS蛋白比较困难[23, 24]。原核表达系统具有产量高、易操作、稳定性好、经济实惠等优点, 已被广泛应用于植物基因的蛋白表达研究[30, 31]。已有文献报道, 模式植物拟南芥和烟草的ALS基因能在大肠杆菌中表达, 并纯化获得了具有活性的蛋白[22, 23, 24]。本研究将油菜ALS的野生型和突变酶S638N在大肠杆菌原核表达系统中重组表达, 并分离纯化获得具有活性的重组融合蛋白, 为后续的酶学特性和除草剂抑制作用研究奠定了基础。
温度和pH是影响酶催化活性的2个关键因子。本研究结果显示, 在不同温度和pH下, 抗性油菜M9中突变酶S638N与宁油16中野生型酶的催化活性变化趋势基本一致, 并且在37℃、pH 7.0时, 二者酶活性都达到最高值, 暗示Ser638氨基酸位点的变异并没有改变M9中ALS1对温度和pH值的响应。在模式植物拟南芥中, Lee等[23]利用定点突变技术将相同位置的氨基酸突变成4种分子量大小不同的氨基酸, 在大肠杆菌中得到了4个ALS重组突变酶。酶学研究也发现, 4个ALS突变酶对温度和pH值的响应与野生型的相同, 推测可能原因是油菜和拟南芥同属十字花科, ALS酶的氨基酸序列同源性较高, 空间结构相似。Km和Vmax是反映酶动力学性质的重要特征性参数, 反应了酶与底物之间结合的牢固程度, 对了解酶的催化活性及生理功能有重要意义。为比较突变酶S638N和野生型的酶动力学性质, 分别测定了二者的Km和Vmax。结果表明, 突变酶S638N和野生型的Km、Vmax没有差异。这与Chang等[24]在拟南芥中研究的3个ALS突变酶(A122V、W574S、S653N)结果相同, 同时Chong等[32]在烟草中也发现类似现象。另外, 本研究还发现油菜突变酶S638N对3个辅助因子的饱和响应曲线与野生型相同, 这也与Chang等[24]和Chong等[32]分别在拟南芥和烟草中的研究相同。因此, 笔者认为油菜ALS氨基酸位点变异不会改变S638N突变酶的酶学动力学性质, 其在抗性作物体内能发挥正常的催化活性和生理功能, 也许是抗性油菜M9的产量性状、经济性状、品质性状与普通油菜表现相同的原因。
氨基酸残基Ser653位点突变引起植物在表型上对IMI类除草剂产生专一抗性, 已在水稻、玉米、小麦、大麦等作物中有文献报道[2, 7, 17]。前期研究中, 笔者从抗咪唑啉酮油菜M9中克隆了具有功能的ALS基因BnALS1~BnALS3, 序列比对发现, M9抗性是由于BnALS1蛋白序列的第638位丝氨酸(AGT)突变成了天冬酰胺酸(AAT)所致, 参照模式植物拟南芥ALS位置, 该位点同样属于Ser653位点变异[12]。体外表达的突变酶S638N与除草剂分子相互作用研究结果表明, 突变酶S638N对IMI类除草剂具有专一抗性, 而对Su类除草剂表现敏感, 这与抗性油菜M9在表型上鉴定结果一致, 进一步解释了M9产生抗性的分子基础。IMI类除草剂灭草喹(Imazaquin)与拟南芥ALS复合物的晶体结构研究表明, 该除草剂结合在拟南芥ALS催化位点的活性空腔里, 当Ser653被分子结构较大的氨基酸残基Asn、Thr替代后, 阻塞了灭草喹上的喹啉环与酶的连接, 从而使植物产生对IMI类除草剂的抗性[3]。
以ALS为作用靶标的除草剂具有高效、低毒、杀草谱广和对环境友好等众多优点, 深受农户喜爱。然而, 由于缺乏抗性基因资源, 我国油菜生产至今尚不能应用此类除草剂。高建芹等[33]利用自然突变的抗性单株育成了抗性稳定株系M9[33], 笔者从M9中克隆到抗性基因BnALS1R[12], 并开发出3条标记引物可应用于抗性基因的检测[34]。本研究获得了抗性基因的重组蛋白产物S638N, 将其酶学特性及其与除草剂的相互作用机制和野生型比较发现, S638N的酶学特性没有任何变化, 但表现对IMI类除草剂的专一抗性。以上这些研究, 不仅阐明了抗除草剂油菜M9抗性产生的分子机制, 而且为我国抗ALS类除草剂油菜品种的培育提供了抗性基因资源和基因功能标记。
利用原核表达系统在大肠杆菌中表达了油菜ALS突变酶S638N。S638N对温度和pH的响应与野生型相同, 表现为先升后降, 在37℃、pH 7.0条件下催化活性均最高。该突变酶的酶学动力学性质及其对3个辅助因子的响应曲线与野生型相同, 缺少其中任何一个辅助因子S638N基本都没有活性, 但却具有对IMI类除草剂的专一抗性。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|