拟南芥G蛋白复合体(异源三聚体包括α、β、γ亚基)参与植物多个信号转导途径, G蛋白复合体通过膜上的G蛋白偶联受体(GPCR)接受胞外信号后通过3个亚基将信号传递给下游效应器。目前, 有关植物G蛋白复合体的效应器及其信号传递途径的报道较少, 寻找新的G蛋白的效应器有助于阐明G蛋白复合体相关的信号传导途径。本研究以拟南芥G蛋白α亚基GPA1为诱饵蛋白, 利用泛素分离系统筛选拟南芥cDNA文库, 获得一个与GPA1互作的铜离子结合蛋白AtBCB。荧光双分子杂交(BiFC)试验证明, GPA1与AtBCB的互作发生在细胞膜上。基因表达特性分析结果显示,
Heterotrimeric G protein, including three subunits of α, β, and γ, is involved in a lot of signaling pathways in plants. It receives extracellular signals via G-protein coupled receptor (GPCR) and transmits them to the downstream effectors by the three subunits. Till now, the downstream effectors and signaling pathway related to G-protein complexes have been rarely reported. Furthermore, identifying more novel G protein effectors would be helpful to elucidate signaling pathway associated with the G protein complex. In order to find some novel effectors, G protein α subunit (GPA1) was used as a biat to screen interaction protein in
G蛋白复合体是一个异源三聚体, 由α、β和γ亚基组成。目前, 拟南芥中发现一个α亚基GPA1, 一个β亚基AGB1, 3个γ亚基AGG1、AGG2和AGG3[1]。G蛋白信号传导途径广泛存在于动植物体内, 主要由G蛋白偶联受体(G-protein coupled receptor, GPCR)接受外界信号, 再将信号通过α、β或者βγ二聚体传递给下游的效应器, 最终引起细胞产生一系列生理生化的应答反应。研究表明, G蛋白参与植物对光[2,3,4]、激素[5,6]和糖[7]等信号的传导, 也参与对离子通道的调控[1,5,8]以及对病原菌的防卫反应[9]等过程。寻找G蛋白的互作蛋白, 对于发现新的G蛋白的效应器以及揭示G蛋白相关的信号途径具有重要意义。Lapik等[10]用酵母双杂交方法筛选出一个与G蛋白α亚基互作, 并参与调控种子萌发和早期幼苗发育的蛋白因子AtPirin。Assmann等[11]发现, GPCR受体蛋白GCR1与GPA1互作, 并调控ABA的信号传导过程。GPA1与磷脂酶D(PLD)的互作依赖于PLD蛋白中的DRY氨基酸序列的存在, 并依赖于二者的互作调节彼此的活化状态[12]。利用反向Ras拯救系统[13,14], 苑国良[15]发现GPA1与一个质膜定位的蛋白AtXB31互作, 并可能参与Xcc8004病原菌的信号调控过程。Kaufman等[16]研究发现, GPA1可以和拟南芥的预苯酸水解酶PD1互作并激活PD1, 从而激活其自身苯丙氨酸的合成途径, 使拟南芥在低剂量UV下免受损伤。Friedman等[17]通过遗传学方法发现, ARD1与G蛋白β亚基AGB1互作, 并参与下胚轴的发育过程。Tsugama等[18]发现AGB1与蛋白磷酸酶PP2C52互作。目前, 有关植物G蛋白复合体的效应器及其信号传递途径的报道较少。同时, G蛋白复合体成员参与植物对金属离子胁迫的应答还未见报道。
G蛋白的3个亚基中, G蛋白α亚基不仅可以和膜上接受信号的GPCR类蛋白结合, 并将信号传递给下游的效应器, 同时也具有GTP的水解酶活性, 影响β和γ亚基的活性, 因此, 在G蛋白相关信号途径中, G蛋白α亚基发挥重要的作用。本实验以拟南芥G蛋白α亚基GPA1为诱饵, 通过泛素分离系统[19]筛选拟南芥cDNA文库, 获得一个GPA1的互作蛋白-铜离子结合蛋白AtBCB, 对GPA1参与植物对铝胁迫的应答反应机制进行初步分析, 为阐明G蛋白途径在调控植物胁迫应答过程中的作用模式提供了新的线索。
1.1.1 植物材料 野生型拟南芥(Columbia生态型, WT)由本实验室保存, 拟南芥G蛋白α亚基GPA1 (AT2G26300)突变体 gpa1-4 和AtBCB (AT5G 20230)的突变体 bcb 购于 Arabidopsis Biological Resource Center (ABRC)。
1.1.2 菌株和载体 酵母菌株NMY51、pDHB1质粒和pPR3N质粒购于Dualsystems Biotech公司, GFP、YFPN和YFPC质粒以及拟南芥cDNA文库由本实验室保存。
1.1.3 试验试剂 限制性内切酶和T4 DNA连接酶购于Promega公司; X-α-gal购于Sigma公司; 其他化学药品为国产分析纯试剂。引物合成和测序由北京三博远志生物技术有限责任公司完成。
通过PCR方法扩增 GPA1 的全长CDS序列, 并将其克隆到诱饵载体pDHB1。泛素分离系统筛选文库的方法及酵母转化所用培养基的配制均按Dualsystems Biotech公司hunter系统操作说明书(http://www.dualsystems.com/, P01601-P01629)。先将诱饵载体pDHB1-GPA1-Cub单独转入NMY51酵母细胞, 再将cDNA文库质粒转入含诱饵载体pDHB1-GPA1-Cub的酵母感受态细胞, 将转化产物涂于选择性平板SD/-Trp-Leu-His-Ade (含1.5 mmol L-1 3-AT)。挑取选择性平板上的单克隆重新点于含X-α-gal的选择性平板, 观察报告基因 LacZ 的表达活性。提取3个报告基因( His+、 Ade+和 LacZ+)均为阳性的酵母单克隆质粒, 转入大肠杆菌TOP10 (TIANGEN, 北京), 选取阳性克隆菌送至三博远志生物技术公司测序, 并对结果进行Blast比对分析。
对阳性克隆进行测序和Blast比对分析, 获得一个GPA1的互作蛋白AtBCB。将 AtBCB 的全长CDS序列克隆到捕获载体pPR3N。将诱饵载体pDHB1- GPA1-Cub和捕获载体pPR3N-NubG-BCB共同转化到NMY51酵母感受态细胞中, 分别涂于SD/-Trp-Leu和SD/-Trp-Leu-His-Ade (含1.5 mmol L-1 3-AT)选择性平板, 30℃培养3~5 d。从SD/-Trp-Leu-His-Ade选择性平板上挑取3个单克隆, 分别培养至OD600等于0.6~0.8后, 取1 μL点于含40 mg L-1的X-α-gal选择性平板SD/-Trp- Leu-His-Ade (含1.5 mmol L-1 3-AT), 观察报告基 因 LacZ 的表达活性。同时设置对应的阴性对照 试验。
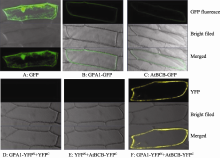
将GPA1和AtBCB与GFP融合表达, 构建35S::GPA1-GFP和35S::BCB-GFP亚细胞定位载体。将GPA1与YFPN, AtBCB与YFPC融合表达, 构建成35S::GPA1-YFPN和35S::BCB-YFPC双分子荧光互补表达载体。采用基因枪轰击法[20]将35S::GFP对照质粒、35S::GPA1-GFP和35S::BCB-GFP单独转入洋葱表皮细胞; 将35S::GPA1-YFPN和35S::BCB-YFPC及阴性对照组合分别共同转化洋葱表皮细胞。25℃黑暗培养12~16 h后于Zeiss LSM700激光共聚焦显微镜下观察。每个转化重复3次。
将订购的 gpa1-4 和 bcb 突变体种子分别用75%的酒精消毒处理5 min, 用0.5%的次氯酸钠灭菌处理10 min, 再用高压灭菌的蒸馏水洗涤3次。将无菌的种子在4℃, 黑暗条件下春化4 d。用牙签将春化后的种子点播在MS固体培养基上, 在培养室培养(16 h光照/8 h黑暗; 22℃) 10 d后, 将突变体的苗子移栽到装有营养土的花盆中培养至成熟。移栽14 d后, 取单株的叶片, 按照植物基因组DNA提取试剂盒(TIANGEN, 北京)的操作说明提取DNA, 采用“三引物法”[21]进行纯合突变体的鉴定。利用T-DNA Primer Design (http://signal.salk.edu/tdnaprimers.2. html)设计突变体鉴定引物(表1)。取鉴定为纯合突变体的植株叶片, 按照植物总RNA提取试剂盒(TIANGEN, 北京)的操作说明书提取总RNA, 采用RT-PCR的方法分析 GPA1 和 AtBCB 在WT和突变体中的表达情况。
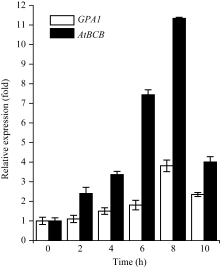
将WT的种子按照1.5的方法消毒处理和春化后, 按照改进的Murphy等[22]方法进行铝离子胁迫处理。将5层滤纸平铺于直径15 cm的培养皿中, 一层纱布平铺在五层滤纸上面, 向培养皿中加入适量1/6 MS液体培养基(MS培养基的无机盐成分和B5培养基的有机成分各稀释6倍), 待滤纸和纱布被营养液完全浸透后, 将春化后的种子用无菌牙签直接点播于纱布上, 将培养皿转移到培养室培养(16 h光照/8 h黑暗; 22℃)10 d, 将带有幼苗的纱布取出于含100 µmol L-1Al2(SO4)3的1/6 MS液体培养基(pH 4.0)中处理10 h, 每2 h取一次根部样品, 提取RNA, 并用相对定量PCR方法分析铝离子胁迫处理不同时间下 GPA1 和 AtBCB 在WT中的表达情况。
| 表1 引物序列 Table 1 Primer sequences |
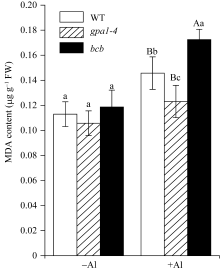
将WT、 gpa1-4 和 bcb 的种子按照1.6的方法培养10 d, 将带有幼苗的纱布取出在无菌蒸馏水中洗涤3次, 置含铝离子(终浓度为100 µmol L-1)和不含铝离子的1/6 MS液体培养基(pH 4.0)中处理8 h后, 测定根部丙二醛(MDA)含量[23]。
将WT、 gpa1-4 和 bcb 的种子按照1.7的方法用100 µmol L-1 Al2(SO4)3胁迫处理8 h, 提取根部总RNA。依照cDNA第一链合成试剂盒(TIANGEN, 北京)的操作说明, 取5 μg总RNA合成cDNA第一链, 将cDNA原液稀释5倍后作为模板待用。实时荧光定量PCR反应总体积为20 μL, 其中含2 μL稀释后的cDNA模板, 10 µmol L-1正反向引物(表1)各0.5 μL, 2×SuperReal PreMix Plus 10 μL和50×Rox Reference Dye (TIANGEN, 北京) 1 μL, 无RNase ddH2O 6 μL。将配制好的PCR反应管置ABI7500荧光定量PCR仪上, 按照95℃ 15 min, 95℃ 15 s, 60℃ 20 s, 72℃ 32 s, 共40个循环的程序进行PCR。分别检测在铝离子处理和不处理情况下, WT、 gpa1-4 和 bcb 材料中铝离子胁迫下相关基因的表达情况。
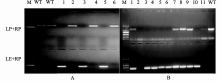
采用泛素分离系统筛选拟南芥cDNA文库, 获得一个阳性克隆, 测序和NCBI blast比对分析结果显示, 该基因为 AtBCB (AT5G20230)。用 GPA1 和 AtBCB 的基因全长进行酵母双杂互作验证(图1)发 现, GPA1-Cub和NubG-BCB以及相对应的对照分 别共转化NMY51酵母感受态细胞后, 均可在缺 陷型(SD/-Trp-Leu)培养基上正常生长, 只有GPA1-Cub和NubG-BCB可在含有X-α-gal的缺陷 型(SD/-Trp-Leu-His-Ade+1.5 mmol L-1 3-AT)培养 基上正常生长并显蓝, 其余的对照组均不能生长 (图1), 说明转入GPA1-Cub与NubG-BCB, 使3个报告基因(His+Ade+LacZ+)均正常表达, GPA1和AtBCB二者存在相互作用。有研究[24,25]表明, AtBCB含有一个铜离子结合结构域, 并受铝离子胁迫的诱导表达。
利用生物信息学数据库(SoftBerry, http://linux1.softberry.com/berry.phtml)预测GPA1和AtBCB在细胞中的定位显示, 二者均定位于细胞膜上(AtBCB score 6.3; GPA1 score 5.9)。在激光共聚焦显微镜下观察35S::GPA1-GFP和35S::BCB-GFP的亚细胞定位, 发现只转化对照质粒35S::GFP的细胞(图2-A), 绿色荧光分布于洋葱表皮细胞的细胞膜、细胞质及细胞核中。分别转化35S::GPA1-GFP (图2-B)和35S:: BCB-GFP (图2-C)融合蛋白的洋葱表皮细胞, 均只在细胞膜上观察到绿色荧光, 说明GPA1与AtBCB二者均分布于细胞膜上, 与软件预测和文献报道结果一致[26]。35S::GPA1-YFPN和35S::BCB-FPC共轰击洋葱表皮细胞后, 在细胞膜上观察到强烈的黄色荧光(图2-F), 说明GPA1与BCB在细胞膜上发生了相互作用, 这与GPA1和AtBCB都定位于细胞膜上相一致。
提取突变体单株叶片的DNA, 用“三引物法” 鉴定纯合突变体(图3-A, B)。其中, WT中只能用LP+RP扩增出一条特异条带; 纯合突变体只能用LB+RP扩增出一条特异条带; 杂合突变体用LP+RP和LB+RP可分别扩增出一条特异条带。鉴定结果显示, gpa1-4 中共有5株为纯合突变体; bcb 中共有3株为纯合突变体。对鉴定为纯合突变体的植株进行RT-PCR分析(图4), 结果显示, gpa1-4 和 bcb 纯合突变体中, GPA1 和 AtBCB 的转录受到抑制, 基因功能缺失。
对于WT, 随着铝处理时间的延长, GPA1 和 AtBCB 的表达量均上升, 在8 h达到最高值。在铝诱导下, AtBCB 的表达量在不同时间点均比 GPA1 高。 GPA1 和 AtBCB 参与了植物对铝的应答反应 (图5)。
植物在受到金属铝胁迫时, 根的生长会受到抑制[27], 根部细胞膜受损, 发生过氧化反应[28,29]。为了检测WT、 gpa1-4 和 bcb 在受到铝离子毒害时, 根部细胞的质膜受损程度, 对这三种材料分别进行100 µmol L-1 Al2(SO4)3胁迫处理后, 测定其根部丙二醛的含量, 丙二醛含越高证明植物细胞受损越严重。在铝处理下, WT、 gpa1-4 和 bcb 三种材料根部的丙二醛含量均比没有铝处理时高。在没有铝时, 三种材料间根部的丙二醛含量没有差异; 在铝处理下, gpa1-4 根部的丙二醛含量比WT低( P<0.05); bcb 根部丙二醛含量比WT高( P<0.01)(图6)。说明在100 µmol L-1 Al2(SO4)3处理下, 与WT相比, 突变体 gpa1-4 受铝离子的毒害作用小于WT, 而突变体 bcb 受铝离子的毒害作用大于WT。
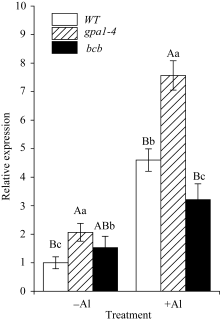
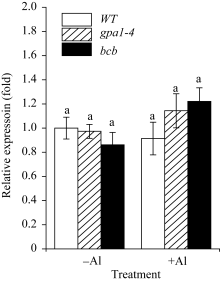
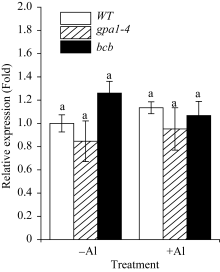
研究表明, 拟南芥苹果酸转运体蛋白ALMT1, 半类型ABC转运蛋白ALS1和ABC转运蛋白ALS3对拟南芥耐受铝离子毒害具有重要作用[30,31,32]。本研究用100 µmol L-1 Al2(SO4)3对WT、 gpa1-4 和 bcb 三种材料进行处理, 采用相对定量PCR法检测 ALMT1 、 ALS1 和 ALS3 的在3种拟南芥材料中表达的变化(图7、图8和图9)。结果显示, 在铝胁迫处理下, ALMT1 在3种材料中的表达量均有所提高, 其中, ALMT1 在 gpa1-4 中的表达量比WT高( P<0.01); 在 bcb 中的表达量比WT低( P<0.05)(图7)。在有铝和无铝情况下, ALS1 和 ALS3 的表达量在3种材料间均无显著差异(图8和图9)。
G蛋白复合体介导的细胞信号传导是真核生物中最保守的信号传导机制之一[33], 筛选拟南芥G蛋白α亚基GPA1的互作蛋白有助于更好地理解胞外到胞内的信号传导过程。利用经典的酵母双杂交系统(GAL4系统或者LexA系统)筛选文库, 通常筛选到的都是在细胞核中具有相互作用的蛋白, 对筛选膜蛋白的互作蛋白具有一定的局限性。本研究通过膜蛋白筛选系统-泛素分离系统筛选拟南芥cDNA文库并对阳性克隆进行验证, 发现GPA1与AtBCB存在相互作用(图1)。对该互作的BiFC验证确认二者在细胞膜上发生相互作用(图2-D), 这与二者的亚细胞定位结果一致(图2-B, C)。Van等[24]对AtBCB的氨基酸序列分析发现, 其N端的23个氨基酸包含大量疏水性残基, 可形成一个α螺旋结构; C端的20个疏水性残基可形成一个β折叠层结构; 铜离子结合区域(24~127氨基酸)为核心区域, 总共104个氨基酸, 该区域与拟南芥质体蓝素蛋白的铜离子结合区的氨基酸序列同源性较高, 其中与铜离子直接结合的氨基酸残基(His50、Cys115和His120)保持一致; 在核心区域与C端间为脯氨酸富集区(128~176氨基酸), 该区域仅含7种氨基酸, 除Asp174外, 均为非极性氨基酸。Adman等[34]对铜离子结合蛋白进行X晶体衍射分析, 发现这类蛋白可作为电子载体参与多种途径。GPA1可能是通过与AtBCB互作, 影响AtBCB的电子载体活性, 从而调控AtBCB相关的信号过程。
Richards等[25]研究发现, AtBCB 受铝离子的诱导表达, 且在铝处理下, 与氧化胁迫相关的 GST 、 PER 和 CAB 等基因的表达量也呈上升趋势。本研究中, 野生型拟南芥在经过100 µmol L-1 Al2(SO4)3处理后, GPA1 和 AtBCB 的表达量上升(图5), 说明GPA1和AtBCB均参与了植物对铝的应答过程。用铝处理 AtBCB 过表达植株, 其根部MDA的含量明显低于WT对照植株[26,29], 表明 AtBCB 参与了铝离子胁迫对植物体造成的氧化胁迫应答。Joo等[35]将WT和 gpa1-4 置700 ×10-9臭氧环境中3 h后, 转入正常生长环境培养24 h, 发现WT的叶片上出现明显的受臭氧氧化损伤的斑块, 而 gpa1-4 的叶片上未见明显的损伤, 这表明突变体 gpa1-4 在抵抗氧化胁迫方面比WT强。本研究中, WT、 gpa1-4 和 bcb 三种材料对100 µmol L-1Al2(SO4)3的耐受能力不同, gpa1-4 细胞膜受损程度较低, 其根部MDA含量比WT和 bcb 低; 而 bcb 根部的MDA含量最高, 细胞膜受损严重(图6), 说明在拟南芥对铝的耐受作用中, GPA1起负向作用; AtBCB起正向作用。
目前, 关于植物抵抗铝毒害的作用机制尚不清楚, 但有研究表明, 苹果酸转运体基因 ALMT1 的突变体在500 µmol L-1AlCl3处理下, 根部出现明显的生长抑制现象[30]; 转小麦 ALMT1 基因的大麦植株不论是在pH 4.0的营养液还是酸性土壤中, 对铝的耐受性均明显提高[36]。在本研究中, 用100 µmol L-1 Al2(SO4)3处理WT、 gpa1-4 和 bcb , 3种材料中 ALMT1 的表达水平具有显著差异(图7)。在 gpa1-4 中, 由于 ALMT1 的表达量较高, ALMT1可转运更多的苹果酸螯合铝离子, 降低铝对植物的毒害, 从而使 gpa1-4 受铝毒害作用小, 根部细胞膜的过氧化损伤程度较小, 丙二醛含量较低; 与此相反, bcb 中 ALMT1 的表达量在3种材料中较低, 受铝毒害作用较大, 根部丙二醛的含量较高(图6), GPA1和AtBCB参与拟南芥对铝的应答反应, 可能是通过间接地调控 ALMT1 的转录来发挥作用。Larsen等[32,37]发现, 突变体 als3 和 als1 在25 µmol L-1 AlCl3处理下, 根的生长均受抑制, 但根部铝的积累总量无明显差异。在 als3 中铝主要积累在根尖; 在WT中铝从根尖到根成熟区都有积累[31]。本研究中, 有铝或无铝情况下, ALS1和ALS3在WT、 gpa1-4 和 bcb 三者中的表达量均无明显差异(图8和图9), 这表明GPA1和AtBCB不是通过影响铝在植物体内的再分布来应答铝的胁迫。
此外, 通常都是将植物置酸性(pH 4.0)环境下来研究植物对铝胁迫的耐受性, Iuchi等[38]发现, 拟南芥中对酸性环境的应答有关键作用的转录因子STOP1也参与植物对铝的应答过程, 并调控 ALMT1 的转录水平。本研究中, 在无铝处理时, ALMT1 在3种材料中的表达也有差异(图7), 推测可能是受酸性(pH 4.0)培养环境的影响。Van等[24]发现, 将拟南芥黑暗处理48 h后, AtBCB的表达量显著升高。Xia等[39]在水稻中已经发现了一个铝的转运体基因 Nrat1 。GPA1和AtBCB的互作是否影响植物对酸性环境的应答和光信号的传递, 以及拟南芥中是否存在铝的转运体尚有待进一步研究。
GPA1与AtBCB定位于细胞膜上, 并在细胞膜上发生直接的相互作用。植物对铝胁迫的耐受作用中, GPA1起负向作用, AtBCB起正向作用。对铝胁迫应答有重要作用的基因 AtALMT1 , 其转录受GPA1负调控; 受AtBCB正调控。植物通过细胞膜上的G蛋白α亚基GAP1和铜离子结合蛋白AtBCB的相互作用影响了下游基因苹果酸转运体基因 AtALMT1 的表达, 调控植物对铝胁迫的响应。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|