农作物在生长过程中会受到多种环境因素的胁迫, 其中干旱和盐胁迫是最常遇到的胁迫类型[1]。干旱、高盐会影响植物的各种生理生化过程, 使其器官组织加速衰老, 最终导致植物的死亡[2]。与此同时, 植物会利用体内建立的各种响应机制来调节自身的各种生理生化过程, 从而防御和适应逆境胁迫[3]。已有大量研究报道, 转录因子(transcription factor, TF)是植物响应逆境胁迫的重要调控因子[4]。目前, 植物中已经鉴定的转录因子主要包括MYB、bZIP、AP2/ERF、bHLH、NAC和WRKY。转录因子可以与真核基因的特定顺式元件发生特异性结合来调控基因的表达, 最终导致下游基因的激活或者抑制[5-6]。bHLH家族转录因子含有众多成员, 参与植物抵御干旱、高盐等非生物胁迫。bHLH转录因子在植物中高度保守, 由大约60个氨基酸组成, 其保守结构域由近40个氨基酸组成的C末端HLH结构域, 参与同源或异源二聚体的形成; 由13~17个氨基酸组成的N端碱性区[7⇓-9], 碱性区通过与DNA相结合来调控下游靶基因的表达[10]。目前, 许多植物的bHLH家族成员已被鉴定, 拟南芥(Arabidopsis thaliana)中有162个成员[11], 辣椒(Capsicum annuum)中有122个成员[12], 玉米(Zea mays L.)中有161个成员[13], 水稻(Oryza sativa)中有167个成员[14], 番茄(Solanum melongena L.)中有121个成员[15], 马铃薯 (Solanum tuberosum L.)中有108个成员[16]。
脱落酸(abscisic acid, ABA)在植物响应非生物胁迫中发挥重要作用[17]。已有研究表明, 通过ABA依赖途径, 超表达MdbHLH130、AtHLH68和OrHLH2基因可以提高转基因烟草和拟南芥的抗旱性或耐盐性[18⇓-20]。ABA响应基因的启动子区均含有一个保守的顺式作用元件(ABRE; Py-ACGTGGTC)[21]。ABRE结合蛋白(AREB)或ABRE结合因子(ABFs)已经被分离鉴定, 且AREB/ABFs编码bZIP转录因子的碱性结构域[22]。在拟南芥中, 干旱、高盐和ABA可诱导AREB1/ABF2、AREB2/ABF4和ABF3基因的表达[23]。另外, AREB家族的同源蛋白TRAB1和HvABI5在水稻和大麦中已有报道[24-25]。AREB1蛋白活性受到ABA依赖的保守区域多个位点磷酸化的调控, SNF1相关蛋白激酶2 (SnRK2s)在AREB1蛋白磷酸化中起到关键的作用[23,26]。SnRK2s蛋白激酶可以识别AREB/ABFs蛋白保守区域的氨基酸序列(Ser/Thr; R-X-X-S/T)并进行磷酸化从而调控其活性[26]。例如, 在干旱条件下, 拟南芥bHLH转录因子AKS1 (FLOWERING BHLH 3, FBH3)被SnRK2.6磷酸化而丧失活性, 并从DNA上解离, 抑制KAT1基因的表达, 导致气孔关闭, 最终赋予拟南芥抗旱的能力[27]。
马铃薯(Solanum tuberosum L.)营养价值丰富、适应性强, 是我国重要的粮食作物之一, 仅次于水稻、小麦和玉米[28]。马铃薯属于环境敏感性作物, 其生长过程中的环境胁迫(如干旱和盐害)会严重影响马铃薯的产量和品质[29]。马铃薯也可利用ABA信号通路来应对环境胁迫。在干旱刺激下, 马铃薯中合成的ABA可以调控气孔的关闭来影响马铃薯的产量[30]。ABF是ABA信号通路中的关键调节因子。过表达AtABF4可以增强马铃薯的抗旱性和耐盐性, 并增加其块茎的产量[31]。通过依赖ABA信号通路, 高盐、干旱和ABA可以诱导马铃薯StABF1的表达, 说明其可能是马铃薯响应胁迫的关键调节因子之一[32]。干旱胁迫下, 马铃薯中的StSnRK2.4、StSnRK2.8和StAREB2基因表达存在差异, 说明SnRK2基因的表达与干旱紧密相关[33]。已有文章报道, MYB、NF-Y和bZIP等转录因子参与了马铃薯对干旱胁迫的响应[34]。尽管马铃薯bHLH转录因子的家族成员已被鉴定, 但截至目前, 国内外关于马铃薯bHLH转录因子在响应非生物胁迫功能方面的报道较少。为探究bHLH转录因子在马铃薯非生物胁迫响应中的功能, 本研究以拟南芥AtFBH3在马铃薯中的同源基因StFBH3为研究对象, 将该基因在马铃薯中进行过表达。进一步对StFBH3转基因马铃薯在高盐和干旱胁迫下的抗逆性进行了分析, 以期为阐明马铃薯bHLH转录因子在植物非生物胁迫应答中的分子机制提供一定的理论依据, 也为筛选和培育优质抗旱、耐盐马铃薯新种质及作物改良提供有用的参考价值。
1 材料与方法
1.1 试验材料与试剂
试验材料为四倍体马铃薯品种‘Desiree’脱毒组织培养苗, 由本实验室保存。马铃薯组培苗经扩繁后, 置于组织培养室中培养, 温度22℃、光暗周期16 h/8 h、光照强度约2000 μmol m-2 s-1。试验中所用到的各种感受态细胞、不同种类的酶、提取试剂盒和检测试剂盒等都为国产或者进口产品。
1.2 马铃薯cDNA的获取
以马铃薯叶组织为材料, 按照试剂盒的说明(全式金, 北京)提取总RNA, 测定RNA浓度并用1.2%琼脂糖凝胶电泳验证RNA的完整性。按照First Strand cDNA Synthesis试剂盒进行反转录和cDNA的合成。
1.3 马铃薯StFBH3基因的克隆
利用拟南芥AtFBH3基因的氨基酸序列, 在Phytozome数据库(
表1 本研究所用引物
Table 1
| 引物名称 Prime name | 引物序列 Primer sequence (5'-3') |
|---|---|
| StFBH3-F | ATGGATTCATCAGAGTTTGAG |
| StFBH3-R | TTTGCAGTTAGCGCGACAGTCA |
| HYG-F | GATCGGACGATTGCGTCGCAT |
| HYG-R | CGTGGATATGTCCTGCGGGTAA |
| qStFBH3-F | GTGGGTACAGGGTGATGGGG |
| qStFBH3-R | CTCCAGCACCTTTCAAC |
| qStKAT1-F | GGATCTGCTTTTCCAACTGGTTC |
| qStKAT1-R | CGAGCAACAGCCTTCCCAAT |
| Actin-F | ATTGGAAACGGATATGCTCCA |
| Actin-R | TCCTTACCTGAACGCCTGTCA |
1.4 转基因株系的获得
1.5 StFBH3基因表达模式分析
以转基因马铃薯植株和非转基因马铃薯植株为研究对象, 分别用ABA、NaCl和PEG-6000进行胁迫处理。参考Bouaziz等[36], 选取生长周期约为3周且长势一致的马铃薯植株, 分别置于含有50 µmol L-1 ABA、200 mmol L-1 NaCl和10% PEG-6000的1/2 MS液体培养基中, 置于组织培养间培养。处理48 h后, 分别取植株的根、茎和叶片并立即置于液氮中, -80℃保存。提取处理后马铃薯根、茎和叶片的总RNA并反转录为cDNA。以cDNA为模板, 根据StFBH3基因和内参基因设计特异荧光定量引物(表1), 使用ABI3000 (美国ABI公司) qPCR仪进行实时荧光定量PCR (qPCR)扩增。每个生物学样本和每个试验技术重复3次, 采用2-∆∆Ct方法分析StFBH3基因的相对表达情况。
1.6 转基因马铃薯对盐、旱和ABA的耐受性分析及叶片叶绿素含量测定
取生长周期为4周的WT和StFBH3转基因马铃薯组培苗的茎段, 并将其转移至含有100 mmol L-1 NaCl、350 mmol L-1甘露醇和100 µmol L-1 ABA的MS固体培养基中, 25℃条件下培养1个月。野生型和转基因植株各5株, 各设3个生物学重复。观察表型后, 统计分析根长、根数和生根率。其中生根率(%)=生根植株数/总植株数×100。对WT和StFBH3转基因马铃薯叶片的叶绿素含量进行测定。取生长周期为4周且完全伸展的健康叶片, 分别置于含有0、200、400和600 mmol L-1 NaCl或甘露醇的1/2 MS液体培养基中, 置于25℃条件下处理5 d, 野生型和转基因植株叶片各5个, 每组处理重复3次。按照叶绿素含量测定试剂盒(建成, 南京)说明测定叶绿素含量。
1.7 土壤中转基因马铃薯植株对干旱和盐的耐受性分析
选取生长状态一致的转基因及野生型马铃薯试管苗移栽至含有等量土质的高6.5 cm、直径6.0 cm的花盆中, 土质为蛭石和营养土的混合土, 比例为1∶3。将花盆置于温室中培养, 第1周保持每天浇水, 后3周每隔3 d浇水1次, 保证花盆中水分充足。4周后选取长势相似的马铃薯植株进行不同的处理。对照组进行正常的浇水处理; 盐处理组浇灌100 mmol L-1 NaCl进行胁迫处理14 d后观察表型并取样; 干旱处理组进行自然干旱处理7 d和复水处理7 d后分别观察表型及取样。以上处理均设3个生物学重复。表型观察后, 测量植株的株高; 测定叶片相对含水量(%)=[(鲜重-干重)/(吸水后重-干重)]×100; 测定过氧化物歧化酶(superoxide dismutase, SOD)和叶绿素的含量。
1.8 盐胁迫下马铃薯单株试管薯鲜重的测定
取生长至4周的WT和StFBH3转基因马铃薯组培苗的茎段, 分别将其转移至含有0和50 mmol L-1 NaCl的MS固体培养基中(MS培养基含有10%蔗糖和5 mg L-1激动素), 每组设3个生物学重复, 25℃黑暗条件下培养1个月进行结薯。统计分析每组处理下单株试管薯的鲜重(mg)。
1.9 数据处理
利用MEGA7和DNAMAN进行进化树的分析和建立; 通过Microsoft Excel 2021软件进行数据整理和分析; 利用SPSS 18.0软件进行数据统计分析, 采用LSD和Waller- Duncan (W)方法对数据进行单因素方差分析(One-way ANOVA)和多重比较来评估不同条件处理下转基因和野生型植株之间的差异性, 比较后的数据以平均值和标准差(SD) (n = 3)的形式表示, 显著差异用星号表示(*: P < 0.05; **: P < 0.01)。
2 结果与分析
2.1 StFBH3的克隆与进化树分析
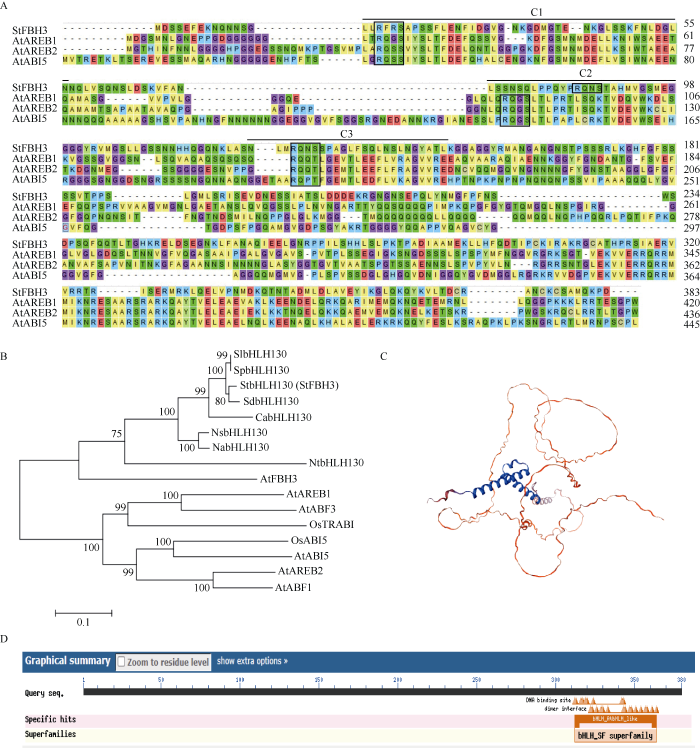
将拟南芥基因AtFBH3 (AT1G51140)序列提交至Phytozome数据库进行对比, PGSC0003DMT400021062的bitscore最高, 为77.9295, identity为86%, 故将其命名为StFBH3, 并用于后续研究。StFBH3基因全长2580 bp, 含有6个外显子和5个内含子。提取‘Desiree’叶片的RNA并反转录为cDNA, 以该cDNA为模板对StFBH3进行克隆并测序, 序列分析表明该序列与参考序列一致。
图1
图1
StFBH3的序列分析
A: 氨基酸多序列比对。黑线表示C1、C2和C3保守结构域; 黑色框表示保守的磷酸化位点。B: 进化树分析。0.1标尺表示每单位核苷酸变化的数量。C: 蛋白空间结构预测。D: 保守结构域分析。
Fig. 1
Sequence analysis of StFBH3
A: multiple sequence alignment of amino acid sequence. The positions of C1, C2, and C3 conserved domains are indicated by black lines.
Consensus phosphorylation sites are indicated by the black boxes. B: analysis of the evolutionary tree. The 0.1 scale bar indicates the
number of amino acid substitution per site. C: protein tertiary structure prediction. D: conserved domain analysis.
2.2 StFBH3在马铃薯中的表达模式分析
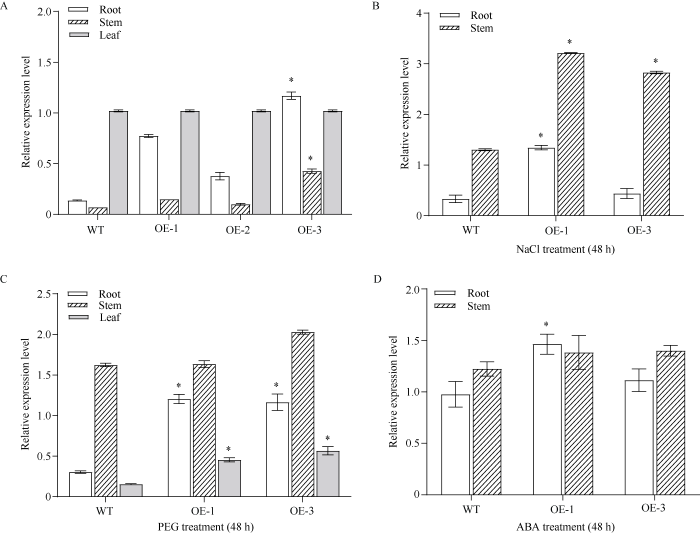
分别提取野生型和过表达马铃薯植株的根、茎和叶片的RNA, 并逆转录为cDNA, 进行qPCR分析。结果表明, StFBH3在不同组织中均有表达, 但表达量存在一定差异(图2-A)。将叶片中StFBH3的表达量记为1, 与茎相比, StFBH3在叶片和根中的表达量较高。另外, 与野生型相比, 所有过表达植株的根和茎中, StFBH3的表达量增加。但是, 在3株不同过表达植株的根和茎中, StFBH3的表达量也存在一定差异, OE-3最高, 其次是OE-1。OE-3根和茎中StFBH3的表达量较野生型显著增加, 根中StFBH3的表达量最高, 是野生型的8.6倍。
图2
图2
StFBH3在马铃薯不同组织和非生物胁迫处理下的相对表达量
A: StFBH3在不同组织中的相对表达量; B~D: StFBH3在高盐、脱水和ABA处理后的相对表达量。*表示在0.05概率水平差异显著。
Fig. 2
Relative transcript level of StFBH3 under different potato tissues and abiotic stress
A: relative expression of StFBH3 in different tissues; B-D: relative expression of StFBH3 after high salt, dehydration and ABA treatments. * indicates a significant difference at the 0.05 probability level.
为了进一步研究StFBH3在干旱、高盐和ABA胁迫下的表达模式, 将野生型和过表达植株分别置于含有10% PEG-6000、100 mmol L-1 NaCl和50 µmol L-1 ABA的1/2 MS培养基中, 分别处理0 h和48 h。提取植株不同部位的RNA, 并逆转录为cDNA, 进行qPCR分析。在盐处理48 h后, StFBH3在所有过表达马铃薯株系根和茎中的表达量均上调; 其在OE-1根中的表达量约为对照的1.3倍, 茎中的表达量约为对照的3.2倍, 均呈显著水平(图2-B)。在PEG处理48 h后, StFBH3在所有过表达马铃薯株系根、茎和叶片中的表达量均上调, 其中OE-1和OE-3根和叶片中StFBH3相对表达量较野生型呈显著水平(图2-C)。在ABA处理48 h后, StFBH3在所有植株的根和茎中的表达量均上调, 其中OE-1根中StFBH3相对表达量较野生型显著上调, 约为对照的1.6倍(图2-D)。表明高盐、渗透和ABA胁迫均不同程度地影响StFBH3基因的表达, 其中根对胁迫处理表现得更为敏感。由此推测StFBH3可能参与响应脱水、高盐、渗透和ABA激素等胁迫。
2.3 过表达StFBH3的马铃薯株系叶片的胁迫处理分析
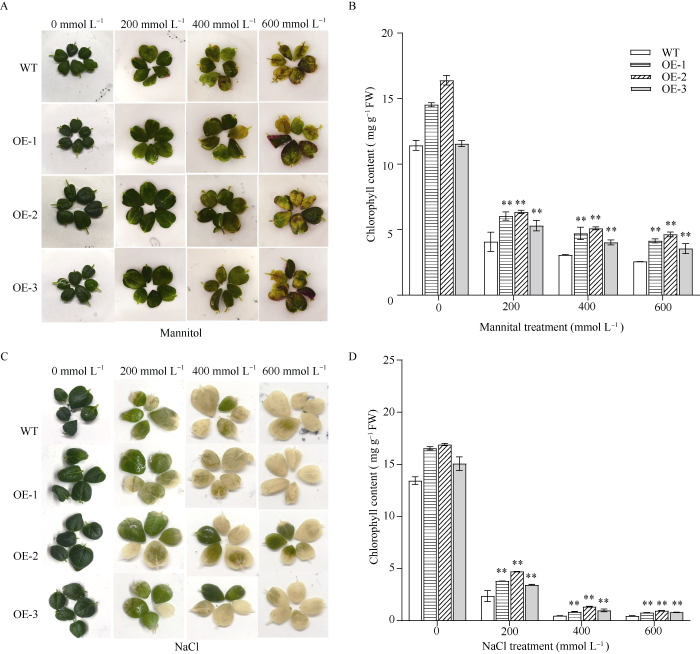
选取完全伸展且长势一致的野生型和过表达马铃薯植株的叶片, 将其分别置于含有0、200、400和600 mmol L-1 NaCl和甘露醇的1/2 MS培养基中, 孵育5 d后测定叶绿素的含量。利用不同浓度甘露醇处理5 d后, 与野生型相比, 过表达马铃薯植株的叶片较绿(图3-A), 且所有过表达马铃薯株系叶片的叶绿素含量与野生型差异均极显著, 其中OE-2叶片中的叶绿素含量最高, 分别是野生型的1.7、1.7和1.8倍(图3-B)。利用不同浓度NaCl处理5 d后, 野生型马铃薯的叶片因失去叶绿素而变为白色, 过表达马铃薯植株的叶片则保持绿色(图3-C), 同样所有过表达马铃薯株系叶片的叶绿素含量与野生型差异均极显著, 其中OE-2叶片中的叶绿素最高, 分别为野生型的2.0、2.8和2.1倍(图3-D)。由此推测, StFBH3基因可能参与了马铃薯的渗透胁迫和盐胁迫响应。
图3
图3
不同浓度甘露醇和盐处理下过表达马铃薯株系中叶绿素含量比较
A和C: 不同浓度甘露醇和盐处理下, 过表达马铃薯株系与野生型植株叶片的表型; B和D: 不同浓度甘露醇和盐处理下, 过表达马铃薯株系与野生型植株叶片中叶绿素含量。**表示在0.01概率水平差异显著。
Fig. 3
Chlorophyll content of overexpression potato lines under different concentrations of mannitol and NaCl
A and C: phenotypic of overexpression potato lines and WT plants under different mannitol and NaCl concentrations; B and D: chlorophyll content of overexpression potato lines and WT plants under different mannitol and NaCl concentrations. ** indicates a significant difference at the 0.01 probability level.
2.4 过表达StFBH3马铃薯株系的耐盐胁迫和耐渗透胁迫分析
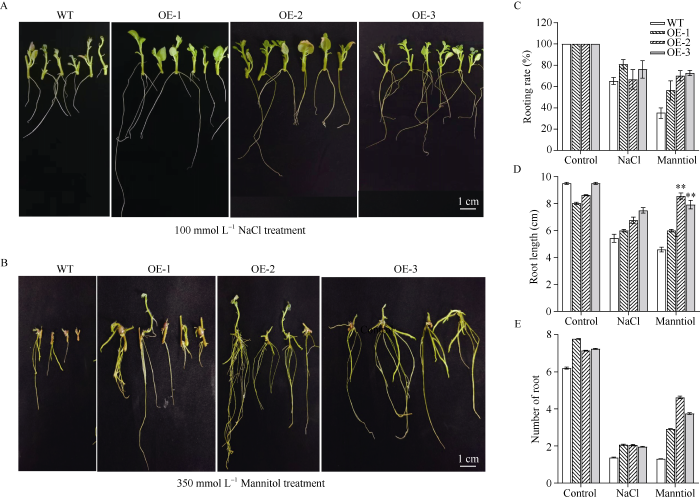
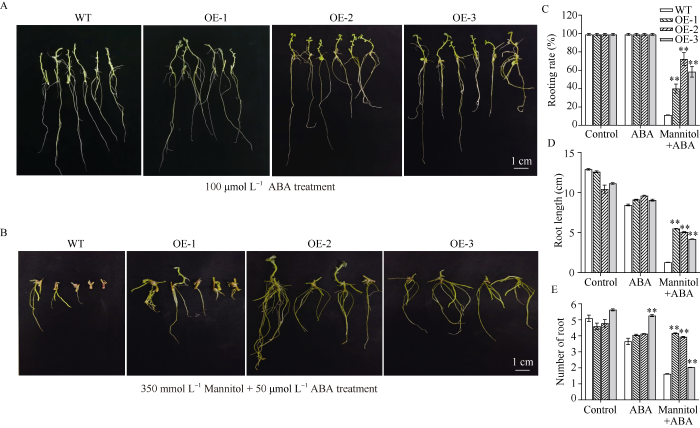
将野生型和过表达StFBH3基因的马铃薯试管苗剪成带有一片叶子的腋芽, 分别置于含有100 mmol L-1 NaCl和 350 mmol L-1 甘露醇的MS培养基中, 培养30 d。利用NaCl处理30 d后, 野生型和过表达马铃薯的腋芽均可正常生长, 但过表达马铃薯株系的根系生长优于野生型(图4-A)。OE-1和OE-3马铃薯腋芽的生根率均优于野生型(62%), 分别为81%和76% (图4-C)。3个过表达马铃薯株系的根系长优于野生型的根系, 且根数也优于野生型(图4-D, E)。利用甘露醇处理30 d后, 野生型和过表达马铃薯的腋芽均可正常生长, 但过表达马铃薯株系均表现出更强的耐受性, 其根系的主根长及侧根都优于野生型(图4-B)。3个过表达马铃薯株系腋芽的生根率均优于野生型, 分别为野生型的1.5、2.2和2.0倍(图4-C)。3个过表达马铃薯株系的根系长于野生型的根系, 其中OE-1、OE-2和OE-3株系的主根长极显著长于野生型(图4-D); 另外, 与野生型相比, 3个过表达马铃薯株系的主根数更多, 其中OE-2株系最多有5个主根(图4-E)。因此推测, 当马铃薯受到一定程度的盐胁迫和渗透胁迫时, StFBH3基因起到重要的耐受调控作用。
图4
图4
在NaCl和甘露醇处理下过表达马铃薯株系的生根率、根长和根数比较
A~B: 100 mmol L-1NaCl和350 mmol L-1 甘露醇处理下的马铃薯株系形态学; C~E: 100 mmol L-1 NaCl和350 mmol L-1 甘露醇处理下马铃薯株系的生根率、主根长度和主根数。标尺为1.0 cm; **表示在0.01概率水平差异显著。
Fig. 4
Rooting rate, root length and numbers of roots of overexpression potato lines under NaCl and mannitol treatments
A-B: morphology of potato lines under 100 mmol L-1 NaCl and 350 mmol L-1 mannitol; C-E: rooting rate, the main root length and root numbers of potato lines under 100 mmol L-1 NaCl and 350 mmol L-1 mannitol. Bar: 1.0 cm; ** indicates a significant difference at the 0.01 probability level.
2.5 过表达StFBH3的马铃薯株系的ABA胁迫分析
将野生型和过表达StFBH3基因的马铃薯试管苗剪成带有一片叶子的腋芽, 分别置于含有100 µmol L-1 ABA、350 mmol L-1 甘露醇和50 µmol L-1 ABA的MS培养基中, 处理30 d。过表达马铃薯株系的耐胁迫能力更强, 其根系的长度较野生型具有一定的优势(图5-A, B)。100 µmol L-1 ABA处理下, 其生根率与野生型无差异, 而在350 mmol L-1 甘露醇和50 µmol L-1 ABA共同处理下, 过表达马铃薯株系的生根率极显著地高于野生型(图5-C)。100 µmol L-1 ABA处理下, 其中OE-3马铃薯株系的根数极显著地高于野生型; 而350 mmol L-1 甘露醇和50 µmol L-1 ABA共同处理下, 所有过表达马铃薯株系的根长和根数均极显著地高于野生型(图5-D, E)。由此推测, ABA可能参与了StFBH3基因对渗透胁迫耐受的响应过程。
图5
图5
ABA和甘露醇处理下过表达马铃薯株系的生根率、根长和根数比较
A: 100 µmol L-1 ABA处理下的马铃薯株系形态学; B: 50 µmol L-1 ABA和350 mmol L-1 甘露醇处理下的马铃薯株系形态学; C~E: 2种条件处理下马铃薯株系的生根率、主根长度和主根数量。标尺为1.0 cm; **表示在0.01概率水平差异显著。
Fig. 5
Rooting rate, root length and numbers of roots of overexpression potato lines on ABA and mannitol
A: morphology of potato lines under 100 µmol L-1 ABA; B: morphology of potato lines under 50 µmol L-1 ABA and 350 mmol L-1 mannitol; C-E: rooting rate, the main root length and root numbers of potato lines under two conditions. Bar: 1.0 cm; ** indicates a significant difference at the 0.01 probability level.
2.6 过表达StFBH3的马铃薯株系在土壤中的抗旱性分析
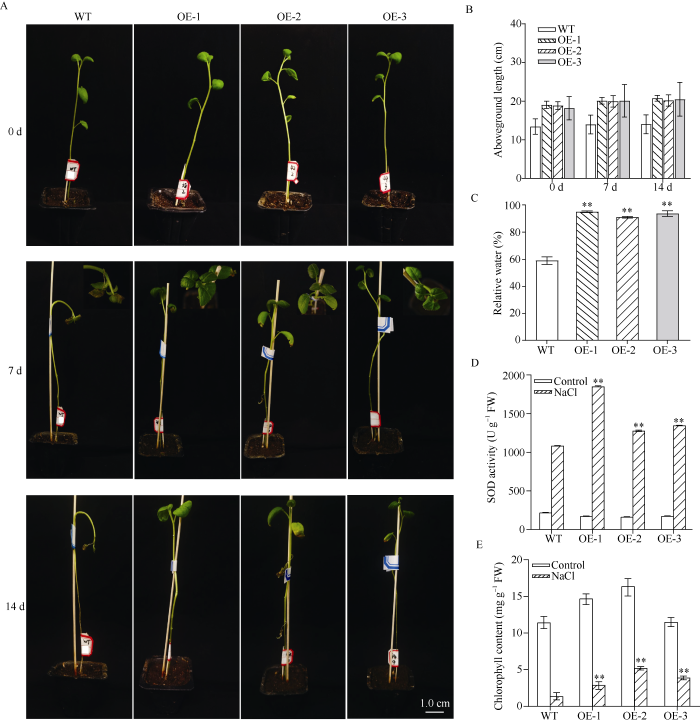
为了进一步探究StFBH3在干旱胁迫下的作用, 本研究将过表达和野生型马铃薯的试管苗移栽至花盆中, 并置于温室中培养, 生长4周后进行干旱处理。在未进行干旱处理的条件下, 野生型和过表达马铃薯株系的生长状态无差异。当进行干旱处理7 d后, 野生型和过表达马铃薯株系的生长状态均受到影响, 最为明显的现象是叶片均出现萎蔫, 但野生型马铃薯叶片的失水程度比过表达马铃薯株系更加严重, 野生型叶片的相对含水量为48.7%, 而OE-1、OE-2和OE-3的叶片相对含水量分别为60.4%、54.5%和56.3% (图6-A, C)。为了更好地评估上述马铃薯株系对干旱的反应能力, 分别测量干旱处理7 d和14 d后, 野生型和过表达马铃薯株系地上部的长度。野生型马铃薯的生长较缓慢, 而过表达马铃薯株系的茎长有所增加(图6-B)。复水处理7 d后, 野生型马铃薯植株茎段干枯, 并未生长新叶片, 而过表达马铃薯株系可以正常存活(图6-A)。另外, 过表达马铃薯株系叶片的叶绿素含量极显著地高于野生型, 野生型叶片叶绿素含量降低了62.8%, 而OE-1、OE-2和OE-3叶片叶绿素含量分别降低了27.0%、50.6%和55.5% (图6-E)。此外, 本研究分析SOD酶活发现, 在正常条件下, 所有马铃薯株系中SOD酶活性无差异。干旱处理15 d后, 过表达马铃薯株系中SOD酶活性均极显著地高于野生型。过表达马铃薯株株系中SOD酶活性增加了2.4~2.9倍, 野生型只增加了1.6倍(图6-D)。因此推测, 过表达StFBH3马铃薯植株可能通过调节体内过氧化物酶活性而增强其抗旱性。
图6
图6
土壤中StFBH3过表达马铃薯株系在干旱胁迫下的表型分析
A: 马铃薯植株在干旱胁迫下的表型; B: 干旱胁迫下, 马铃薯株系地上部位的长度; C: 干旱胁迫下, 马铃薯株系叶片的相对含水量; D: 干旱胁迫下, 马铃薯株系叶片中SOD酶活性分析; E: 干旱胁迫下, 马铃薯株系的叶绿素含量测定。标尺为1.0 cm; **表示在0.01概率水平差异显著。
Fig. 6
Phenotypes of StFBH3-OE potato lines under drought stress in soil
A: the phenotype of potato; B: length above of potato under drought stress; C: percentage of relative water contents in potato under drought stress; D: percentage of chlorophyll contents in potato under drought stress; E: SOD activity of potato under drought stress. Bar: 1.0 cm; ** indicates a significant difference at the 0.01 probability level.
2.7 过表达StFBH3的马铃薯株系在土壤中的耐盐性分析
在正常生长条件下, 过表达和野生型马铃薯株系的生长状态无明显差异。当利用100 mmol L-1 NaCl处理7 d后, 野生型马铃薯植株顶部整个叶片发黄、干枯并卷曲严重, 而过表达马铃薯株系的顶部叶片仍呈现绿色, 并略微萎蔫卷曲(图7-A)。过表达马铃薯株系叶片相对含水量分别为94.3%、90.6%和93.2%, 极显著地高于野生型(图7-C)。在盐处理14 d后, 野生型马铃薯植株的所有叶片干枯并死亡, 而过表达马铃薯株系仅底部叶片发黄干枯, 而顶部叶片仍呈现绿色(图7-A)。干旱处理7 d和14 d后, 分别测量野生型和过表达马铃薯株系地上部的长度。结果如图7-B所示, 野生型马铃薯的生长较缓慢, 而过表达马铃薯株系的茎长有所增加(图7-B)。另外, 过表达马铃薯株系叶片的叶绿素含量极显著地高于野生型, 野生型叶片叶绿素含量降低了87.7%, 而OE-1、OE-2和OE-3叶片叶绿素含量分别降低了80.3%、68.1%和65.9% (图7-E)。此外, 在盐处理15 d后, 过表达马铃薯株系中SOD酶活性均极显著地高于野生型。过表达马铃薯株系中SOD酶活性增加了6.7~9.7倍, 野生型只增加了3.9倍(图7-D)。因此推测过表达StFBH3马铃薯植株可能通过调节体内过氧化物酶活性而响应盐胁迫。
图7
图7
土壤中StFBH3过表达马铃薯株系在盐胁迫下的表型分析
A: 马铃薯植株在盐胁迫下的表型; B: 在盐胁迫下, 马铃薯株系地上部位的长度; C: 在盐胁迫下, 马铃薯株系叶片的相对含水量; D: 在盐胁迫下, 马铃薯株系叶片中SOD酶活性分析; E: 在盐胁迫下, 马铃薯株系的叶绿素含量测定。标尺为1.0 cm; **表示在0.01概率水平差异显著。
Fig. 7
Phenotypes of StFBH3-OE potato lines under salt stress in soil
A: the phenotype of potato; B: length above of potato under salt stress; C: percentage of relative water contents in potato under salt stress; D: percentage of chlorophyll contents in potato under salt stress; E: SOD activity of potato under salt stress. Bar: 1.0 cm; ** indicates a significant difference at the 0.01 probability level.
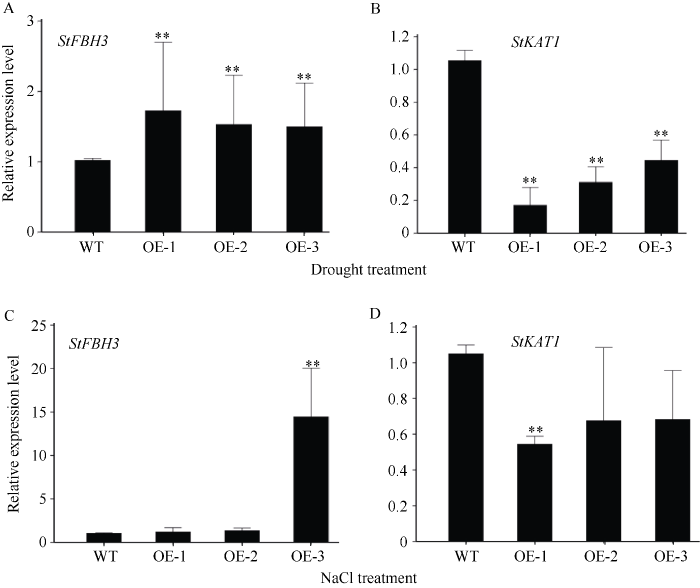
2.8 胁迫应答基因在StFBH3过表达马铃薯植株中的表达量分析
图8
图8
干旱和盐胁迫响应基因在马铃薯中的表达分析
**表示在0.01概率水平差异显著。
Fig. 8
Relative expression analysis of the stress-induced genes in StFBH3-OE and WT potatoes under drought and salt treatment
** indicates a significant difference at the 0.01 probability level.
2.9 过表达StFBH3的马铃薯株系在盐胁迫下的单株试管薯鲜重分析
在正常的培养条件下, 过表达植株较野生型马铃薯植株的单株试管薯鲜重无显著差异。在50 mmol L-1 NaCl的培养条件下, 过表达植株较野生型马铃薯植株的单株试管薯鲜重也无显著差异。但与未添加NaCl相比, 添加50 mmol L-1 NaCl诱导的过表达和野生型马铃薯植株的单株试管薯鲜重均下降, 野生型降低了66.8%, 而过表达马铃薯株系分别降低了56.4%、62.4%和52.3% (表2)。表明过表达StFBH3马铃薯株系具有一定的耐盐性, 其生长发育能力更强。
表2 50 mmol L-1 NaCl处理下过表达马铃薯株系单株试管薯鲜重
Table 2
| 样本 Groups | 每株平均试管薯鲜重Micro-tuber per plant | |
|---|---|---|
| 0 mmol L-1 NaCl | 50 mmol L-1 NaCl | |
| CK | 34.68 ± 14.86 a | 11.50 ± 7.80 a |
| OE-1 | 48.65 ± 27.35 a | 21.23 ± 6.92 a |
| OE-2 | 35.00 ± 12.02 a | 13.16 ± 1.46 a |
| OE-3 | 38.44 ± 9.75 a | 18.35 ± 16.73 a |
小写字母a表示在0.05概率水平差异不显著。
The lowercase letter a means no significant difference at the 0.05 probability level.
3 讨论
干旱、高盐等环境胁迫会严重影响植物的生长发育, 而植物体内形成的多种响应机制通过调控基因的表达来应对不同的环境胁迫。bHLH家族是植物界第二大类转录因子, 其通过转录或者翻译后修饰在植物响应各种环境胁迫中发挥着重要的调控作用[37]。此外, 研究发现bHLH转录因子参与的植物抗旱性与赤霉素(JA)和脱落酸(ABA)信号通路有关[38]。例如, 在拟南芥中, AtbHLH68通过ABA信号传递提高其耐旱性[18]。在小麦中, TabHLH1通过调节脱落酸途径来提高其抗旱性[39]。bHLH转录因子参与高盐胁迫响应的同时会伴随干旱胁迫响应。例如, 拟南芥的AtbHLH92基因受高盐、甘露醇诱导表达, 过表达AtbHLH92 基因增加拟南芥根长和侧根数, 从而增强其抗旱性和耐盐性[40]。拟南芥的AtbHLH112基因受高盐、干旱和ABA的诱导表达, 过表达AtbHLH112基因可以增强植物的抗逆性[41]。此外, 在正常生长条件下, 植物体内的SOD、POD等酶能及时清除活性氧, 从而维持细胞渗透平衡[42]。在拟南芥中, 过表达ThbHLH1基因, 植物体内的SOD酶活性提高, ROS清除能力增强, 从而增强植株的耐盐性和抗旱性[43]。本研究克隆了马铃薯的StFBH3基因, 其编码的蛋白具有bHLH转录因子特有的保守结构域。马铃薯中的StFBH3基因表达受干旱、高盐和ABA诱导表达, 并且其在马铃薯不同组织器官中的表达量存在差异, 尤其在叶片和根中的表达量较高。为了更深入研究该基因在马铃薯响应非生物胁迫中所起的作用, 本研究对过表达StFBH3马铃薯株系进行抗逆分析, 发现分别在含有100 mmol L-1 NaCl和 350 mmol L-1 甘露醇的MS培养基中, 过表达马铃薯株系的根长极显著地高于野生型(P < 0.01)。在含有200、400和600 mmol L-1 NaCl和甘露醇的1/2 MS培养基中, 过表达马铃薯株系叶片较野生型更绿, 叶绿素含量极显著地高于野生型(P < 0.01)。另外, 在干旱和100 mmol L-1 NaCl的高盐处理下, 土壤中生长的过表达马铃薯株系较野生型生长的更好, 叶片相对含水量更高, 且过表达马铃薯株系的叶绿素含量极显著地高于野生型(P < 0.01)。同时, 分别在干旱和盐胁迫处理下, 过表达马铃薯株系较野生型具有更高的SOD酶活性。以上这些研究结果更进一步阐明, 在干旱、高盐胁迫下, StFBH3可能作为一个正向响应因子来发挥调控作用, 从而增强马铃薯的抗旱性和耐盐性。已有研究报道, 在拟南芥中, ABA参与下, bHLH转录因子AtFBH3通过抑制KAT1基因的表达, 导致气孔闭合, 最终赋予拟南芥抗旱的能力[27]。同样在马铃薯中, 在含有100 µmol L-1 ABA的MS培养基中, 过表达马铃薯株系的根系比野生型更长, 说明StFBH3可能通过ABA信号通路来参与干旱胁迫应答。同时, 在干旱和高盐胁迫下, qPCR结果表明, 过表达马铃薯株系中StKAT1的表达量下降, 有利于提高马铃薯的抗性。由此表明StFBH3能通过调控相关基因的表达来提高马铃薯抗旱性和耐盐性。
参考文献
干旱和盐胁迫对花生渗透调节和抗氧化酶活性的影响
Effects of drought and salt stress on osmotic regulator and antioxidase activities
Mechanisms of salinity tolerance
ROS and redox signalling in the response of plants to abiotic stress
中国玉米产业: 发展趋势与政策建议
China maize industry: development trends and policy suggestions
转录因子与叶片发育的研究进展
Research progress of transcription factors and leaf development
Transcription factors regulating leaf senescence in Arabidopsis thaliana
Regulating the regulators: the control of transcription factors in plant defense signaling
Regulatory switch enforced by basic helix-loop-helix and ACT-domain mediated dimerizations of the maize transcription factor R
Origin and diversification of basic-helix-loop- helix proteins in plants
Dissecting a co-expression network of basic helix-loop-helix (bHLH) genes from phosphate (Pi)-starved soybean (Glycine max)
Structure and function of helix-loop-helix proteins
Genome-wide identification and characterization of the bHLH transcription factor family in pepper (Capsicum annuum L.)
玉米ZmbHLH161基因的克隆及功能研究
Cloning and functional analysis of ZmbHLH161gene in maize
Genome-wide analysis of basic/helix-loop-helix transcription factor family in rice and Arabidopsis
Genome-wide analysis of basic helix-loop-helix superfamily members related to anthocyanin biosynthesis in eggplant (Solanum melongena L.)
马铃薯bHLH转录因子家族全基因组鉴定与表达分析
Genome-wide identification and expression analysis of the bHLH transcription factor family in Solanum tuberosum
Annual review of plant physiology and plant molecular biology
AtbHLH68 transcription factor contributes to the regulation of ABA homeostasis and drought stress tolerance in Arabidopsis thaliana
MdbHLH130, an apple bHLH transcription factor, confers water stress resistance by regulating stomatal closure and ROS homeostasis in transgenic tobacco
Basic helix-loop-helix transcription factor from wild rice (OrbHLH2) improves tolerance to salt- and osmotic stress in Arabidopsis
Regulation of abscisic acid-induced transcription
Viviparous1 alters global gene expression patterns through regulation of abscisic acid signaling
AREB1 is a transcription activator of novel ABRE-dependent ABA signaling that enhances drought stress tolerance in Arabidopsis
A bZIP factor, TRAB1, interacts with VP1 and mediates abscisic acid-induced transcription
The transcription factors HvABI5 and HvVP1 are required for the abscisic acid induction of gene expression in barley aleurone cells
Abscisic acid-dependent multisite phosphorylation regulates the activity of a transcription activator AREB1
Inhibition of the Arabidopsis bHLH transcription factor by monomerization through abscisic acid-induced phosphorylation
Biotech potatoes in the 21st century: 20 years since the first biotech potato
Symposium introduction:enhancing the nutritional value of potato tubers
Physiological responses of potato (Solanum tuberosum L.) to partial root-zone drying: ABA signalling, leaf gas exchange, and water use efficiency
Expression of the Arabidopsis ABF4 gene in potato increases tuber yield, improves tuber quality and enhances salt and drought tolerance
Characterization of StABF1, a stress-responsive bZIP transcription factor from Solanum tuberosum L. that is phosphorylated by StCDPK2 in vitro
Sucrose non-ferment 1 related protein kinase 2 (SnRK2) genes could mediate the stress responses in potato (Solanum tuberosum L.)
马铃薯抗旱性研究进展
Research progress in drought tolerance of potato
A stable cytosolic expression of VH antibody fragment directed against PVY NIa protein in transgenic potato plant confers partial protection against the virus
Overexpression of StDREB1 transcription factor increases tolerance to salt in transgenic potato plants
Evolutionary and comparative analysis of MYB and bHLH plant transcription factors
The bHLH-type transcription factor AtAIB positively regulates ABA response in Arabidopsis
Wheat bHLH-type transcription factor gene TabHLH1 is crucial in mediating osmotic stresses tolerance through modulating largely the ABA-associated pathway
Functional characterization of the Arabidopsis bHLH92 transcription factor in abiotic stress
Arabidopsis AtbHLH112 regulates the expression of genes involved in abiotic stress tolerance by binding to their E-box and GCG-box motifs
脯氨酸引发提高烟草种子和幼苗抗逆性及其与抗氧化系统的关系
Improving the antioxidant system and its stress resistance to tobacco seeds and seedling by proline priming
A bHLH gene from Tamarix hispida improves abiotic stress tolerance by enhancing osmotic potential and decreasing reactive oxygen species accumulation