泛素受体蛋白OsDSK2b负向调控水稻叶瘟和渗透胁迫抗性
丁杰荣, 马雅美, 潘发枝, 江立群, 黄文洁, 孙炳蕊, 张静, 吕树伟, 毛兴学, 于航, 李晨, 刘清
作物学报
2023, 49 ( 6):
1466-1479.
DOI: 10.3724/SP.J.1006.2023.22039
泛素受体蛋白DSK2 (dominant suppressor of KAR2)在植物生长发育和逆境胁迫中发挥重要作用, 但其在水稻抗病和渗透胁迫中的作用尚未见报道。本研究发现OsDSK2b受多种逆境的调控, 该基因的表达水平在稻瘟病菌侵染和20% PEG-6000处理后显著降低。时空表达分析表明OsDSK2b基因在三叶期幼苗中的表达水平最高, 亚细胞定位结果显示该蛋白定位于细胞质。接种稻瘟病菌(GD08-T13和Guy11)后, 敲除植株的病斑面积约为0.05 cm2和0.10~0.13 cm2, 远小于野生型植株的病斑面积(0.24 cm2和0.31 cm2)。敲除OsDSK2b显著增强水稻的叶瘟抗性。而且在病原菌侵染后, 敲除植株中病程相关蛋白(PR)基因的表达受到明显诱导。敲除OsDSK2b也显著增强水稻的渗透胁迫抗性, 20% PEG-6000模拟渗透胁迫处理后, OsDSK2b敲除植株的存活率为58.3%~74.0%, 显著高于野生型植株的存活率(17.0%)。OsDSK2b敲除植株的离子渗透率和植株失水率则显著低于野生型植株。扫描显微镜的结果表明, 无论在20% PEG-6000处理前后, 敲除OsDSK2b能够促进气孔的闭合, 且在20% PEG-6000处理后, 这种促进作用会更强。此外, qRT-PCR结果表明, 在20% PEG-6000处理后, OsDSK2b敲除植株中DREB基因以及脱落酸(ABA)合成或通路相关基因的表达水平显著高于野生型植株, 且敲除植株ko6和ko14的内源ABA含量分别为314.2 ng g-1和344.4 ng g-1, 显著高于野生型植株的内源ABA含量(206.8 ng g-1), 揭示OsDSK2b参与调控渗透胁迫的过程同时涉及ABA依赖和ABA非依赖途径。本研究通过解析OsDSK2b基因在水稻应对生物与非生物胁迫时所发挥的调控作用, 为水稻抗性品种的选育提供了新的候选基因。
View image in article
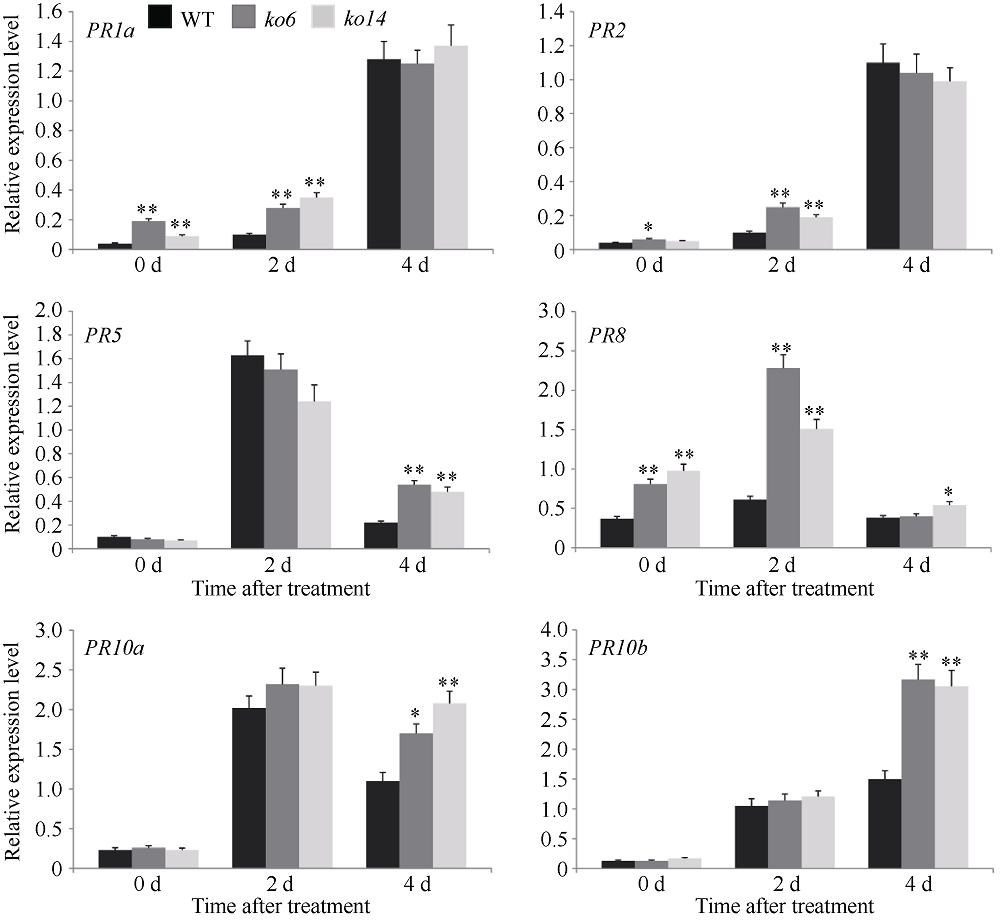
图3
OsDSK2b调控病程相关蛋白PR基因的表达
稻瘟病菌Guy11接种前(0 h)和接种后(2 d和4 d), 野生型日本晴和OsDSK2b敲除植株叶片中的PR基因的相对表达量。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
正文中引用本图/表的段落
A: OsDSK2b的结构和各敲除株系的靶序列突变情况。外显子和内含子分别用黑色矩形和黑线表示, 红色字体表示CRISPR载体构建的靶序列, 蓝色字体表示插入的碱基, 省略号表示缺失的碱基; B: 打孔接种GD08-T13菌株7 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; C: 打孔接种GD08-T13菌株7 d后, OsDSK2b敲除株系和野生型日本晴的病斑面积统计图; D: 离体接种Guy11菌株7 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; E: 接种Guy11菌株7 d后, OsDSK2b敲除株系和野生型日本晴的病斑面积统计图。 数据为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05, **: P < 0.01)。
为了进一步探究OsDSK2b调控水稻稻瘟病抗性的分子机制, 我们对野生型日本晴和OsDSK2b敲除植株中的PR基因的表达量进行测定, 分析了8个PR基因(PR1a、PR1b、PR2、PR3、PR5、PR8、PR10a和PR10b)在稻瘟病菌Guy11侵染前后的表达模式。结果表明, 正常条件下OsDSK2b敲除植株中PR1a和PR8基因的表达水平显著高于野生型植株(图3)。病原菌侵染后, 野生型和敲除植株中PR1a、PR2、PR5、PR8、PR10a和PR10b的转录均被诱导。侵染2 d后, 敲除植株中PR1a、PR2和PR8的表达水平显著高于野生型植株, 而侵染4 d后, 它们的表达水平在野生型和敲除植株中则无显著差异。侵染2 d后, PR5、PR10a和PR10b在敲除植株中的表达水平与野生型植株相比并无显著差异, 而侵染4 d后, 它们在敲除植株中的表达水平显著高于野生型植株(图3)。综上所述, 敲除OsDSK2b介导的水稻稻瘟病抗性增强很可能与PR基因的激活密切相关。
A: 20% PEG-6000处理前与处理3?d再复水生长5?d后, 野生型日本晴和OsDSK2b敲除株系的表型图; B: 20% PEG-6000处理3?d再复水生长5 d后, 野生型日本晴和OsDSK2b株高统计图; C: 20% PEG-6000处理前与处理5?d再复水生长5 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; D: 20% PEG-6000处理5 d再复水生长5 d后, 野生型日本晴和OsDSK2b的存活率统计图; E: 20% PEG-6000处理前后, 野生型日本晴和OsDSK2b的离子渗透率统计图; F: 野生型日本晴与OsDSK2b敲除株系地上部在0、30、60、90、120、180、240和300 min的离体失水率统计图。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
A: 不同开放程度的气孔图。标尺为10 μm; B: 正常条件下和20% PEG-6000处理4 h后, 野生型日本晴和OsDSK2b敲除株系中3种不同开放程度的气孔占比统计图。结果以3个生物学重复的平均值(±标准差)表示, 每个重复至少统计300个以上气孔; C: 野生型日本晴和OsDSK2b敲除株系中气孔密度统计图; D: 野生型日本晴和OsDSK2b敲除株系中气孔大小统计图。结果以3个生物学重复的平均值(±标准差)表示, 每个重复至少统计100个气孔。
本文的其它图/表
-
 表1
本研究所使用的引物信息表
表1
本研究所使用的引物信息表
-
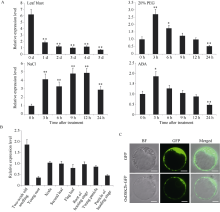 图1
OsDSK2b的表达受多种胁迫影响以及OsDSK2b在日本晴中的时空表达模式
图1
OsDSK2b的表达受多种胁迫影响以及OsDSK2b在日本晴中的时空表达模式
A: OsDSK2b在稻瘟病分离株Guy11、20% PEG-6000、150 mmol L-1 NaCl和100 μmol L-1ABA处理前后的相对表达量; B: OsDSK2b在日本晴不同组织(2周龄幼苗、幼根、茎节、倒二叶、旗叶、孕穗期根、幼穗和抽穗期穗)中的相对表达量; C: OsDSK2b蛋白在水稻原生质体中的亚细胞定位(标尺为10 μm)。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s test, *: P < 0.05, **: P < 0.01)
-
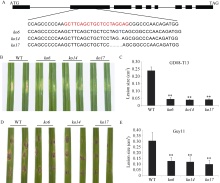 图2
敲除OsDSK2b增强水稻对稻瘟病的抗性
图2
敲除OsDSK2b增强水稻对稻瘟病的抗性
A: OsDSK2b的结构和各敲除株系的靶序列突变情况。外显子和内含子分别用黑色矩形和黑线表示, 红色字体表示CRISPR载体构建的靶序列, 蓝色字体表示插入的碱基, 省略号表示缺失的碱基; B: 打孔接种GD08-T13菌株7 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; C: 打孔接种GD08-T13菌株7 d后, OsDSK2b敲除株系和野生型日本晴的病斑面积统计图; D: 离体接种Guy11菌株7 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; E: 接种Guy11菌株7 d后, OsDSK2b敲除株系和野生型日本晴的病斑面积统计图。 数据为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05, **: P < 0.01)。
-
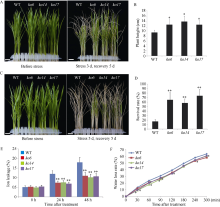 图4
敲除OsDSK2b增强水稻对渗透胁迫的抗性
图4
敲除OsDSK2b增强水稻对渗透胁迫的抗性
A: 20% PEG-6000处理前与处理3?d再复水生长5?d后, 野生型日本晴和OsDSK2b敲除株系的表型图; B: 20% PEG-6000处理3?d再复水生长5 d后, 野生型日本晴和OsDSK2b株高统计图; C: 20% PEG-6000处理前与处理5?d再复水生长5 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; D: 20% PEG-6000处理5 d再复水生长5 d后, 野生型日本晴和OsDSK2b的存活率统计图; E: 20% PEG-6000处理前后, 野生型日本晴和OsDSK2b的离子渗透率统计图; F: 野生型日本晴与OsDSK2b敲除株系地上部在0、30、60、90、120、180、240和300 min的离体失水率统计图。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
-
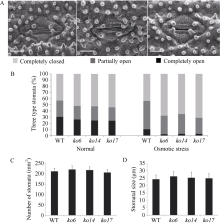 图5
敲除OsDSK2b降低气孔开度
图5
敲除OsDSK2b降低气孔开度
A: 不同开放程度的气孔图。标尺为10 μm; B: 正常条件下和20% PEG-6000处理4 h后, 野生型日本晴和OsDSK2b敲除株系中3种不同开放程度的气孔占比统计图。结果以3个生物学重复的平均值(±标准差)表示, 每个重复至少统计300个以上气孔; C: 野生型日本晴和OsDSK2b敲除株系中气孔密度统计图; D: 野生型日本晴和OsDSK2b敲除株系中气孔大小统计图。结果以3个生物学重复的平均值(±标准差)表示, 每个重复至少统计100个气孔。
-
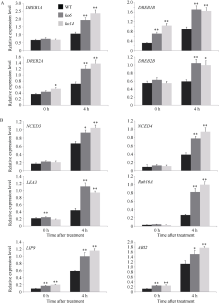 图6
OsDSK2b调控抗逆相关基因的表达
图6
OsDSK2b调控抗逆相关基因的表达
A: 20% PEG-6000处理前(0 h)和处理后(4 h)野生型日本晴和OsDSK2b敲除株系中DREB基因的相对表达量; B: 20% PEG-6000处理前(0 h)和处理后(4 h)野生型日本晴和OsDSK2b敲除株系中ABA信号通路相关基因的相对表达量。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
-
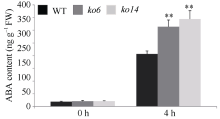 图7
OsDSK2b影响20% PEG-6000处理下水稻内源ABA的积累
图7
OsDSK2b影响20% PEG-6000处理下水稻内源ABA的积累
数据均为6个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
|