泛素受体蛋白OsDSK2b负向调控水稻叶瘟和渗透胁迫抗性
丁杰荣, 马雅美, 潘发枝, 江立群, 黄文洁, 孙炳蕊, 张静, 吕树伟, 毛兴学, 于航, 李晨, 刘清
作物学报
2023, 49 ( 6):
1466-1479.
DOI: 10.3724/SP.J.1006.2023.22039
泛素受体蛋白DSK2 (dominant suppressor of KAR2)在植物生长发育和逆境胁迫中发挥重要作用, 但其在水稻抗病和渗透胁迫中的作用尚未见报道。本研究发现OsDSK2b受多种逆境的调控, 该基因的表达水平在稻瘟病菌侵染和20% PEG-6000处理后显著降低。时空表达分析表明OsDSK2b基因在三叶期幼苗中的表达水平最高, 亚细胞定位结果显示该蛋白定位于细胞质。接种稻瘟病菌(GD08-T13和Guy11)后, 敲除植株的病斑面积约为0.05 cm2和0.10~0.13 cm2, 远小于野生型植株的病斑面积(0.24 cm2和0.31 cm2)。敲除OsDSK2b显著增强水稻的叶瘟抗性。而且在病原菌侵染后, 敲除植株中病程相关蛋白(PR)基因的表达受到明显诱导。敲除OsDSK2b也显著增强水稻的渗透胁迫抗性, 20% PEG-6000模拟渗透胁迫处理后, OsDSK2b敲除植株的存活率为58.3%~74.0%, 显著高于野生型植株的存活率(17.0%)。OsDSK2b敲除植株的离子渗透率和植株失水率则显著低于野生型植株。扫描显微镜的结果表明, 无论在20% PEG-6000处理前后, 敲除OsDSK2b能够促进气孔的闭合, 且在20% PEG-6000处理后, 这种促进作用会更强。此外, qRT-PCR结果表明, 在20% PEG-6000处理后, OsDSK2b敲除植株中DREB基因以及脱落酸(ABA)合成或通路相关基因的表达水平显著高于野生型植株, 且敲除植株ko6和ko14的内源ABA含量分别为314.2 ng g-1和344.4 ng g-1, 显著高于野生型植株的内源ABA含量(206.8 ng g-1), 揭示OsDSK2b参与调控渗透胁迫的过程同时涉及ABA依赖和ABA非依赖途径。本研究通过解析OsDSK2b基因在水稻应对生物与非生物胁迫时所发挥的调控作用, 为水稻抗性品种的选育提供了新的候选基因。
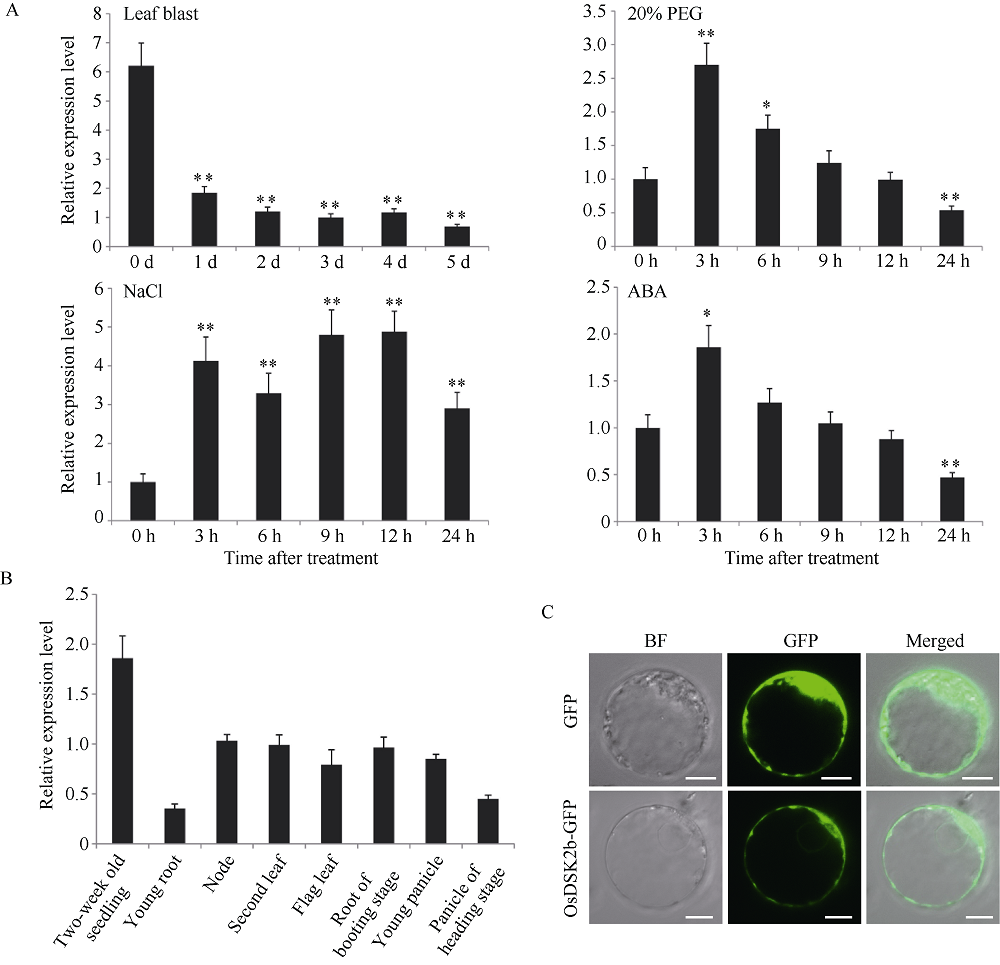
View image in article
图1
OsDSK2b的表达受多种胁迫影响以及OsDSK2b在日本晴中的时空表达模式
A: OsDSK2b在稻瘟病分离株Guy11、20% PEG-6000、150 mmol L-1 NaCl和100 μmol L-1ABA处理前后的相对表达量; B: OsDSK2b在日本晴不同组织(2周龄幼苗、幼根、茎节、倒二叶、旗叶、孕穗期根、幼穗和抽穗期穗)中的相对表达量; C: OsDSK2b蛋白在水稻原生质体中的亚细胞定位(标尺为10 μm)。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s test, *: P < 0.05, **: P < 0.01)
正文中引用本图/表的段落
通过检测稻瘟病菌接种、渗透胁迫、高盐和ABA处理后三叶期水稻幼苗中OsDSK2b的表达量, 发现OsDSK2b的表达显著地受稻瘟病菌侵染、渗透胁迫、高盐胁迫和ABA处理的影响。上述胁迫处理后, 水稻中OsDSK2b的表达量发生不同程度的变化。稻瘟病菌侵染显著抑制OsDSK2b的表达, 在处理后的1 d, OsDSK2b的表达量显著降低, 约为处理前的1/3, 并一直维持至5 d后。高盐胁迫诱导OsDSK2b的持续表达, 在处理后的3 h, OsDSK2b的表达量显著升高, 之后呈现波动状态, 并一直维持到24 h后(图1-A)。渗透胁迫和ABA处理均使OsDSK2b的表达量在处理后3 h达到峰值, 后又在处理后的12 h降至处理前水平(图1-A)。这些结果表明, OsDSK2b很可能在水稻生物胁迫和非生物胁迫中发挥重要作用。
为了更好地探究OsDSK2b基因在水稻抗逆中的功能, 我们检测了该基因在水稻不同组织的表达情况以及该蛋白的亚细胞定位。荧光定量PCR的结果表明, OsDSK2b在野生型日本晴的营养组织和生殖组织中均有不同程度表达(图1-B)。值得注意的是, OsDSK2b在水稻两周龄幼苗的地上部中检测到较高的转录水平, 而在幼根和抽穗期穗中较低, 在茎、倒二叶、旗叶、孕穗期根和幼穗则处于中间水平,表明OsDSK2b在2周龄幼苗中的表达水平最高。亚细胞定位的分析结果显示, 对照(空载) GFP蛋白的绿色荧光信号在细胞质、质膜和细胞核中均有分布, 而OsDSK2b-GFP融合蛋白的绿色荧光信号主要分布于细胞质中, 表明OsDSK2b是一个定位于细胞质的蛋白(图1-C)。
本文的其它图/表
-
 表1
本研究所使用的引物信息表
表1
本研究所使用的引物信息表
-
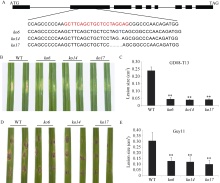 图2
敲除OsDSK2b增强水稻对稻瘟病的抗性
图2
敲除OsDSK2b增强水稻对稻瘟病的抗性
A: OsDSK2b的结构和各敲除株系的靶序列突变情况。外显子和内含子分别用黑色矩形和黑线表示, 红色字体表示CRISPR载体构建的靶序列, 蓝色字体表示插入的碱基, 省略号表示缺失的碱基; B: 打孔接种GD08-T13菌株7 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; C: 打孔接种GD08-T13菌株7 d后, OsDSK2b敲除株系和野生型日本晴的病斑面积统计图; D: 离体接种Guy11菌株7 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; E: 接种Guy11菌株7 d后, OsDSK2b敲除株系和野生型日本晴的病斑面积统计图。 数据为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05, **: P < 0.01)。
-
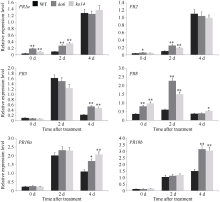 图3
OsDSK2b调控病程相关蛋白PR基因的表达
图3
OsDSK2b调控病程相关蛋白PR基因的表达
稻瘟病菌Guy11接种前(0 h)和接种后(2 d和4 d), 野生型日本晴和OsDSK2b敲除植株叶片中的PR基因的相对表达量。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
-
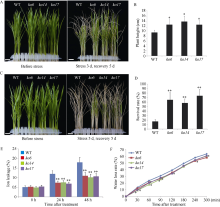 图4
敲除OsDSK2b增强水稻对渗透胁迫的抗性
图4
敲除OsDSK2b增强水稻对渗透胁迫的抗性
A: 20% PEG-6000处理前与处理3?d再复水生长5?d后, 野生型日本晴和OsDSK2b敲除株系的表型图; B: 20% PEG-6000处理3?d再复水生长5 d后, 野生型日本晴和OsDSK2b株高统计图; C: 20% PEG-6000处理前与处理5?d再复水生长5 d后, 野生型日本晴和OsDSK2b敲除株系的表型图; D: 20% PEG-6000处理5 d再复水生长5 d后, 野生型日本晴和OsDSK2b的存活率统计图; E: 20% PEG-6000处理前后, 野生型日本晴和OsDSK2b的离子渗透率统计图; F: 野生型日本晴与OsDSK2b敲除株系地上部在0、30、60、90、120、180、240和300 min的离体失水率统计图。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
-
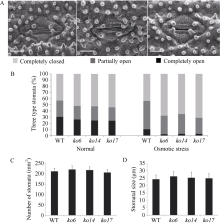 图5
敲除OsDSK2b降低气孔开度
图5
敲除OsDSK2b降低气孔开度
A: 不同开放程度的气孔图。标尺为10 μm; B: 正常条件下和20% PEG-6000处理4 h后, 野生型日本晴和OsDSK2b敲除株系中3种不同开放程度的气孔占比统计图。结果以3个生物学重复的平均值(±标准差)表示, 每个重复至少统计300个以上气孔; C: 野生型日本晴和OsDSK2b敲除株系中气孔密度统计图; D: 野生型日本晴和OsDSK2b敲除株系中气孔大小统计图。结果以3个生物学重复的平均值(±标准差)表示, 每个重复至少统计100个气孔。
-
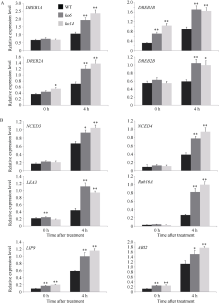 图6
OsDSK2b调控抗逆相关基因的表达
图6
OsDSK2b调控抗逆相关基因的表达
A: 20% PEG-6000处理前(0 h)和处理后(4 h)野生型日本晴和OsDSK2b敲除株系中DREB基因的相对表达量; B: 20% PEG-6000处理前(0 h)和处理后(4 h)野生型日本晴和OsDSK2b敲除株系中ABA信号通路相关基因的相对表达量。数据均为3个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
-
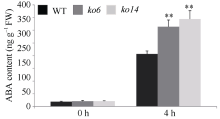 图7
OsDSK2b影响20% PEG-6000处理下水稻内源ABA的积累
图7
OsDSK2b影响20% PEG-6000处理下水稻内源ABA的积累
数据均为6个生物学重复的平均值(±标准差) (Dunnett’s测验, *: P < 0.05; **: P < 0.01)。
|