水稻细长秆突变体sr10的鉴定与基因定位
委刚, 陈单阳, 任德勇, 杨宏霞, 伍靖雯, 冯萍, 王楠
作物学报
2022, 48 ( 8):
2125-2133.
DOI: 10.3724/SP.J.1006.2022.12052
本研究报道的突变体sr10 (slender rice 10)是由籼稻保持系西农1B经甲酰磺酸乙酯(EMS)诱变而成, 表现为茎细长, 雄性不育。细胞学观察显示, sr10细胞变长, 维管束变少。冷冻切片和叶绿素含量测定表明, sr10的叶绿素含量大幅下降, 导致光合速率下降, 但气孔导度的降低可能提高其抗旱性。通过激素含量测定发现, sr10中IAA和GA3水平显著升高, 而ABA含量显著降低。qRT-PCR分析表明, GAs通路相关基因表达下调, IAA通路相关基因表达异常。遗传分析表明, sr10的突变表型受单个隐性核基因控制。SR10定位于3号染色体的分子标记LIND12和28.5~4之间的175.7 kb的区域内。本研究结果为SR10的克隆和功能分析奠定了基础。
引物
Primer | 正向序列
Forward primer(5'→3') | 反向序列
Reverse primer(5'→3') | | OsActin | ACCACTTCGACCGCCACTACT | ACGCCTAAGCCTGCTGGTT | | OsIAA3 | GACGCAGCAGAAGGAGGAT | GACGTCCCATTCGAGATGTT | | OsIAA6 | CCAATTCGATCCTTCAGGAG | CACAGCAAGGTGCAGATGAC | | OsIAA10 | GGTTGCTGGATGGGTGAAGG | CCAGCTCACCTACGAGGACAGG | | OsIAA11 | GCGCTGGTGAAGGTGAGCAT | AGAGATGACCTGGAGTACGT | | iaa21 | GAAGGCACAGGTGGTAGGATG | GGTGAATCAAATGGGAAGTCAGG | | OsIAA23 | GTACCTGCGCAAGGTGGAC | GTTCGTCGAGTCCTGCAAG | | OsSAUR39 | TACAGCTGATGGAGAGCGATT | TTGGATTCACAGGTGAGGAAA | | OsPIN3t | CGGCTCTACCACAAGGGATTG | TGTACTACATCCTTCTTGGACTATGA | | OsTIR1 | ATTACATCCTCTCAGGCTGC | CATGAACGATCCTGGAAGGT | | GA2ox1 | ACCACTACCCTCCATCATGCAACA | AGGCTAGCAATGGTGGGAATCTGA | | GA2ox4 | CTGCAGGTGATGACGAACGG | TGGAGCAGAGGATCGCGCCGCT | | GA3ox2 | CGCCTCTGGCCCAAGT | GAGTTGCTGAGGTTGTTCTTGAG | | GA20ox2 | GCCAATGGGGAGGGTGT | TGTCGCTGACGATCATGG | | SLR1 | TGCCCGCCATGCTTCCAC | GCTGACCCGTCGGCTGCT |
View table in article
表S2
本研究所用的qRT-PCR引物
正文中引用本图/表的段落
对控制水稻株高的遗传机制的探索是目前水稻遗传学和基因组学的研究热点[1]。目前已鉴定出许多与株高相关的基因, 例如, 基因Ghd7和Ghd2的过表达可以显著提高水稻株高, 在提高全球水稻产量潜力和适应性方面发挥着非常重要的作用[2-3]。分蘖对水稻等单子叶作物的产量影响很大[4], 在水稻中, 分蘖数几乎总是与株高成反比, 分蘖数的增加通常伴随着株高的降低。然而, 这种关系是可塑的, 因为水稻最终的株高和分蘖数取决于许多内源和环境因素(如植物激素信号)[5]。赤霉素(gibberellic acid, GA)与其他植物激素如生长素之间的相互作用在控制植物株高方面起着重要作用[6]。许多矮化突变体缺乏赤霉素生物合成或感知能力[7]。例如, dwl1是一个矮秆水稻的新突变体, 其对GA不敏感[8]; 矮秆基因D-h可能参与GA信号通路[9]。水稻分蘖也与内源激素关系密切, DWT1是控制水稻分蘖生长所必需的, 其表达水平与GA信号转导相关[10]。此外, 水稻雄性不育也被报道与内源激素密切相关[11]。
根据天根生化科技(北京)有限公司提供的总RNA提取纯化试剂盒说明书进行总RNA的提取。cDNA合成试剂盒由宝日医生物技术(北京)有限公司生产。采用2-ΔΔCT方法分析基因表达的相对变化[19]。所用的qRT-PCR引物列于附表2。
通过扫描电镜对sr10的倒一叶叶肉细胞观察发现, sr10的叶面表皮和背面保卫细胞都变窄并呈现出拉伸的状态(图2-a~d), 这可以很好地解释sr10叶片变长和变窄的原因。此外, sr10的鞘部细胞明显长于WT (图2-e~h), 因此sr10表现为茎杆显著变长。利用石蜡切片技术观察了灌浆期WT和sr10倒一节间横切面的细胞状态, 发现与WT相比, sr10的茎明显变细, 维管束明显变少, 约减少38.68% (图2-i, j)。
以F2群体中990个突变植株中的229个单株作为初定位群体, 发现目的基因与3号染色体上的分子标记ZTQ67存在连锁关系。对标记ZTQ67两侧相邻的引物进行进一步分析, 最终将目的基因初步定位于ZTQ67和LIND16之间。进一步扩大群体和开发新的分子标记(附表2), 最终将SR10定位于标记LIND12和28.5~4之间, 物理距离为175.7 kb (图5)。区间内有20个注释基因(附表4), 其中有2个已克隆基因, 但测序并未发现任何差异。
具有GA生物合成缺陷的植物表现出典型的GA缺陷表型, 如矮化、根生长受抑制和雄性不育, GA3促进茎伸长, 但抑制分蘖[42]。与WT相比, sr10叶片中GA3水平升高, 因此sr10茎变细, 分蘖减少。过表达GA2oxs是降低转基因植物中GA水平的一种简单方法[43]。因此, GA2oxs表达的降低会导致GA水平的升高。sr10中OsGA2ox1和OsGA2ox4表达水平极显著降低, 这可能是sr10中GA3水平升高的原因之一。GA3下调OsGA3ox2的表达[44], sr10中OsGA3ox2的表达量明显降低, 这可能是GA3水平升高引起的。OsGA20ox2/SD1蛋白引导赤霉素(主要是GA4)的合成[45], GA4主要在植物生殖生长中发挥作用, 因此, Ga2ox1和OsGA20ox2表达的下调极为显著, 可能影响sr10雄性生殖器官的发育, 导致表型完全不育。
本文的其它图/表
-
 表S1
本研究所设计的分子标记
表S1
本研究所设计的分子标记
-
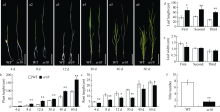 图1
sr10的表型鉴定
图1
sr10的表型鉴定
a1~a6: 4~60 d的WT和sr10的表型观察, 标尺分别为17.5、41、69.2、102、191和309 mm; b: 4~60 d的WT和sr10的株高; c: 4~60 d的WT和sr10的根长; d: 成熟期WT和sr10的叶长; e: 成熟期WT和sr10的叶宽; f: WT和sr10的分蘖数; First: 倒一叶; Second: 倒二叶; Third: 倒三叶; *: P < 0.05; **: P < 0.01。
-
 图2
sr10的细胞学观察
图2
sr10的细胞学观察
a: WT的叶片上表皮, 标尺为35 μm; b: sr10的叶片上表皮, 标尺为35 μm; c: WT的叶片下表皮, 标尺为35 μm; d: sr10的叶片的下表皮, 标尺为35 μm; e: WT的鞘外壁, 标尺为35 μm; f: sr10的鞘外壁, 标尺为35 μm; g: WT的鞘内壁, 标尺为35 μm; h: sr10的鞘内壁, 标尺为35 μm; i: WT与sr10的倒一节间横截面, 标尺为1.1 mm; j: WT和sr10的维管束数目; 白色箭头用于指示保卫细胞, 红色箭头用于指示细胞长度, 红色椭圆用于指示维管束; **: P < 0.01。
-
 图3
sr10的育性鉴定
图3
sr10的育性鉴定
a: WT和sr10的小穗, 标尺为2.1 mm; b, c: WT和sr10的花药, 标尺为2.8 mm (b)和3.5 mm (c); d: WT的花粉I2-KI染色, 标尺为115 μm; e: sr10的花粉I2-KI染色, 标尺为115 μm; f: WT和sr10的花粉育性统计; g: WT和sr10的结实率; **: P < 0.01。
-
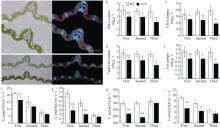 图4
sr10的叶绿素含量和光合指标的测定
图4
sr10的叶绿素含量和光合指标的测定
a: WT和sr10叶片的冷冻切片和荧光观察, Bar: 26 μm; b: 叶绿素a含量; c: 叶绿素b含量; d: 总叶绿素含量; e: 类胡萝卜素含量; f: 净光合速率(Pn); g: 气孔导度(Gs); h: 细胞间CO2浓度(Ci); i: 蒸腾速率(Tr); First: 倒一叶; Second: 倒二叶; Third: 倒三叶; *: P < 0.05; **: P < 0.01。
-
 表S3
ssr1的遗传分析
表S3
ssr1的遗传分析
-
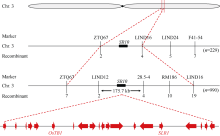 图5
水稻3号染色体上SR10的分子定位
图5
水稻3号染色体上SR10的分子定位
N = 229: 用于初定位的F2隐性群体; n = 990: 用于精细定位的F2隐性群体。
-
 表S4
定位区间内的注释基因
表S4
定位区间内的注释基因
-
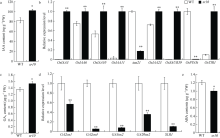 图6
sr10中激素含量的测定及相关基因的表达分析
图6
sr10中激素含量的测定及相关基因的表达分析
|