玉米小籽粒突变体mn-Mu的基因克隆与转录组分析
丁孟丽, 王茹茵, 施栋晟, 李莹博, 雷洁, 陈洪宇, 申清文, 王桂凤
作物学报
2023, 49 ( 11):
3122-3130.
DOI: 10.3724/SP.J.1006.2023.23076
玉米籽粒大小是影响产量形成的关键因素。本研究鉴定了一个转座子随机插入的小籽粒突变体mn-Mu; 该突变体相较野生型籽粒变小、种皮皱缩、淀粉含量下降, 而醇溶蛋白含量升高。石蜡切片观察发现mn-Mu突变体胚乳发育迟缓, 胚乳基底转移层细胞发育缺陷。遗传分析表明mn-Mu是由隐性单基因控制的突变, 通过图位克隆将突变基因定位在2号染色体57.83~61.91 Mb的区间, 其中已克隆的编码细胞壁转化酶的Zm00001d003776 (Miniature 1, Mn1)基因在第5个外显子上存在一个1442 bp的转座子插入。等位测试证实, mn-Mu为一个新的Mn1基因等位突变体。转录组分析表明, Mn1基因功能缺失影响碳水化合物代谢、储藏物质积累、糖基转移酶活性、细胞壁生物合成和细胞周期调控等生物学过程。本研究鉴定的新的mn1等位突变体为深入解析籽粒发育的分子调控网络提供了新的遗传材料。
引物名称
Primer name | 正向引物
Forward sequence (5'-3') | 反向引物
Reverse sequence (5'-3') | | Indel-26.11 | ACTTGCCTGCTGCGACTGG | TCCTGCCCGTCCCGACAG | | Indel-34.89 | TCGTGGCTGGCTGGAGTG | CGGGAAATCGGGTTGTTGATTG | | Indel-43.19 | TGGTAGGCAGGGCGTTGG | TGTCCGTGTAGACTGTAGGAAC | | Indel-53.27 | GGGAGAGCATCGACAGATACTG | GACAATGACTTCGTACCTTCGG | | Indel-55.89 | GCCGCACACACCCTATGAAG | AGCGTGCATGTATCTGGAAGTG | | Indel-57.83 | GCAATCCCCTTGTCCTGAAAAG | CTTCCAACGCAGCAGCAATG | | Indel-61.91 | AGGTCAACCATCGAATCGAAGC | ATCTGCATGGTTCAGAGTCTCC | | Indel-83.16 | TCCATCTATGGGGAGCGAGTAC | GCAGTCCGTGACGACAACC | | PDC1R/2F | GCAACGGTGCAAGTGAACAA | GCGGTACGACTACTACACCG | | PDC1F/2R | GTCGTAAGTTTCGCTTCGGC | TCGTAGAACGTCTTGGACGC |
View table in article
表1
基因定位及克隆引物序列
正文中引用本图/表的段落
玉米籽粒大小是影响产量形成的关键因素。本研究鉴定了一个转座子随机插入的小籽粒突变体mn-Mu; 该突变体相较野生型籽粒变小、种皮皱缩、淀粉含量下降, 而醇溶蛋白含量升高。石蜡切片观察发现mn-Mu突变体胚乳发育迟缓, 胚乳基底转移层细胞发育缺陷。遗传分析表明mn-Mu是由隐性单基因控制的突变, 通过图位克隆将突变基因定位在2号染色体57.83~61.91 Mb的区间, 其中已克隆的编码细胞壁转化酶的Zm00001d003776 (Miniature 1, Mn1)基因在第5个外显子上存在一个1442 bp的转座子插入。等位测试证实, mn-Mu为一个新的Mn1基因等位突变体。转录组分析表明, Mn1基因功能缺失影响碳水化合物代谢、储藏物质积累、糖基转移酶活性、细胞壁生物合成和细胞周期调控等生物学过程。本研究鉴定的新的mn1等位突变体为深入解析籽粒发育的分子调控网络提供了新的遗传材料。
已有研究表明Mn1单基因突变引起的改变具有多效性。Lowe和Nelson首次分离到mn1突变体, 隐性纯合突变体mn1-1籽粒易于区分, 其为种皮折皱呈纸状的小籽粒, 成熟时种子重量约为正常(Mn1)种子重量的1/5[11]。发育中的mn1突变籽粒胎座-合点区(placento-chalazal region, PC)细胞退化, 导致在籽粒小穗柄(pedicel, PED)母体组织的维管束和胚乳之间形成间隙, 且胚乳基底转移层(basal endosperm transfer layer, BETL)细胞壁内增生发育受阻[13,16]。相比野生型, mn1突变体的胚乳细胞数量减少、细胞体积变小[17]。随后的研究表明mn1突变体内生长素及细胞分裂素含量较野生型大幅降低[14,18??-21], 其胚乳和胚中蔗糖、葡萄糖、果糖及山梨醇含量相比野生型均有不同程度的下降[22-23]。这些研究表明Mn1参与母体组织到子代组织的蔗糖卸载过程, 在籽粒发育中发挥着重要作用。此外, 超表达Mn1可以显著改良玉米籽粒灌浆, 从而大幅提高籽粒产量[24]。
取F2分离群体的成熟果穗上野生型与突变籽粒各12粒, 用TPS法抽提胚乳基因组DNA[25], 并分别等量混合以构建突变体DNA池和野生型DNA池, 利用实验室已有的覆盖玉米全基因组的240个InDel (insertion/deletion) 标记, 对这2个DNA混池分别进行扩增, 筛选在2个DNA混池之间具有多态性的分子标记, 并进行连锁分析。通过Gramene网站(http://www.gramene.org/)提供的玉米基因组DNA序列在2号染色体26.11~83.16 Mb区间内开发新的InDel标记(表1), 用于mn-Mu候选基因的定位克隆, InDel标记名称中数字代表该标记所在染色体上的物理位置。
根据mn-Mu基因的定位区间, 在Gramene网站检索该区间内基因, 结合文献报道发现Zm00001d003776 (Mn1)基因为已报道的籽粒发育相关基因[12]。为了探究mn-Mu的籽粒缺陷表型是否由Mn1基因功能缺失导致, 以自交系B73中的Mn1基因序列为参考, 设计了覆盖Mn1全基因组的2对引物(表1), 分别扩增mn-Mu野生型和突变体的Mn1基因片段并测序。通过鉴定并种植mn1基因突变体(3807O, mn*-N378C)杂合体与mn-Mu的杂合体, 将2个材料进行正反交, 并对成熟果穗进行表型观察。
将mn-Mu突变体杂合子与自交系郑58杂交以产生遗传群体, 其F2代的成熟果穗上面呈现正常籽粒与缺陷籽粒表型3︰1的分离规律(χ2<3.84) (图1-A和表2), 表明mn-Mu为单基因控制的隐性遗传突变。与野生型相比, 成熟的mn-Mu籽粒较小, 胚乳发育不良、胚凹陷, 胚乳外围呈玻璃质, 种皮折皱松散, 且mn-Mu突变体籽粒粒长、粒宽、粒厚相较野生型均降低(图1-B~E), 其百粒重仅为野生型的26.82% (图1-F)。
为了克隆mn-Mu突变基因, 我们将mn-Mu/+杂合植株与自交系郑58杂交, 获得F2分离群体用于基因定位。利用240个覆盖玉米10对染色体的InDel标记对突变体DNA池和野生型DNA池进行筛选, 将mn-Mu突变基因初步定位在2号染色体。随后利用F2群体中的587个突变籽粒将目的基因定位到2号染色体57.83~61.91 Mb范围约4.08 Mb大小区间内, 2端分别有1个和3个交换籽粒(图4-A)。基于玉米基因组数据库信息, 该区间内包含已发表的Mn1 (Zm00001d003776), 鉴于mn-Mu与mn1突变体表型相似, 故将该基因作为候选基因并对其进行后续分析。
A: 玉米mn-Mu的图位克隆。n: 定位所用的群体数目, 与InDel标记相对应的数值为交换籽粒数目; B: Mn1基因结构示意图。三角符号代表mn-Mu中转座子插入位置; C: Mn1基因DNA全长扩增。M: DNA分子量标记; WT: 野生型; Z58: 自交系郑58对照。
为了验证mn-Mu突变体是否由Mn1基因突变导致, 我们设计了覆盖Mn1全基因组的2对引物PDC1F/2R和PDC1R/2F, 分别扩增野生型和mn-Mu突变体的Mn1基因片段。PDC1F/2R引物扩增产物大小为1670 bp, 在野生型与mn-Mu突变体间没有差异; PDC1R/2F引物以野生型DNA为模板获得1524 bp大小片段, 而以mn-Mu突变体DNA为模板扩增产物大小为2966 bp (图4-C)。由于mn-Mu为转座子插入突变体, 故对扩增出有差异的产物进行测序分析, 结果表明mn-Mu突变体中Mn1基因的第5个外显子上存在1442 bp的片段插入(图4-B)。序列比对分析表明该插入片段为来源于 Bronze 1座位的转座子。
为了验证 Mn1 基因上转座子的插入是mn-Mu的突变本质, 利用实验室已确定的mn1基因突变体(3807O, mn*-N378C)杂合体与mn-Mu杂合突变体进行正反交。结果显示杂交果穗上均呈现正常和突变籽粒3∶1的分离规律(图5-A, B), 等位测试结果表明mn-Mu是mn1的等位突变体。已报道的Mn1基因突变体多为EMS诱变获得[14,27], 而mn-Mu突变体由转座子插入Mn1基因导致, 因此mn-Mu为一个新的Mn1基因等位突变体。
A: mn-Mu/+ × mn1/+杂交果穗表型, 标尺为1 cm; B: mn1/+ × mn-Mu/+杂交果穗表型, 标尺为1 cm。
已有研究分析了Mn1突变对籽粒中糖代谢、激素含量的影响, 并通过蛋白组学的研究揭示了Mn1在BETL发育及籽粒发育过程中的作用机制[18,22-23,28]。然而糖与激素作为信号分子, 其信号转导过程涉及广泛的基因表达调控, 但目前仍未有基于转录组水平解析Mn1功能的报道。为了研究mn-Mu突变在籽粒发育过程中对转录组的影响, 我们使用授粉后15 d杂合果穗上共分离的野生型和mn-Mu突变籽粒进行RNA-seq分析。与野生型相比, 在mn-Mu中共鉴定出1357个差异表达基因, 包括868个上调表达基因和489个下调表达基因(图6-A)。对差异表达基因进行KEGG富集分析发现, 遗传信息处理(genetic information processing)、碳水化合物代谢(carbohydrates metabolic)、DNA复制与修复(replication and repair)过程、代谢(metabolism)与次级代谢物生物合成(biosynthesis of other secondary metabolites)途径被显著富集(图6-B)。
对差异表达基因进行GO富集分析, 结果表明, 与代谢途径(metabolic process)、碳水化合物转运(carbohydrate transport)、蛋白复合体寡聚化(protein complex oligomerization)、脂滴(lipid droplet)和脂肪酸结合(fatty acid binding)相关过程被显著富集(图6-C), 表明Mn1基因的缺失与籽粒储藏物质的积累有关。UDP-糖基转移酶活性(UDP-glycosyltransferase activity)、糖基转移酶活性(glycosyltransferase activity)、转移己糖基团活性(transferase activity, transferring hexosyl groups)、糖基水解酶活性(hydrolase activity, acting on glycosyl bonds)等过程也被富集(图6-C), 这可能与Mn1作为细胞壁转化酶的活性有关, 在mn1突变体中蔗糖卸载过程受阻, 胚乳中蔗糖、葡萄糖与果糖含量相比野生型均有下降, 可能影响下游糖基转移过程[23,29]。此外, 多个与细胞壁功能相关条目也被富集, 包括植物型细胞壁(plant-type cell wall)、细胞壁大分子物质代谢过程(cell wall macromolecule catabolic process)、多聚糖代谢过程(polysaccharide catabolic process) (图 6-C), 可能与mn-Mu突变体BETL细胞壁内增生发育缺陷直接相关。细胞周期相关的复制前起始复合物装配(pre-replicative complex assembly involved in nuclear cell cycle DNA replication)、DNA复制起始(DNA replication initiation)、DNA复制(DNA replication)、姊妹染色单体的结合(sister chromatid cohesion)、3°-5° DNA解旋酶活性(3°-5° DNA helicase activity)这些与DNA复制及细胞周期调控相关的过程也被富集(图 6-C), 表明Mn1在调控细胞增殖过程中发挥功能。后续通过遗传材料深入解析mn-Mu转录组中差异表达基因的生物学功能有望丰富玉米籽粒发育的分子调控网络。
Mn1编码BETL特异表达的细胞壁转化酶INCW2, 已报道的多个mn1突变体均导致籽粒发育缺陷。mn1-1等位基因是由自然突变引起的, 该突变导致Mn1基因表达完全丧失, 授粉后12 d的mn1-1籽粒中总转化酶活性损失98%, 成熟种子重量减少近70% [30]。半显性mn1-89等位基因是由EMS诱导的碱基变化产生, 该碱基变化导致脯氨酸到亮氨酸的替换, 并可能影响INCW2蛋白的稳定性[27]。mn1-89籽粒总转化酶活性损失94%, 种子重量减少33% [13,27]。mn-Mu突变体为Mn1基因第5个外显子上一个转座子插入导致, 该突变体表型与mn1-1相似, 其成熟籽粒较小、种皮折皱呈纸状, 种子重量减少70% (图1), BETL细胞发育缺陷, 细胞壁内增生不明显, 且在胚乳与母体组织维管系统间存在空隙(图2-B)。mn-Mu突变体表现为典型的mn1缺失突变表型, 由于其为转座子插入突变体, 使用PDC1R/PDC2F共显性标记可以方便地鉴定其基因型(图4-C), 相比mn1-1和mn1-89的基因型鉴定更为便捷, 为深入研究Mn1基因功能提供了新的遗传材料。
催化蔗糖水解是细胞壁转化酶的主要生化功能, 代谢释放的己糖既是母体组织供给子代细胞发育的能量物质, 又是重要的信号分子, 协同调控胚乳和胚的发育[31-32]。发育中的mn1突变籽粒基部胚乳中葡萄糖、果糖等己糖含量相比野生型显著降低, 但蔗糖含量增加[19,22-23]。Mn1功能缺失影响籽粒中淀粉的积累[22], 本研究中mn-Mu突变体成熟籽粒中淀粉含量相比野生型也有轻微的降低, 然而醇溶蛋白积累相比野生型却明显增加(图3)。蛋白组分析表明mn1突变体籽粒中碳水化合物代谢相关蛋白普遍表现出较低的积累或糖基化水平[29,33], 本研究通过转录组分析也发现差异表达基因富集于储藏物质代谢途径和糖基转移等过程(图6-C), 这些结果均表明Mn1在籽粒储藏物质积累过程中的重要作用。此外, Mn1功能缺失影响发育籽粒中激素稳态, mn1突变体籽粒中生长素与细胞分裂素含量均比野生型降低, 细胞分裂活性也有降低, 相应地胚乳细胞数目与细胞体积也都下降[17-18], 本研究中转录组分析也表明mn-Mu突变体中DNA复制及细胞周期调控过程受到较大影响(图6-C)。已有研究证实葡萄糖作为信号分子正调控细胞分裂过程[32,34], 因此, 推测Mn1水解产生的己糖在调控籽粒细胞发育过程中发挥重要功能。
细胞壁转化酶负责光合产物的源库转化, 其活性直接影响作物产量。超量表达水稻细胞壁转化酶GIF1 (Grain Incomplete Filling 1)导致种子变小, 而使用栽培稻GIF1自身启动子驱动GIF1的表达可以提高种子产量, 表明水稻灌浆过程中GIF1的表达受到精细的转录调控[38]。番茄中细胞壁转化酶LIN5 (LYCOPERSICUM INVERTASE 5)的活性下降也导致结实减少和种子变小[39], 而使用RNA干扰沉默细胞壁转化酶抑制子INVINH1后, 番茄细胞壁转化酶活性明显提升, 且种子变大, 果实己糖含量提高[40]。在玉米中通过CaMV 35S强启动子超量表达拟南芥AtGIF1、水稻OsGIF1或玉米Mn1均可以显著增加玉米籽粒灌浆, 提高籽粒产量[24]。细胞壁转化酶的转录调控在拟南芥和水稻中已有部分研究[41-42], 后续开展玉米中Mn1基因表达的转录调控与翻译后调控研究有望揭示籽粒产量形成的分子调控网络。
本文的其它图/表
-
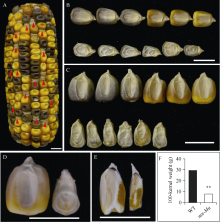 图1
玉米mn-Mu籽粒的表型特征
图1
玉米mn-Mu籽粒的表型特征
A: F1自交成熟果穗; B: 野生型(上排)和mn-Mu (下排)粒长对比; C: 野生型(上排)和mn-Mu (下排)粒宽对比; D: 单粒野生型(左)和突变体(右)籽粒对比; E: 野生型(左)和mn-Mu (右)籽粒纵切; F: 野生型和mn-Mu籽粒百粒重统计。**表示Student’s t检验在0.01概率水平差异显著, 图中标尺为1 cm。
-
 表2
F2成熟果穗正常和突变籽粒分离比
表2
F2成熟果穗正常和突变籽粒分离比
-
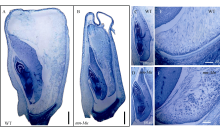 图2
玉米mn-Mu突变体籽粒的组织学观察
图2
玉米mn-Mu突变体籽粒的组织学观察
A: 野生型籽粒, 标尺为1 mm; B: mn-Mu突变体籽粒, 标尺为1 mm; C: 野生型籽粒胚, 标尺为1 mm; D: mn-Mu突变体籽粒胚, 标尺为500 μm; E: 野生型籽粒BETL观察, 标尺为200 μm; F: mn-Mu突变体籽粒BETL观察, 标尺为200 μm。样品为授粉后18 d发育中籽粒。
-
 图3
玉米mn-Mu突变体籽粒的储藏物质分析
图3
玉米mn-Mu突变体籽粒的储藏物质分析
A: 野生型和mn-Mu籽粒的总淀粉含量测定; B: 野生型和mn-Mu成熟籽粒醇溶蛋白含量对比; C: 野生型和mn-Mu成熟籽粒非醇溶蛋白含量对比。M: 蛋白分子量标记; WT: 野生型; Re1/Re2/Re3代表3个生物学重复。
-
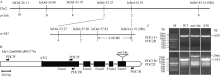 图4
玉米mn-Mu的基因定位与克隆
图4
玉米mn-Mu的基因定位与克隆
A: 玉米mn-Mu的图位克隆。n: 定位所用的群体数目, 与InDel标记相对应的数值为交换籽粒数目; B: Mn1基因结构示意图。三角符号代表mn-Mu中转座子插入位置; C: Mn1基因DNA全长扩增。M: DNA分子量标记; WT: 野生型; Z58: 自交系郑58对照。
-
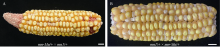 图5
mn-Mu突变体与mn1突变体等位测试
图5
mn-Mu突变体与mn1突变体等位测试
A: mn-Mu/+ × mn1/+杂交果穗表型, 标尺为1 cm; B: mn1/+ × mn-Mu/+杂交果穗表型, 标尺为1 cm。
-
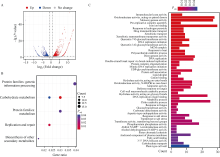 图6
玉米mn-Mu突变体转录组测序分析
图6
玉米mn-Mu突变体转录组测序分析
A: RNA-seq检测mn-Mu差异表达基因; B: 差异表达基因KEGG富集分析; C: 差异表达基因GO富集分析。
|