玉米小籽粒突变体mn-Mu的基因克隆与转录组分析
丁孟丽, 王茹茵, 施栋晟, 李莹博, 雷洁, 陈洪宇, 申清文, 王桂凤
作物学报
2023, 49 ( 11):
3122-3130.
DOI: 10.3724/SP.J.1006.2023.23076
玉米籽粒大小是影响产量形成的关键因素。本研究鉴定了一个转座子随机插入的小籽粒突变体mn-Mu; 该突变体相较野生型籽粒变小、种皮皱缩、淀粉含量下降, 而醇溶蛋白含量升高。石蜡切片观察发现mn-Mu突变体胚乳发育迟缓, 胚乳基底转移层细胞发育缺陷。遗传分析表明mn-Mu是由隐性单基因控制的突变, 通过图位克隆将突变基因定位在2号染色体57.83~61.91 Mb的区间, 其中已克隆的编码细胞壁转化酶的Zm00001d003776 (Miniature 1, Mn1)基因在第5个外显子上存在一个1442 bp的转座子插入。等位测试证实, mn-Mu为一个新的Mn1基因等位突变体。转录组分析表明, Mn1基因功能缺失影响碳水化合物代谢、储藏物质积累、糖基转移酶活性、细胞壁生物合成和细胞周期调控等生物学过程。本研究鉴定的新的mn1等位突变体为深入解析籽粒发育的分子调控网络提供了新的遗传材料。

View image in article
图6
玉米mn-Mu突变体转录组测序分析
A: RNA-seq检测mn-Mu差异表达基因; B: 差异表达基因KEGG富集分析; C: 差异表达基因GO富集分析。
正文中引用本图/表的段落
已有研究分析了Mn1突变对籽粒中糖代谢、激素含量的影响, 并通过蛋白组学的研究揭示了Mn1在BETL发育及籽粒发育过程中的作用机制[18,22-23,28]。然而糖与激素作为信号分子, 其信号转导过程涉及广泛的基因表达调控, 但目前仍未有基于转录组水平解析Mn1功能的报道。为了研究mn-Mu突变在籽粒发育过程中对转录组的影响, 我们使用授粉后15 d杂合果穗上共分离的野生型和mn-Mu突变籽粒进行RNA-seq分析。与野生型相比, 在mn-Mu中共鉴定出1357个差异表达基因, 包括868个上调表达基因和489个下调表达基因(图6-A)。对差异表达基因进行KEGG富集分析发现, 遗传信息处理(genetic information processing)、碳水化合物代谢(carbohydrates metabolic)、DNA复制与修复(replication and repair)过程、代谢(metabolism)与次级代谢物生物合成(biosynthesis of other secondary metabolites)途径被显著富集(图6-B)。
对差异表达基因进行GO富集分析, 结果表明, 与代谢途径(metabolic process)、碳水化合物转运(carbohydrate transport)、蛋白复合体寡聚化(protein complex oligomerization)、脂滴(lipid droplet)和脂肪酸结合(fatty acid binding)相关过程被显著富集(图6-C), 表明Mn1基因的缺失与籽粒储藏物质的积累有关。UDP-糖基转移酶活性(UDP-glycosyltransferase activity)、糖基转移酶活性(glycosyltransferase activity)、转移己糖基团活性(transferase activity, transferring hexosyl groups)、糖基水解酶活性(hydrolase activity, acting on glycosyl bonds)等过程也被富集(图6-C), 这可能与Mn1作为细胞壁转化酶的活性有关, 在mn1突变体中蔗糖卸载过程受阻, 胚乳中蔗糖、葡萄糖与果糖含量相比野生型均有下降, 可能影响下游糖基转移过程[23,29]。此外, 多个与细胞壁功能相关条目也被富集, 包括植物型细胞壁(plant-type cell wall)、细胞壁大分子物质代谢过程(cell wall macromolecule catabolic process)、多聚糖代谢过程(polysaccharide catabolic process) (图 6-C), 可能与mn-Mu突变体BETL细胞壁内增生发育缺陷直接相关。细胞周期相关的复制前起始复合物装配(pre-replicative complex assembly involved in nuclear cell cycle DNA replication)、DNA复制起始(DNA replication initiation)、DNA复制(DNA replication)、姊妹染色单体的结合(sister chromatid cohesion)、3°-5° DNA解旋酶活性(3°-5° DNA helicase activity)这些与DNA复制及细胞周期调控相关的过程也被富集(图 6-C), 表明Mn1在调控细胞增殖过程中发挥功能。后续通过遗传材料深入解析mn-Mu转录组中差异表达基因的生物学功能有望丰富玉米籽粒发育的分子调控网络。
催化蔗糖水解是细胞壁转化酶的主要生化功能, 代谢释放的己糖既是母体组织供给子代细胞发育的能量物质, 又是重要的信号分子, 协同调控胚乳和胚的发育[31-32]。发育中的mn1突变籽粒基部胚乳中葡萄糖、果糖等己糖含量相比野生型显著降低, 但蔗糖含量增加[19,22-23]。Mn1功能缺失影响籽粒中淀粉的积累[22], 本研究中mn-Mu突变体成熟籽粒中淀粉含量相比野生型也有轻微的降低, 然而醇溶蛋白积累相比野生型却明显增加(图3)。蛋白组分析表明mn1突变体籽粒中碳水化合物代谢相关蛋白普遍表现出较低的积累或糖基化水平[29,33], 本研究通过转录组分析也发现差异表达基因富集于储藏物质代谢途径和糖基转移等过程(图6-C), 这些结果均表明Mn1在籽粒储藏物质积累过程中的重要作用。此外, Mn1功能缺失影响发育籽粒中激素稳态, mn1突变体籽粒中生长素与细胞分裂素含量均比野生型降低, 细胞分裂活性也有降低, 相应地胚乳细胞数目与细胞体积也都下降[17-18], 本研究中转录组分析也表明mn-Mu突变体中DNA复制及细胞周期调控过程受到较大影响(图6-C)。已有研究证实葡萄糖作为信号分子正调控细胞分裂过程[32,34], 因此, 推测Mn1水解产生的己糖在调控籽粒细胞发育过程中发挥重要功能。
BETL位于胚乳最底部, 紧邻母体维管组织, 主要负责将氨基酸、蔗糖和单糖等营养物质从母体组织运输到籽粒中, 因此其对玉米籽粒的生长发育至关重要[35]。BETL向内生长的细胞壁形成壁内突, 增加了质膜的表面积, 从而提高了这些细胞的运输能力[36]。Mn1编码的INCW2蛋白免疫定位于BETL细胞壁, Mn1基因突变引起BETL细胞发育受到影响, 细胞壁内增生产生缺陷[28](图2)。在mn1突变体中, 与BETL发育相关的Myb转录因子ZmMRP-1和BETL标记基因BETL-2的表达量相比野生型显著提高[37], 许多同细胞壁发育相关的基因也在mn-Mu突变体籽粒差异表达基因中被富集(图6), 表明细胞壁转化酶活性调控的糖稳态在细胞壁结构及BETL发育中发挥重要作用。
本文的其它图/表
-
 表1
基因定位及克隆引物序列
表1
基因定位及克隆引物序列
-
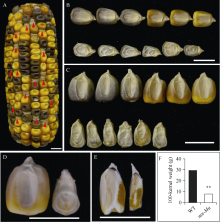 图1
玉米mn-Mu籽粒的表型特征
图1
玉米mn-Mu籽粒的表型特征
A: F1自交成熟果穗; B: 野生型(上排)和mn-Mu (下排)粒长对比; C: 野生型(上排)和mn-Mu (下排)粒宽对比; D: 单粒野生型(左)和突变体(右)籽粒对比; E: 野生型(左)和mn-Mu (右)籽粒纵切; F: 野生型和mn-Mu籽粒百粒重统计。**表示Student’s t检验在0.01概率水平差异显著, 图中标尺为1 cm。
-
 表2
F2成熟果穗正常和突变籽粒分离比
表2
F2成熟果穗正常和突变籽粒分离比
-
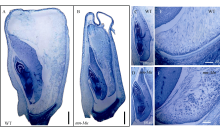 图2
玉米mn-Mu突变体籽粒的组织学观察
图2
玉米mn-Mu突变体籽粒的组织学观察
A: 野生型籽粒, 标尺为1 mm; B: mn-Mu突变体籽粒, 标尺为1 mm; C: 野生型籽粒胚, 标尺为1 mm; D: mn-Mu突变体籽粒胚, 标尺为500 μm; E: 野生型籽粒BETL观察, 标尺为200 μm; F: mn-Mu突变体籽粒BETL观察, 标尺为200 μm。样品为授粉后18 d发育中籽粒。
-
 图3
玉米mn-Mu突变体籽粒的储藏物质分析
图3
玉米mn-Mu突变体籽粒的储藏物质分析
A: 野生型和mn-Mu籽粒的总淀粉含量测定; B: 野生型和mn-Mu成熟籽粒醇溶蛋白含量对比; C: 野生型和mn-Mu成熟籽粒非醇溶蛋白含量对比。M: 蛋白分子量标记; WT: 野生型; Re1/Re2/Re3代表3个生物学重复。
-
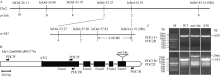 图4
玉米mn-Mu的基因定位与克隆
图4
玉米mn-Mu的基因定位与克隆
A: 玉米mn-Mu的图位克隆。n: 定位所用的群体数目, 与InDel标记相对应的数值为交换籽粒数目; B: Mn1基因结构示意图。三角符号代表mn-Mu中转座子插入位置; C: Mn1基因DNA全长扩增。M: DNA分子量标记; WT: 野生型; Z58: 自交系郑58对照。
-
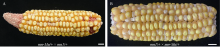 图5
mn-Mu突变体与mn1突变体等位测试
图5
mn-Mu突变体与mn1突变体等位测试
A: mn-Mu/+ × mn1/+杂交果穗表型, 标尺为1 cm; B: mn1/+ × mn-Mu/+杂交果穗表型, 标尺为1 cm。
|