茶树己糖激酶基因CsHXK2的启动子克隆及表达特性分析
李娜娜, 刘莹, 张豪杰, 王璐, 郝心愿, 张伟富, 王玉春, 熊飞, 杨亚军, 王新超
作物学报
2020, 46 ( 10):
1628-1638.
DOI: 10.3724/SP.J.1006.2020.94166
植物己糖激酶是双功能蛋白, 具有磷酸化己糖和介导糖信号的关键性作用。前期研究中, 我们从茶树中克隆获得4个己糖激酶基因, 其中CsHXK2基因编码492个氨基酸残基, 与拟南芥AtHXK3、番茄LeHXK4归为Type A类HXKs。利用RT-PCR技术, 克隆获得长度为2029 bp的CsHXK2基因启动子。CsHXK2基因可能受到光照、低温、病原菌、糖和多种激素等信号的调控, 且可能特异性表达于叶、花、种子、根系、腋芽等组织。CsHXK2蛋白定位于叶绿体内。酵母突变体功能互补试验表明, 去除叶绿体转运信号肽的CsHXK2成熟蛋白具有葡萄糖和果糖磷酸化活性。茶树组织特异性表达分析显示, CsHXK2基因在根和茎中表达量最高, 而在老叶中表达量最低。CsHXK2基因的表达受低温胁迫而显著下调, 经炭疽菌侵染的茶树叶片内CsHXK2基因的表达也受到显著抑制, 而外源赤霉素(GA3)处理的茶树叶片内CsHXK2基因表达显著上调。本研究结果表明, CsHXK2基因在茶树的生长发育过程和逆境胁迫响应中发挥重要的调控作用。
序列名称
Sequence name | 上游引物序列
Forward primer (5'-3') | 下游引物序列
Reverse primer (5'-3') | 用途
Application | | CsPTB ORF | ACCAAGCACACTCCACACTATCG | TGCCCCCTTATCATCATCCACAA | 荧光定量PCR
qRT-PCR | CsHXK2 promoter
| GATTTTGAGTGCATAAATTGAAAACATCGAG | TTGAAACAGAGCGAGAGCGAGA | 启动子扩增
Promoter amplification | | CsHXK2 ORF | ATTTCCGAGTGCTGAGGGTGCAA | TTTCCAGCCGTTCCAGAGACTGC | 荧光定量PCR
qRT-PCR | | CsHXK2 ORF | GGTACCATGTCCGTCACCGTAAGTCCA | GGATCCAAAATTGTGTTCATACTTCGAGTTTGT | 亚细胞定位
Subcellular localization | | CsHXK2 ORF-cTP | GGTACCATGAACGTTGTCACCGTCGCC | TCTAGAAAAATTGTGTTCATACTTCGAGTT | 亚细胞定位
Subcellular localization | | CsHXK2 ORF | ACTAGTATGTCCGTCACCGTAAGTCCA | CCCGGGCTAAAAATTGTGTTCATACTT | 酵母表达
Yeast expression | | CsHXK2 ORF-cTP | ACTAGTATGAACGTTGTCACCGTCGCC | CCCGGGCTAAAAATTGTGTTCATACTT | 酵母表达
Yeast expression | | pDR196 | CTCTTTTATACACACATTCA | CTGGCGAAGAAGTCCAAAGC | 菌液PCR
Colony PCR |
View table in article
表1
引物信息
正文中引用本图/表的段落
目前, 对植物己糖激酶的研究主要集中于HXK基因在植物生长发育过程中的作用, 关于其在抗逆胁迫方面的研究则相对较少。组织内超表达拟南芥AtHXK1基因, 植株表现出生长抑制、叶绿素含量减少、光合作用减弱、可溶性固形物和淀粉含量降低、叶片加速衰老以及光合作用相关基因CAB1和RBCS表达下调等现象[15,16]。利用拟南芥葡萄糖非敏感突变体(gin2)研究AtHXK1基因的生理功能[17], 缺乏HXK1葡萄糖催化功能的突变体仍具有多种信号功能, 可调控光合作用基因CAB1和RBCS表达、细胞增殖、根叶生长、开花和衰老等, gin2突变体表现出对生长素(IAA)不敏感而对细胞分裂素2IP超敏感, 表明植物利用HXK为葡萄糖感受体, 使得养分、光照和激素信号网络相互关联, 从而调控植物的生长与发育。通过RNAi技术抑制BnHXK9基因在油菜籽苗内的表达, 植株具有生长迟缓、矮化、叶片卷曲特征, 表明BnHXK9参与植物的生长发育过程[7]。胁迫过程中, NbHXK1、AtHXK1和AtHXK2基因能响应甲基紫精和病原体侵染诱导的氧化胁迫, 高水平的HXK能增强对氧化胁迫的抵抗力[18]; AtHXK2和AtHXKL3基因能在低温、高盐处理下表达上调[14]; 麻风树JcHXK1、JcHXK2和JcHKL1基因在叶片内同样能响应低温而诱导表达[9]; 油菜BnHXK1、BnHXK3和BnHXK9基因能响应核盘菌在抗性品种内的侵染而表达显著上调[7]。
根据已公布的茶树基因组信息[20], 查找获得CsHXK2基因上游启动子模板序列, 并设计扩增引物(表1)。以‘龙井43’组织DNA为模板, 使用高保真酶PrimeSTAR HS DNA Polymerase (TaKaRa, 中国)进行PCR扩增。PCR产物经琼脂糖凝胶电泳、目的条带回收纯化、连接至PMD18-T载体、转化至感受态细胞后, 取适量转化产物涂板于LB+氨苄青霉素(Amp)的固体培养基, 随机挑选阳性单克隆送测序, 获得目的启动子序列。在New PLACE数据库(A Database of Plant Cis-acting Regulatory DNA Elements; https://www.dna.affrc.go.jp/PLACE/?action=newplace)[21]预测分析启动子序列所含的顺式作用元件。
以‘龙井43’组织cDNA为模板, 表1对应序列为载体构建引物, 利用高保真酶PrimeSTAR HS DNA Polymerase (TaKaRa, 中国)进行qRT-PCR, 扩增片段经琼脂糖凝胶电泳后切割、回收, 连接至pEASY-Blunt Zero中间载体(CB501, Transgen, 中国), 连接反应详见说明书。连接产物转化至感受态细胞DH5α, 菌液涂板于LB+卡那霉素(Kan)的固体培养基上, 筛选阳性单克隆菌液送测序。
采用实时荧光定量PCR法(qRT-PCR)检测CsHXK2在茶树不同组织器官内和不同处理下的表达情况。基于CsHXK2基因序列[19], 在NCBI的Primer-BLAST网页(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计CsHXK2 荧光定量引物(表1), 并用常规qRT-PCR和琼脂糖凝胶电泳检测引物的特异性。选用CsPTB作为内参基因[23]; 使用LightCycler 480 SYBR Green I Master试剂和LightCycler 480 II仪器(Roche, 瑞士)进行qRT-PCR反应。采用2-?CT或2-??CT法[24]计算该基因相对表达水平。
利用New PLACE数据库分析该段2029 bp序列所含的关键顺式作用调控DNA元件。由表2可知, 该启动子含有多种调控茶树响应外在信号的顺式作用元件, 如感知光照、热击、氧气、病菌、创伤、低温、干旱的响应元件, 即-10PEHVPSBD、GATABOX、CCAATBOX1、CURECORECR、ELRECOREPCRP1、LTRE1HVBLT49、MYCCONSENSUSAT等; 如响应生长素、细胞分裂素、水杨酸、乙烯、赤霉素、脱落酸的作用元件, 即ARFAT、ARR1AT、ELRECOREPCRP1、ERELEE4、GARE1OSREP1、MYB1AT等; 多个糖信号响应元件, 即MYBGAHV、SREATMSD、SURE1STPAT21、WBOXHVISO1; 且有ARF、Dof、WRKY、MYB、MYC、RAV1转录因子结合位点, 即ARFAT、DOFCOREZM、ELRECOREPCRP1、MYB1AT、MYCCONSENSUSAT、RAV1AAT等。此外, 还具有调控叶肉、种子、花、根系、腋芽、保卫细胞组织基因表达的元件, 即CACTFTPPCA1、CANBNNAPA、CARGATCON SENSUS、RHERPATEXPA7、SREATMSD、TAAAGSTKST1等。说明茶树CsHXK2基因启动子具备多种调控作用元件, 可能通过参与糖代谢和转导糖信号而调控茶树的生长发育以及逆境胁迫应答。
赤霉素(GA3)作为一种植物激素, 参与调控多种生长发育过程。赤霉素信号途径与糖信号之间存在着紧密关联, 其中HXKs是激素与糖联系的一个关键元件。离体矮牵牛花冠内, GA3对赤霉素诱导基因gip (gibberellin-induced gene)和查尔酮合成酶基因chs (chalcone synthase gene)表达的诱导受到葡萄糖的促进, 但这种葡萄糖引起的促进效果可以被HXK竞争性抑制剂甘露庚酮糖所完全摧毁, 表明HXKs参与的糖磷酸化相关信号转导与赤霉素信号相互作用, 进而诱导矮牵牛花冠发育过程中的基因表达和花青素积累[35]。阿洛糖作为葡萄糖的差向异构体, 能强烈抑制水稻赤霉素依赖性反应, 如第二叶鞘的伸长以及无胚半稻种子α-淀粉酶的诱导, 也能抑制具有赤霉素组成型响应表型的slr1水稻突变体的生长, 而这些抑制能被HXK抑制剂甘露庚酮糖所阻止, 表明阿洛糖通过HXK依赖途径抑制赤霉素信号传导[36]。本研究检测GA3处理的茶树叶片内CsHXK2基因的表达发现, 该基因转录本在处理样品中有显著的诱导富集(图5-D)。表明茶树赤霉素信号途径和CsHXK2基因表达关系密切, 可能与HXK介导的糖信号途径共同调控茶树的生长发育与逆境胁迫响应有关。
本文的其它图/表
-
 图1
茶树CsHXK2基因启动子扩增及序列
图1
茶树CsHXK2基因启动子扩增及序列
A: CsHXK2启动子PCR扩增产物电泳图; B: CsHXK2启动子序列。
-
 表2
茶树CsHXK2基因启动子的主要顺式作用元件
表2
茶树CsHXK2基因启动子的主要顺式作用元件
-
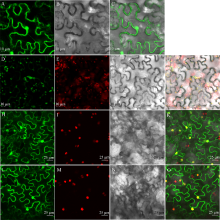 图2
茶树CsHXK2蛋白亚细胞定位
图2
茶树CsHXK2蛋白亚细胞定位
A~C和H~K: 35S::sGFP; D~G: 35S::CsHXK2::sGFP; L~O: 35S::CsHXK2-cTP::sGFP。A, D, H, L: GFP绿色荧光信号; E: 叶绿素自发荧光; I, M: 细胞核RFP红色荧光信号; B, F, J, N: 明场; C, G, K, O: 信号融合。
-
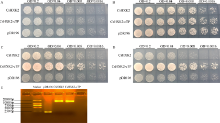 图3
CsHXK2蛋白酵母功能互补验证
图3
CsHXK2蛋白酵母功能互补验证
A: ddH2O; B: 2%半乳糖; C: 2%葡萄糖; D: 2%果糖; E: 酵母转化片段电泳检测。
-
 图4
茶树CsHXK2基因的组织特异性表达模式
图4
茶树CsHXK2基因的组织特异性表达模式
A: 春季‘龙井43’不同组织; B: 秋季‘龙井43’不同组织; C: ‘舒茶早’不同组织。柱上标以不同字母表示数据间的显著性差异(P < 0.05)。
-
 图5
茶树CsHXK2基因在不同处理下的表达分析
图5
茶树CsHXK2基因在不同处理下的表达分析
A: 自然冷驯化; B: 4℃低温及25℃恢复; C: 炭疽菌接种; D: 50 μmol L-1外源GA3处理。柱上标以不同字母表示数据间的显著性差异(P < 0.05)。*表示0.05水平显著; ***表示0.001水平显著。
|